磁共振弥散加权成像在乳腺肿块良恶性鉴别中的应用价值*
刘永天 周彦汝 张 刚
河南中医药大学第一附属医院磁共振科 (河南 郑州 450000)
女性乳腺癌在2020年新发肿瘤中超过肺癌,成为最常见新发恶性肿瘤,也是女性肿瘤相关死亡主要原因[1],早发现、早诊断和早治疗能够有效提高患者生存率[2],因此鉴别乳腺肿块良恶性有重要意义。DWI是乳腺肿块良恶性鉴别诊断的主要手段之一[3],本研究通过对良恶性肿块的DWI信号、ADC信号特征、定量参数ADC值进行对照研究,并应用ROC曲线评价有统计学意义ADC值参数的诊断效能,明确具有最大效能参数的阈值,为鉴别乳腺肿块良恶性提供有价值的辅助依据。
1 资料和方法
1.1 临床资料收集我院2020年8月至2021年8月的乳腺MRI检查451例,通过纳入及排除标准进行病例筛选。
纳入标准:乳腺肿块病变;MRI检查前未经穿刺活检;MRI检查前未经过治疗;MRI检查后取得穿刺或手术病理结果。排除标准:灶点及非肿块病变;男性病例;图像质量差;未取得病理结果。本研究经医学伦理委员会批准。
1.2 MRI检查设备与检查方法使用飞利浦 Ingenia 3.0T MR扫描仪及乳腺专用相控阵线圈进行磁共振检查。患者取俯卧位,前胸壁贴紧乳腺线圈,双乳悬垂于线圈中且无受压变形。扫描方案包括乳腺平扫(T1WI、T2WI序列)、DWI序列和动态对比增强(DCE)序列。DWI序列b值选取0和800 s/mm2。
1.3 MRI图像分析病例资料由经验丰富的两名MRI医师共同分析,协商确定最终诊断结果。乳腺肿块DWI信号与ADC信号特征均与乳腺实质信号对比,DWI信号特征分类包括低信号、等信号、高信号、环形高信号,ADC信号特征分类包括高信号、等信号、低信号、环形低信号。ADC值测定采用绘制ROI的方法,在弥散加权后处理的ADC图上进行,ROI的放置参考弥散加权高信号区以及动态增强强化程度最高的区域,并避开出血、液化坏死区域[4-5]。记录测得的ADC值最大值(ADCmax)、最小值(ADCmin)和均值(ADCmean),测量3次取平均值。ADC值差值(ADCdifference)在SPSS 25.0统计软件中计算取得,计算公式为:ADCdifference=ADCmax-ADCmin。
1.4 统计学方法应用统计软件SPSS 25.0进行数据分析。正态分布计量资料用()表示,采用t检验进行组间比较;偏态分布计量资料用M(P25,P75)表示,采用Mann Whitney U检验;计数资料用百分比(%)表示,采用卡方检验或Fisher确切概率法。检验水准α=0.05,均为双侧检验,P<0.05为差异有统计学意义。采用ROC曲线评价有统计学意义ADC值的诊断效能,并依据最大约登指数,确定具有最大诊断效能参数的阈值、敏感度和特异度。
2 结果
2.1 临床资料乳腺磁共振检查共收集451例,排除非肿块病例115例、灶点状病例113例、男性病人1例、治疗后病例35例、无病理病例96例,最终纳入肿块病例91例,包含51例恶性病例,40例良性病例。51例恶性病例均为浸润性导管癌,其中35例病理分级为Ⅱ级,16例病理分级为Ⅲ级。40例良性病例包含2例良性叶状肿瘤、2例导管内乳头状瘤、25例纤维腺瘤、11例腺病。
2.2 良恶性组间DWI、ADC信号差异性分析良性组肿块DWI信号特征主要表现为高信号(85%),也可见到等信号及低信号表现,恶性组DWI信号特征表现为高信号(72.5%)及环形高信号(27.5%),两组差异有统计学意义(P<0.001);良性组肿块ADC信号特征主要表现为等信号(55%)及高信号(17.5%),恶性组肿块ADC信号表现为低信号(72.5%)及环形低信号(27.5%),两组差异有统计学意义(P<0.001),见表1、图1和图2。
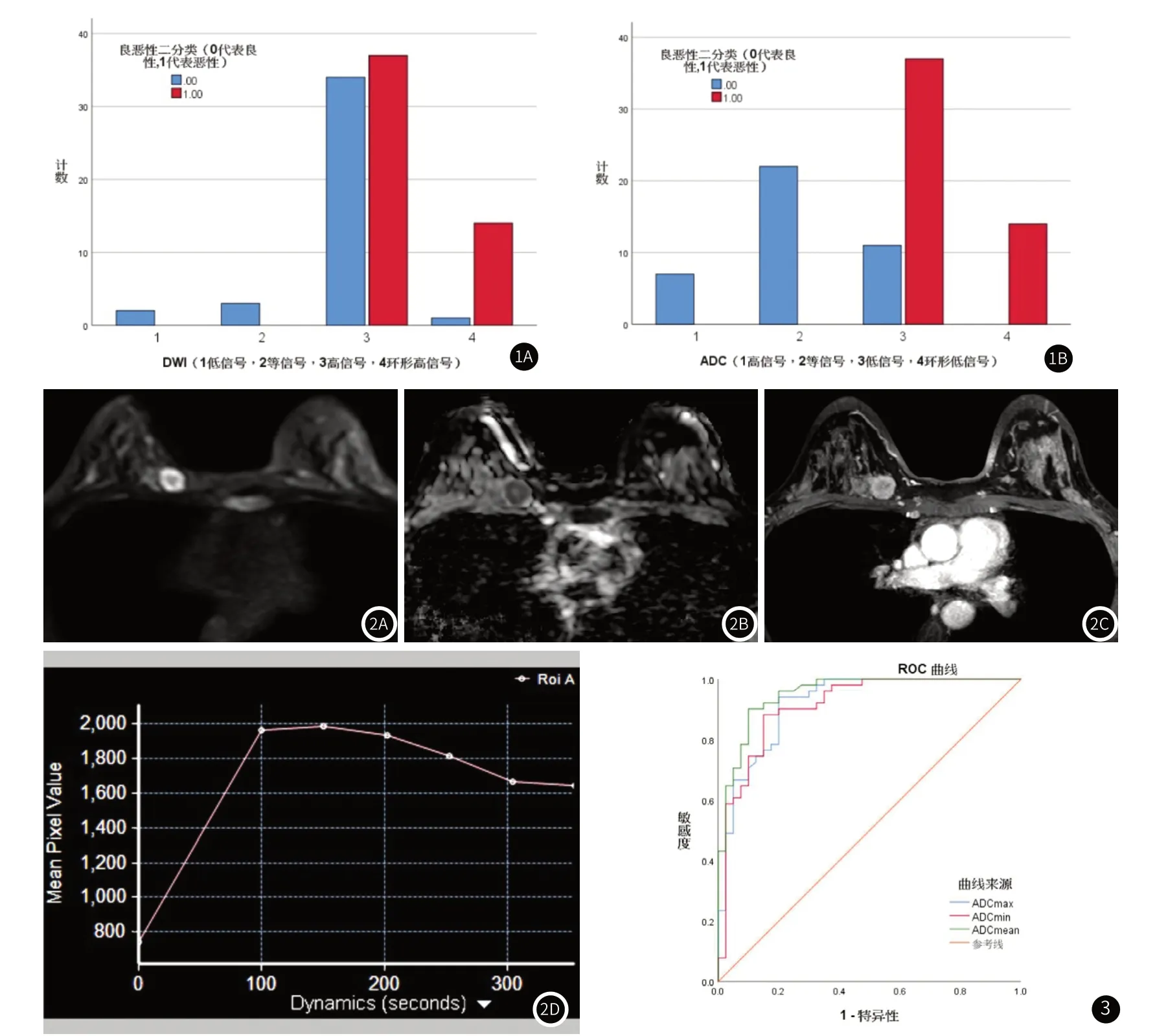
图1 图1A为良恶性肿块DWI信号特征分布图,图1B为良恶性肿块ADC信号特征分布图。图1:良恶性组间DWI信号特征、ADC信号特征分布柱状图。图2 女,31岁,浸润性导管癌Ⅱ级。右乳内上象限肿块,DWI上呈环形高信号(2A),ADC上呈环形低信号(2B),动态对比增强(DCE)呈环形强化(2C),TIC曲线呈流出型(2D)。DWI上环形高信号、ADC上环形低信号、DCE上环形强化,三者环形相匹配。图2:DWI环形高信号、ADC环形低信号、DCE环形强化匹配征。图3 ADCmax、ADCmin、ADCmean ROC曲线,AUC分别为0.919、0.912、0.952。图3:定量参数ADC值ROC曲线分析。
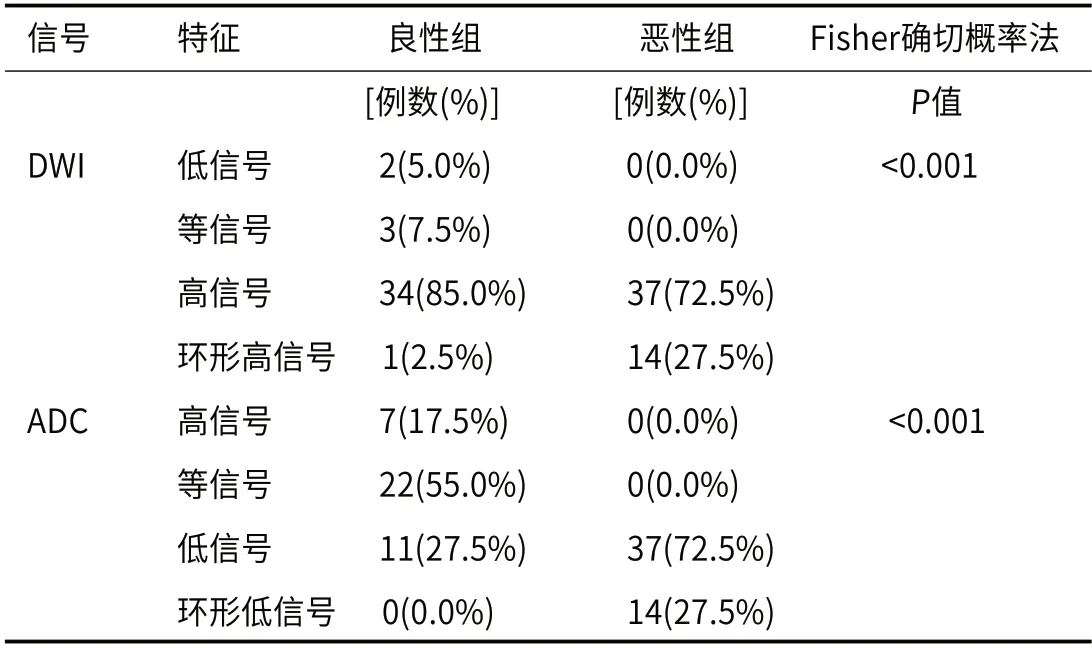
表1 良恶性组间DWI、ADC信号差异性分析
2.3 良恶性组间ADC值差异性良恶性组ADCmax分别为(1.425±0.292)×10-3mm2/s、(0.945±0.200)×10-3mm2/s,良恶性组ADCmin分别为(1.013±0.238)×10-3mm2/s、(0.590±0.223)×10-3mm2/s,良恶性组ADCmean分别为(1.225±0.229)×10-3mm2/s、(0.750±0.180)×10-3mm2/s,良恶性组ADCdifference分别为(0.412±0.246) ×10-3mm2/s、(0.354±0.163) ×10-3mm2/s,良恶性组ADCmax、ADCmin、ADCmean相比较,差异均有统计学意义(P<0.001),ADCdifference差异无统计学意义(P=0.208),结果见表2。
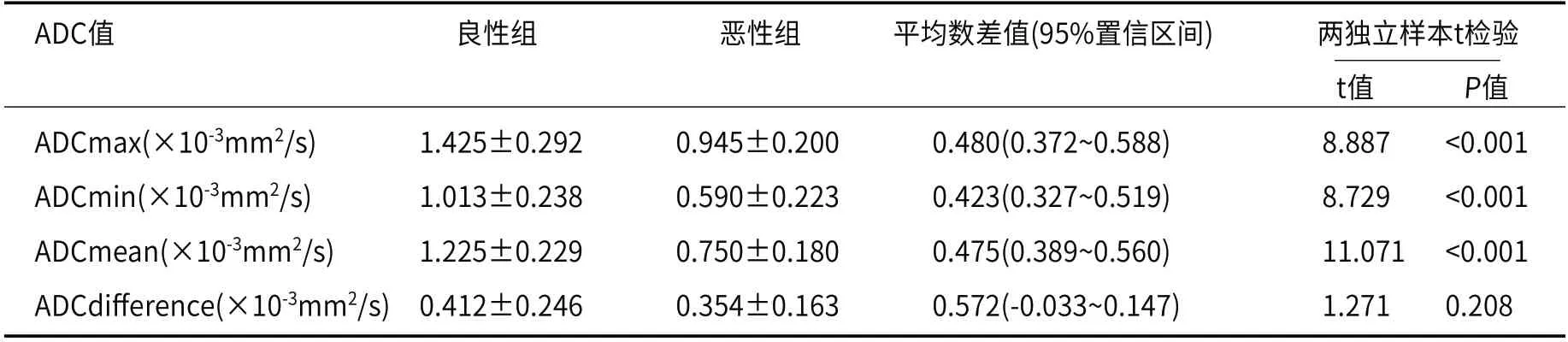
表2 良恶性组间ADC值差异性分析
2.4 定量参数ADC值诊断效能评价分别对ADC值有统计学意义参数ADCmax、ADCmin、ADCmean绘制ROC曲线,曲线下面积分别为0.919、0.912、0.952,其诊断效能依次为ADCmean>ADCmax>ADCmin,依据最大约登指数,ADCmean阈值为0.976×10-3mm2/s,此时敏感度为90%,特异度为90%,见图3和表3。

表3 定量参数ADC均值(ADCmean)ROC曲线分析
3 讨论
磁共振弥散加权成像信号特征及定量参数ADC值是鉴别乳腺肿块良恶性的主要依据之一。DWI能够在无创条件下检测活体组织的水分子弥散运动。人体不同组织的水分子弥散运动程度受到细胞密度、大小、细胞外间隙等微观因素的影响而存在差异,不同组织的受限程度差异,表现出DWI信号及ADC信号的差异,同时,通过计算ADC值,还可以定量分析不同组织水分子的弥散运动,反映出细胞密度、大小、细胞外间隙等结构的差异。乳腺恶性肿块由于细胞密度增高、细胞外间隙减小,水分子弥散运动受限加重,从而表现出DWI信号升高,ADC信号减低,ADC值降低。在本研究中,良性肿块DWI信号主要为高信号,但ADC信号表现为等信号,弥散受限程度并没有加重;恶性肿块主要为DWI高信号或环形高信号,ADC低信号或环形低信号;良恶性肿块DWI信号、ADC信号差异有统计学意义,与既往研究[6]一致。动态对比增强(DCE)对鉴别肿块的良恶性也有重要参考价值[7],在本研究中发现,部分恶性肿块表现为DWI环形高信号、ADC环形低信号、DCE环形强化,三者相匹配,此征象对诊断恶性病变有重要价值。
有研究指出[8],正常乳腺实质、乳腺良性病变、乳腺恶性病变的ADC均值分别为(1.713±0.32)×10-3mm2/s、1.584×10-3mm2/s、0.884×10-3mm2/s,乳腺良恶性病变ADC均值存在差异。本研究中,良性肿块ADC均值为1.225×10-3mm2/s,恶性肿块ADC均值为0.750×10-3mm2/s,ADC均值在两组间有统计学差异,与既往研究[8]相仿。本研究中也显示,良恶性组ADC最大值、最小值相比较,差异有统计学意义,但以ADC均值诊断效能最高。由于乳腺恶性病变内部存在异质性[9-10],以及在不同方向肿瘤浸润速度不同,因而ADC最大值与最小值的差值在良恶性病变间可能存在差异。有研究[11]显示,恶性病变ADC差值较良性病变大,ADC差值可用来鉴别良恶性病变。本研究中,良恶性组ADC差值相比较,差异无统计学意义,与既往研究[11]不同,可能与纳入的疾病病种占比不同,以及恶性肿块病理分级构成比例不同有关。有研究[12]指出,良恶性肿块病变鉴别诊断的ADC值阈值为1.05×10-3mm2/s,ADC>1.05×10-3mm2/s为良性病变,ADC≤1.05×10-3mm2/s为恶性病变。本研究中,对ADC值均值绘制ROC曲线,依据最大约登指数,ADC值均值阈值为0.976×10-3mm2/s,敏感度为90%,特异度为90%。有研究[13]显示,ADC值在Ⅰ、Ⅱ和Ⅲ级乳腺癌逐渐降低,依次为(1.106±0.124)×10-3mm2/s、(0.607±0.056)×10-3mm2/s、(0.211±0.039)×10-3mm2/s。本研究的ADC值阈值较既往研究略低,可能为本研究中病理分级多为Ⅱ级和Ⅲ级,而既往研究中包含了部分病理分级为Ⅰ级的病例。
磁共振弥散加权成像信号特征能够较好的鉴别诊断部分乳腺肿块的良恶性,尤其是DWI环形高信号、ADC环形低信号与DCE环形强化相匹配时,对恶性肿块有较高诊断价值。应用定量参数ADC值阈值辅助诊断肿块良恶性,有较高敏感度和特异度,具有较高的临床应用价值[14,15]。本研究为回顾性研究,难免存在偏倚,且在纳入的病变种类、恶性病变的病理分级方面存在一定的局限,需要进一步扩大病种范围及病例数量,进一步研究。

