胶质母细胞瘤术后复发的MRI诊断*
鲁 强 杨瑞山 王 可
聊城市第二人民医院 (山东第一医科大学附属聊城二院)CT磁共振室(山东 聊城 252600)
胶质母细胞瘤(glioblastoma multiforme,GBM)是颅内生长的原发性恶性肿瘤,患者以头痛、癫痫为首发症状。外科手术治疗是其主要治疗手段,临床研究显示,最大程度的手术切除,可以延长GBM患者生存期[1-2]。尽管如此,大部分患者术后均会复发,预后仍然不甚理想。目前,临床仍然将病理学组织检查作为GBM术后复发的金标准,但由于活检组织采集难度较大,且术后容易造成二次创伤和相关并发症,故而难以为人们广泛接受。因此临床多通过患者临床症状改变和影像学检查判断患者术后是否复发,选择简便、特异的影像学检查方法尤为重要[3-4]。磁共振(magnetic resonancediffusion tension imaging,MRI)具有多参数、多平面、多功能成像和软组织分辨率高的独特优势,常用于神经系统疾病的诊断与筛查工作[5]。其中磁共振弥散加权成像(diffusion weighted imaging,DWI)是以体内水分子扩散成像为原理的影像学成像技术,其中表观扩散系数(apparent diffusion coefficient,ADC)是通过活组织、水分子的扩散能力差异,以此来反映病灶部位组织的病理变化[6-7]。本次研究旨在通过比较和分析GBM术后是否复发不同患者的ADC值,一次鉴别诊断GBM术后复发,并为临床提供一定参考。
1 资料与方法
1.1 一般资料回顾性选取2017年1月至2021年1月在我院收治的211例GBM患者作为研究对象。
纳入标准:符合GBM临床诊断指南[8],且经病理学活检确诊;术后接受常规化疗、放疗,并在术后6个月再次行磁共振常规平扫、增强和DWI成像。排除标准:临床资料不完整者。根据其经二次手术或于术后随访结果分为复发组(n=119)与未复发组(n=92)。复发组:男性73例,女性46例;年龄48~63岁,平均年龄(55.37±3.44)岁。未复发组:男性59例,女性33例;年龄48~63岁,平均年龄(55.45±3.49)岁。复发组与未复发组性别、年龄比较无明显差异(P>0.05)。
1.2 方法所有患者均采用 GE MR750 3.0T磁共振扫描仪器(≥8通道头颈及相控阵线圈),检查序列:磁共振平扫、常规增强、DWI成像,并在GE专用的工作站(AW 4.6)进行后处理。所有纳入患者在进行检查前将身上金属物取下,尽量减少活动并固定头部,选择仰卧位。
磁共振平扫:横轴位T1FLAIR(TR/TE=2000/24ms);FSET2WI(TR/TE=4325/102ms) ;T2FLAIR(TR/TE=9000/90ms),层厚 5.0mm,层间距 0mm,FOV:24cm,矩阵 320×256。
MRI 增强扫描:增强扫描造影剂采用钆喷酸脯葡胺,剂量为0.2mL/kg,采用高压注射器静脉注射或静推,注射速度2mL/s,采用轴位、矢状位、冠状位bravo序列连续扫描:TR/TE=8.2/3.2ms,层厚=2.0mm,间距=0mm,FOV 24cm,矩阵256×256。
DWI成像:序列[平面回波脉冲(EPI),TR/TE=2800/65.5]),扩散梯度:3 个垂直平面,b 值=0和1000s/mm2,矩阵:160×160,层厚:5.0mm,层间距:0mm,扫描范围:24cm×24 cm。
1.3 图像测量与分析(1)将图像传送至GE AW4.6工作站进行处理,获取ADC 图像。由1名经验丰富的影像学医师在ADC 图像上选择感兴趣区域(region of interest,ROI),另选择大小一致的ROI并将其放置在对侧正常的脑组织,计算ADC值。
(2)选择异常信号的最大层面(尽量避免坏死区和脑沟位置)在ROI区测量3次后取平均值,得到ADCmean,并进行数据的标准化处理,比较实性异常信号区 ADCmean值和对侧正常的脑组织ADCmean,计算相对ADC值(rADCmean=患侧/对侧正常ADCmean值)。(3)将ROI放置于DWI成像中最亮区域(图中信号最低处)为ADCmin,ADC 图最亮的区域(图中信号最高处)为ADCmax。
(4)注射对比剂后信号增强部位为强化区,信号无强化部位为坏死区,手动测量计算肿瘤的强化部分体积:各层面坏死面积、强化面积、肿瘤面积,乘以层厚后进行累加。计算肿瘤体积:基于磁共振成像液体衰减反转恢复(FLAIR)序列和T1W1增强图像,对肿瘤边界勾划后,将层厚-层间距之和×各层面截面积之和作为肿瘤体积。肿瘤切除程度=(术前瘤体体积-术后)/术前100%。
1.4 统计学处理采用SPSS 22.0统计学软件对本研究中纳入GBM患者资料进行数据整理,满足正态分布且方差齐的计量资料采用()表示,采用两样本独立t检验比较组间差异,计数资料用[例(%)]表示,采用χ2检验;采用受试者工作曲线(receiver operating characteristic curve,ROC)分析ADCmean、rADCmean、ADCmin和ADCmax值对术后复发的预测效能,肿瘤强化部分残余体积与肿瘤强化部分切除程度对术后复发的预测效能,在P<0.05时提示差异均有统计学意义。
2 结果
2.1 复发组与未复发组ADC图像信号比较复发组主要以ADC低信号为主(P<0.05),未复发组以ADC高信号为主(P<0.05),两组在稍高信号例数比较上无明显差异(P>0.05),见表1。
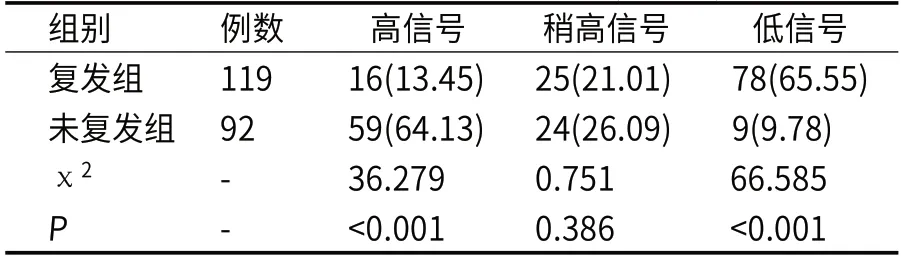
表1 两组ADC图像信号比较(n,%)
2.2 复发组与未复发组ADC值比较复发组ADCmean、rADCmean、ADCmin和ADCmax值均低于未复发组(P<0.05),见表2。

表2 复发组与未复发组ADC值比较(10-3mm2/s)
2.3 ROC分析不同ADC值对GBM术后复发的诊断效能ROC曲线分析显示,ADCmean、rADCmean、ADCmin和ADCmax预测GBM术后复发的AUC分别为0.701、0.722、0.777和0.672,曲线特征见图1,曲线分析见表3。

图1 不同ADC值对GBM术后复发的ROC曲线特征。图2 肿瘤强化部分残余体积与肿瘤强化部分切除程度对GBM术后复发的ROC曲线特征。图3胶质母细胞瘤的术前T1WI图像。图4 胶质母细胞瘤的术前T2WI图像。图5 术后复发可见局部斑点。图6 术后复发可见条状强化灶。图7 术后复发可见不均匀强化。图8 术后复发可见多发结节状明显强化灶。
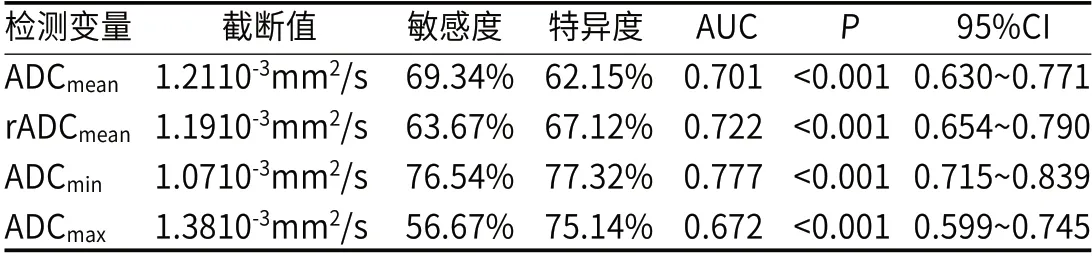
表3 不同ADC值对GBM术后复发的ROC曲线分析
2.4 复发组与未复发组肿瘤强化部分残余体积与肿瘤强化部分切除程度比较复发组肿瘤强化部分残余体积高于未复发组(P<0.05),肿瘤强化部分切除程度低于未复发组(P<0.05),见表4。

表4 复发组与未复发组肿瘤强化部分残余体积与肿瘤强化部分切除程度比较
2.5 ROC分析肿瘤强化部分残余体积与肿瘤强化部分切除程度对术后复发的诊断效能ROC曲线分析显示,肿瘤强化部分残余体积、肿瘤强化部分切除程度预测GBM术后复发的AUC分别为0.798和0.781,曲线特征见图2,曲线分析见表5。

表5 肿瘤强化部分残余体积与肿瘤强化部分切除程度对GBM术后复发的ROC曲线分析
2.6 典型病例分析图3、图4显示右颞叶团片状混杂信号影,周围见斑片状长T1长T2水肿影,DWI示病变见信号不均匀,注入Gd-DTPA后见片絮状不均匀强化,病理示胶质母细胞瘤。图5、图6显示术后复查,注入Gd-DTPA后右侧颞岛叶、丘脑及侧脑室颞角-三角区周围脑实质见斑点、条状强化灶,可见术后局部复发。图7为术后复查,显示右额叶团块状混杂信号,注入造影剂后呈不均匀强化,提示复发。图8左侧顶叶及骨板下见长T1长T2信号,术区边缘见线状强化;右侧基底节、胼胝体膝部、双侧额叶、双侧侧脑室前角见多发结节状明显强化灶,符合肿瘤复发。
3 讨论
GBM是颅内常见的恶性肿瘤,具有较高的复发率,威胁患者健康和安全。近年来随医学的进步和影像学技术发展,GBM术后生存期有明显延长,但其较高的复发率仍是当前治疗的一大难题[9-10]。
本次研究发现,复发组主要以ADC低信号为主,未复发组以ADC高信号为主,两组在稍高信号例数比较上无明显差异。但信号变化易受纤维瘢痕及胶质增生的干扰[11-12],本研究结果可见复发组和未复发组患者的ADC图均有稍高信号表现,可见单独以信号作为鉴别标准临床应用价值仍有局限。
DWI技术通过体内水分子的运动差异进行功能成像,通过ADC值测量对分子扩散水平进行定量分析,即通过测量ADC值判断GBM肿瘤组织的浸润水平,浸润程度更大者侵袭性更强[13-14]。本次研究结果显示,复发组ADCmean、rADCmean、ADCmin和ADCmax值均低于未复发组。GBM肿瘤组织间排列较为紧密,胞浆较少,故核浆比例升高,使得细胞与细胞之间缝隙更为窄小,影响看水分子的弥散程度,故肿瘤实质DWI表现为高信号,ADC图表现为低信号,ADC值更低。本次研究结果显示复发组ADC值均低于未复发组,分析其原因,可能是因为手术虽然切除了肿瘤组织,但同时不可避免的损伤周围正常的脑组织,同时术后放化疗治疗也会引起组织损伤和坏死,导致形成组织纤维化和肉芽,故ADC值可以用于评价GBM患者术后是否复发的临床参考。且经ROC分析可见,ADCmin的AUC最大,提示ADCmin诊断效能最高,究其原因可能是由于ADCmin值对于测量肿瘤侵袭性更为敏感[15-16]。而ADCmax诊断AUC相对较小,推测可能是由于术后部分组织因肿瘤周围水肿或放疗反应导致信号变化,难以判断是否为复发,进而发生误诊。
本次研究发现,复发组肿瘤强化部分残余体积高于未复发组,肿瘤强化部分切除程度低于未复发组,表明复发组GBM患者强化部分残余体积较大,切除程度较低,分析其原因可能为。(1)GBM患者术前肿瘤切除范围更小的患者,健康状况与身体素质更为良好,术后放化疗耐受水平明显更高,可以获得更好的临床结局。(2)手术有助于了解肿瘤性质及解除肿瘤的占位效应,提高患者生活质量,使患者早期进行术后放疗、化疗,减轻肿瘤负担,故推测术中肿瘤切除程度越高,患者的生存期越长。但有研究者发现,单一通过切除肿瘤范围进行治疗可能损害患者神经功能[17-18],因GBM肿瘤主要呈现为浸润性生长的特点,若仅切除MRI上强化的肿瘤部位不一定可以获取最佳的术后效果,故对此类患者在进行手术时,应当尽量切除接近程度的阈值。经ROC分析可见,肿瘤强化部分残余体积、肿瘤强化部分切除程度预测GBM术后复发的AUC分别为0.798和0.781,提示临床医师可以通过肿瘤强化部分残余体积与肿瘤强化部分切除程度联合检测预测患者术后复发效能。
综上所述,对GBM术后采用MRI技术进行分析对肿瘤复发有一定的预测价值,临床医师可根据患者情况进行定期MRI复查,检测ADC值、强化部分残余体积与肿瘤强化部分切除程度,避免误诊,漏诊。

