外源γ-氨基丁酸对葡萄光合色素、内源激素和品质的影响
韩爱民,杨江山,张立梅,王宇航,冯丽丹,王春恒,金鑫,李斗
(1. 甘肃农业大学园艺学院,甘肃 兰州 730070;2. 甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒产业技术研发中心,甘肃 兰州 730070;3. 甘肃省葡萄酒产业技术研发中心,甘肃 兰州 730070)
喷施外源调控物质能够调节植物内源激素的变化并促进植物生长发育和提升果实品质,在农业生产上已被广泛应用[1-2]。在果树栽培管理中,叶面喷施γ-氨基丁酸(GABA)是改善水果品质的有效途径之一[3]。
GABA 是一种自由态四碳非蛋白质氨基酸,也是植物细胞游离氨基酸中重要组分之一[4-5],在植物的各组织中普遍存在,可以以营养物质或代谢调节物质发挥功能对不同环境下植物根、茎、叶、花、果实、种子等各个器官的生长发育起到调节作用[6]。GABA 作为信号分子能够减缓光合色素分解,促进叶绿素合成[7],而类胡萝卜素不仅作为辅助色素参与叶绿体的光合作用,避免叶绿素受到强光的破坏,也是植物激素ABA的生物合成前体。研究发现,外源喷施GABA 能够诱导内源GABA 的积累[8-9]和植物激素(KT 和IAA)[10]含量的增加,而GABA 可以作为氨基酸代谢的中间物质,参与果实成熟过程中的代谢调节,从而在一定程度上提升了果实的品质。陈秀[11]等的研究结果表明,GABA 处理能够维持果实可溶性固形物和可溶性糖含量在较高水平,促进总酚和类黄酮含量积累,对植物的品质、色泽和风味都有一定程度的影响,而且具有天然的抗氧化活性。另外,陈洪彬等[12]研究表明,GABA处理能够有效降低采后番石榴果实的冷害指数、呼吸强度和乙烯释放速率,维持较高的果实硬度、可溶性固形物、可滴定酸、维生素C和总糖的含量,从而提升了对番石榴果实的贮藏水平,更好地维持其营养与感官品质。Yu等[13]在2014年首次提出外源 GABA 可通过提高防御相关酶活力及其基因表达来诱导梨果实对青霉病的抗性,且有效抑制了梨果实中由扩展假单胞菌引起的蓝霉病,对梨果实的食用品质没有不良影响。有研究者提出,在植物体内GABA是一种信号物质,但是信号通路的运作方式、大田应用方式、施用时间和成本效益需要进一步的实践探索[14]。目前,GABA的研究多存在于黄秋葵[15]和苹果[16]等作物上面,针对光合色素、内源激素含量变化和果实品质在酿酒葡萄方面的应用研究未见相关报道。
为探索GABA 对葡萄生理作用和品质的影响。本试验以蛇龙珠酿酒葡萄为试验材料,喷施不同浓度GABA处理,研究外源GABA对葡萄不同物候期光合色素和内源激素及果实品质的影响,探索出最佳处理措施,以期为外源GABA 在葡萄生产中的应用提供技术支撑和理论依据。
1 材料与方法
1.1 试验材料
以露地栽培的10 年生欧亚种酿酒蛇龙珠葡萄(Cabernet Gernischt) 为试验材料,株行距为0.75 m×1.5 m,单干双臂Y 型整形修剪。试验药剂为上海源叶生物科技有限公司生产的GABA(纯度>99%)。
1.2 试验处理
试验设4 个不同浓度GABA 处理:5(T1)、10(T2)、15(T3)、20 mmol/L(T4),以喷施清水为对照(CK),共5 个处理。处理选在晴朗、无风的上午进行,分别于开花期、坐果期、果实膨大期、果实转色期和成熟期各喷施一次,每处理每次喷施体积为2 L,每处理5 株,3 次重复,喷施程度以叶正反面均匀布满雾状水滴为度。
于开花期、坐果期、膨大期、转色期和成熟期各喷施3 d 后,采集叶片,用蒸馏水冲洗表面污物并去除叶脉部分,采后立即放入冰盒带回实验室,供生理指标的测定。
1.3 测定指标与方法
1.3.1 光合色素含量的测定 叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素(Chl t)和类胡萝卜素(Car)含量的测定参照叶子飘等[17]的方法,略有改动。准确称取新鲜叶片0.1 g,用10 mL 95%乙醇避光浸泡26 h,直至叶片完全褪色,使用紫外分光光度计测定溶液在665、649、470 nm 处的吸光值。计算 Chl a、Chl b 和Car 的含量,Chl a 和Chl b 含量的二者之和为叶绿素总量(Chlt)。
1.3.2 内源激素的测定 内源激素赤霉素(GA3)、吲哚乙酸 (IAA) 、激动素 (KT) 和脱落酸 (ABA)含量用高效液相色谱法测定[18]。
高效液相色谱仪为美国Waters ACQUITY Arc,色谱柱为Hypersil BDS C18 色谱柱,流动相为甲醇-0.1%磷酸水溶液,色谱柱温度为30 ℃,进样量为10 μL,检测波长为254 nm,流速为1.0 mL/min。
1.3.3 果实品质指标测定 于成熟期采集果实进行品质指标测定。各处理随机选取3株,每株上、中、下随机选取30 粒,将样品经液氮速冻后在-80 ℃的条件下贮存备用。
用电子天平称量单粒质量;用游标卡尺测量果实的纵径和横径;采用手持糖量计测定可溶性固形物的含量;蒽酮试剂法[19]测定可溶性糖的含量;NaOH 滴定法[20]测定可滴定酸(以酒石酸计)含量;采用Folin 丹尼斯法[21]测定单宁含量;采用Folin 酚法[22]测定总酚含量;总类黄酮含量按照氯化铝比色法[23];另外,称取葡萄果皮0.2 g,加入1%(w)盐酸-无水甲醇提取液20 mL,于室温下暗处浸提12 h,定容至50 mL棕色容量瓶,采用pH示差法测定果皮总花色苷含量[24]。
1.4 数据处理与分析
采用Microsoft Excel 2010 和Origin 2018 进行数据的统计与作图。应用Duncan 新复极差法进行显著性分析,显著性差异检验P<0.05,并用SPSS 26.0进行主成分分析。
2 结果与分析
2.1 外源GABA 处理对蛇龙珠葡萄叶片光合色素含量的影响
图1 结果显示,与对照(CK)相比,在开花期、坐果期和转色期,T2处理下Chl a、Chl b、Chl t和Car含量最高,各处理均呈现先升高后降低的趋势。膨大期,Chl b和Chl t在各处理均呈现先升高后降低的趋势,T2处理下含量最高,且较CK 分别提高22.51%和14.20%;其中,在成熟期,各处理葡萄叶片Chl a、Chl b和Chl t 均呈现先升高后降低的趋势,较CK升高14.90%、53.65%和22.31%。可见,GABA 处理显著增加了葡萄叶片光和色素含量,叶面喷施不同浓度的GABA 能显著缓解光和色素含量降低的趋势,并以T2处理效果最佳。
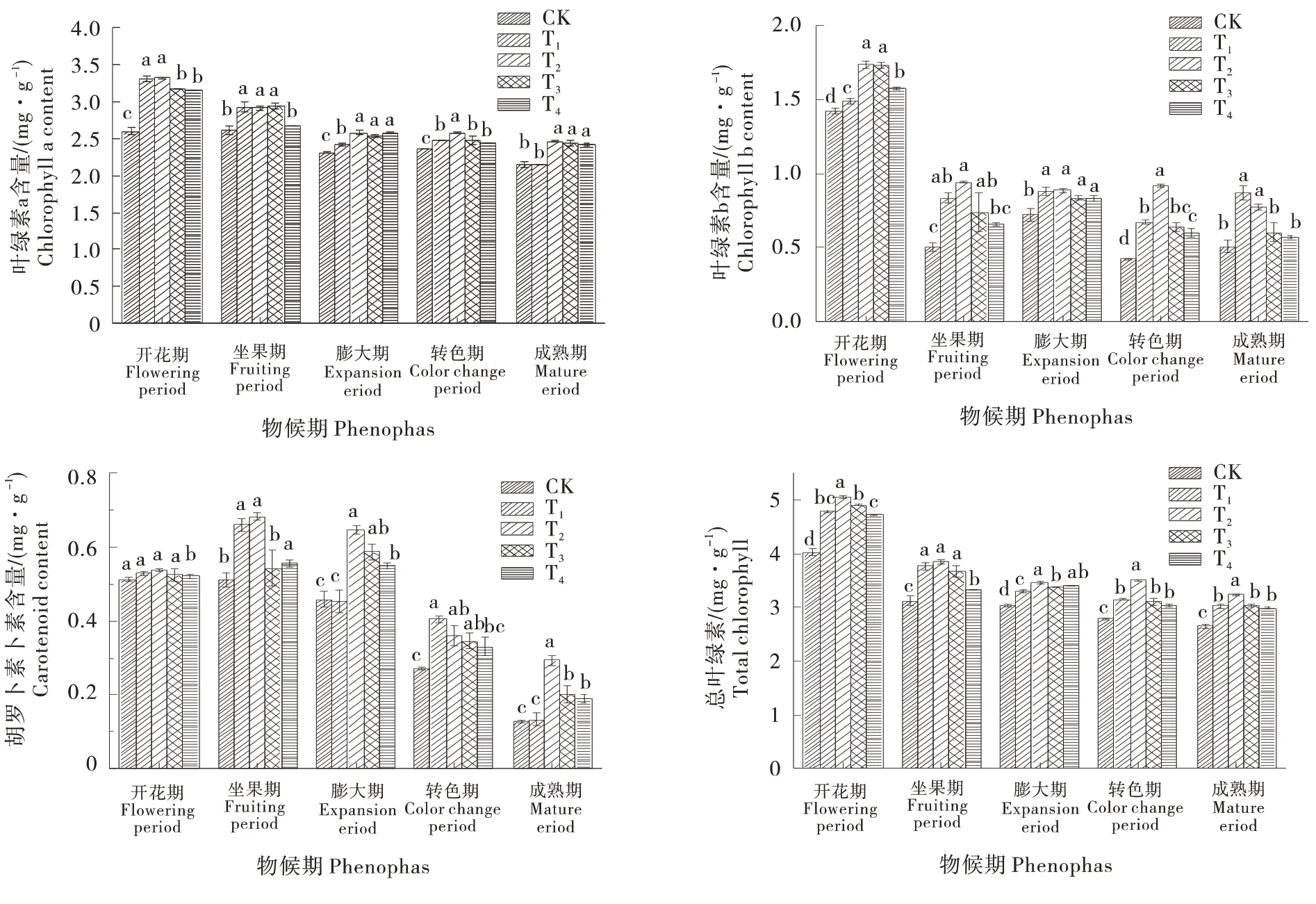
图1 GABA对蛇龙珠葡萄叶片光合色素含量的影响Figure 1 Effect of GABA on photosynthetic pigment content in leaves of Cabernet Gernischt grape
2.2 外源GABA 处理对‘蛇龙珠’葡萄叶片内源激素动态变化的影响
叶片中KT含量从开花期到成熟期,整体呈下降趋势(图2)。从开花期到成熟期,KT含量均T2处理最高,较CK 分别增加了67.91%、47.50%、31.68%、57.44%和35.07%,说明T2处理效果最好(图2-A)。开花期到坐果期,叶片GA3含量总体呈下降趋势,于膨大期有所升高,之后继续呈下降趋势;GABA处理可显著改变叶片GA3的含量,在膨大期,T2较CK 增加了45.56%(图2-B),而其他处理间差异较小;此后的时期中,GABA 处理下叶片GA3含量均高于CK,说明GABA处理有利于叶片GA3的积累。
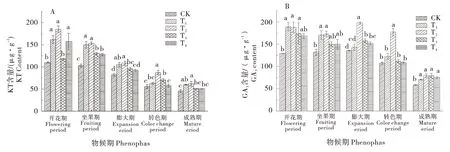
图2 GABA对蛇龙珠葡萄叶片KT和GA3含量的影响Figure 2 Effects of GABA on KT and GA3 contents in leaves of Cabernet Gernischt grape
叶片IAA的含量变化如图3-A所示,坐果期T2处理IAA 含量最高,较CK 高49.18%,随着叶片发育,IAA 含量逐渐下降;各物候期,GABA 处理下叶片IAA 含量始终高于CK,说明GABA 处理有利于叶片中IAA 的积累。如图3-B 所示,从开花期到成熟期,葡萄叶片ABA 含量呈逐渐升高的趋势;膨大期,T2处理显著地提高了叶片ABA的含量,较CK提高了48.90%;转色期,T1和T2处理与CK 差异显著,分别较CK 提高了27.50%和41.05%;成熟期,各处理均高于CK,T2含量最高,且差异显著,较CK提高了27.95%。GABA 处理增加了叶片ABA 含量,而T2处理对ABA 含量变化影响最大,处理效果最好。
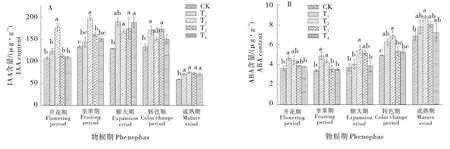
图3 GABA对蛇龙珠葡萄叶片IAA和ABA含量的影响Figure 3 Effects of GABA on IAA and ABA contents in leaves of Cabernet Gernischt grape
2.3 外源GABA 处理下对蛇龙珠葡萄果实品质的影响
GABA处理蛇龙珠葡萄外观品质和果实风味均有显著影响(表1)。随着GABA 浓度的增加,蛇龙珠葡萄果实单粒质量、纵径、横径和果形指数都有一定程度的提高,T2和T3处理最为显著,单粒质量较CK分别提高了11.32%和44.05%;各处理中可溶性固形物的含量均有不同程度的升高,其中,T2处理有显著差异,较 CK 提高了11.14%;GABA 喷施浓度与总酚含量显著相关,并随着GABA 浓度的增大总酚的含量先升高后降低,T3处理的含量最高,为24.45 mg/g,较 CK 提高了36.94%,T2和T3与其他处理具有显著差异;T1和T3单宁含量最高,分别较CK高48.16%、48.80%;处理T2总花色苷含量较CK提高了5.03%,但T1和T4处理与 CK 相比,果实中总花色苷差异不显著;总类黄酮含量T3处理最高,与CK 相比提高了10.98%,T2与T1处理差异不显著,但T2与T3处理差异显著。
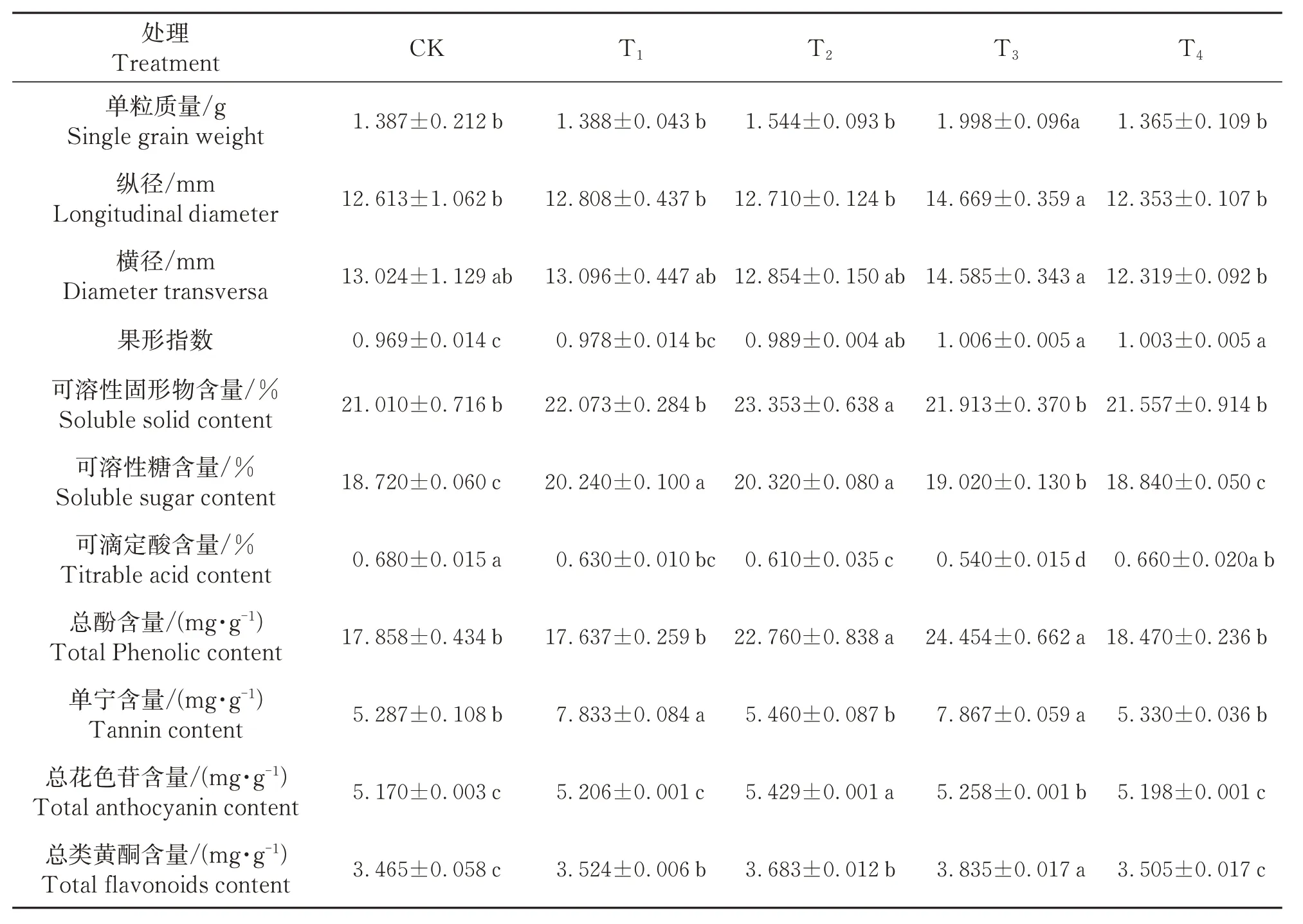
表1 成熟期不同GABA处理蛇龙珠葡萄果实品质指标Table 1 Fruit quality indexes of Cabernet Gernischt grape treated with different GABA at mature stage
2.4 外源GABA 处理对‘蛇龙珠’葡萄叶片和果实指标的相关性分析
蛇龙珠葡萄叶片和果实16 种指标相关性分析结果(表2)显示,总叶绿素、KT、GA3、IAA、ABA、单粒质量、纵径、横径、果形指数、可滴定酸、可溶性糖、总酚和总花色苷共13项之间的相关关系系数值呈现出显著性,葡萄叶片总叶绿素与赤霉素(GA3)含量呈显著正相关,与生长素(IAA)含量呈极显著正相关,与脱落酸(ABA)含量呈显著正相关;激动素(KT)与可溶性糖呈极显著正相关;赤霉素(GA3)与生长素(IAA)含量呈极显著正相关,与果形指数呈显著正相关;单粒重与纵径呈极显著正相关,与横径呈显著正相关;纵径与横径呈极显著正相关;果形指数与总酚含量呈显著正相关,与总花色苷含量呈显著正相关;可滴定酸与总酚呈显著负相关,与总花色苷含量呈极显著负相关;总酚含量与总花色苷含量呈极显著正相关。

表2 蛇龙珠葡萄叶片和果实16种指标的相关性分析Table 2 Correlation analysis of 16 indexes of leaves and fruits of Cabernet Gernischt grape
2.5 外源GABA 处理对蛇龙珠葡萄叶片和果实品质相关指标主成分分析
主成分分析是一种将原来个数较多且彼此相关的果实品质指标转化为新的个数较少且彼此独立或不相关的综合指标的分析方法[25]。蛇龙珠葡萄样品16 项品质指标的主成分分析结果(表3)显示,从16项品质指标中共提取出3个主成分,它们特征值分别为8.629、4.695 和2.057。3 个主成分的累计方差贡献率达到了96.133%,可以有效地反映出原始数据的大部分信息。第1 主成分的方差贡献率为53.934%,与其有较高正相关性的指标有GA3、果形指数和总花色苷,而有较高负相关的品质指标仅有可滴定酸;第2 主成分的方差贡献率达到了29.344%,与其有较高正相关性的指标有KT、可溶性糖和总类黄酮,而有较高负相关性的指标为果形指数和总酚,即主成分2的方差贡献率大时,葡萄果实中KT、可溶性糖和总类黄酮的含量均会增加,而其果形指数和总酚含量却减少;第3主成分的方差贡献率达到了12.855%,与其有较高正相关性的指标有可溶性固形物和单宁,而有较高负相关性的品质指标为总叶绿素和可滴定酸。
2.6 外源GABA处理对蛇龙珠葡萄效果综合分析
综合得分(F)是每个主成分得分与对应贡献率乘积之和,即F=F1×53.934%+F2×29.344%+F3×12.855%。由表4 可知,CK、T1、T2、T3、T4的综合得分分别为-92.574 5、36.937 92、67.958 93、17.417 75、-29.740 1,综合指数的得分越高,说明GABA影响效果越好,即GABA对蛇龙珠葡萄果实性状和品质的作用效果依次为T2>T1>T3>T4>CK。
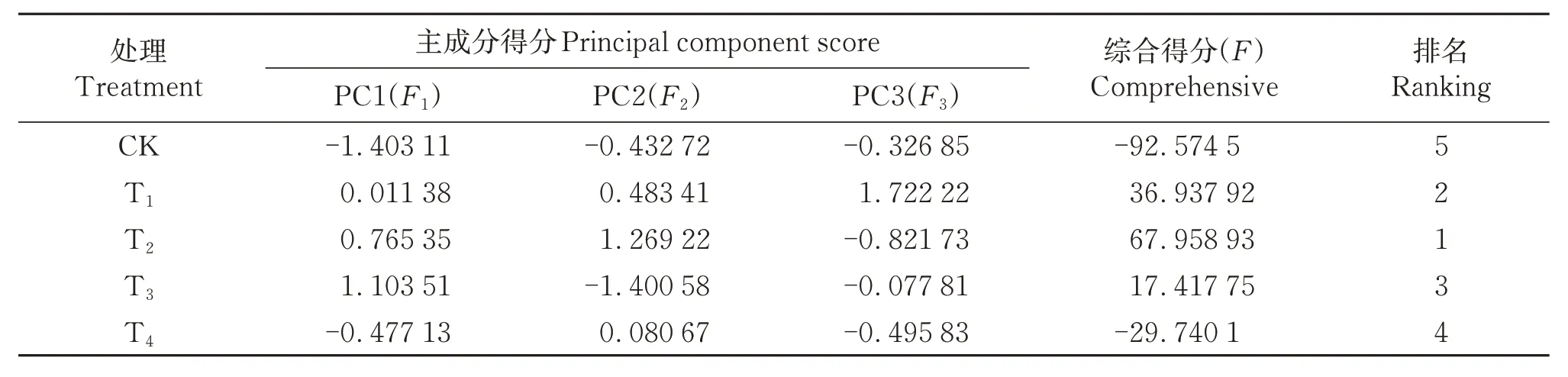
表4 不同GABA处理蛇龙珠葡萄效果综合分析表Table 4 Comprehensive analysis table of effects of different GABA treatments on Cabernet Gernischt grape
3 讨论
光合色素有吸收光能的作用,且叶绿素是植物光合作用的中心色素分子,是表征其光合作用能力和生长状况的重要指示因子[26]。光合作用在果树生长、发育、开花和结果等生理过程中起着重要的作用,决定着果树的生长发育和果实品质的好坏[27]。本试验表明,T2处理可有效的提高叶绿素和类胡萝卜素含量,这可能是较低浓度的外源GABA 促进葡萄叶片的光合色素形成过程,既积累了光合物质,又促进光合作用,从而降低黄化现象,与殷菲胧等[15]的研究结果一致,证明较低浓度GABA 处理可以通过提高番茄叶片叶绿素a/b的比率[28],从而增强光合特性、促进多胺的合成和转化等生理过程,缓解各种胁迫影响对植物的伤害,有利于植物生长发育,促进葡萄果实品质的提高。此外,外源GABA 内源激素是植物体内存在的小分子信号化合物,它能够将细胞内复杂的分子机制网络的外部和内部信号进行整合,从而使植物在不同的环境条件下进行各种生理生化活动来调控叶片衰老[29]。一旦叶片开始衰老,大分子即开始降解并重新分配到生长部位,进而提高果树生产能力以及改善果实品质。植物内源激素生理方面还主要集中在调节植物生长发育的研究上,能够根据外界环境因素的变化快速调节植物的生长和发育,也是影响细胞分裂和膨大的关键性因素,已经被广泛应用到农业生产尤其是果树的栽培中。IAA、GA3、KT 和ABA 等内源激素以及激素之间的协同调控[30],IAA、KT 和GA3均可促进果实生长发育及同化产物积累,增大葡萄纵横径,提高单粒重,ABA 能够促进果实成熟,从而改善果实品质。本试验中,葡萄叶片中KT 含量从开花期到成熟期,整体呈下降趋势,而叶片GA3含量在开花期到坐果期,总体呈下降趋势,于膨大期有所升高,之后继续呈下降趋势。这可能与果实发育后期KT、GA3等激素调节果实内部相关、激素的含量有关,较高含量的KT和GA3对果实快速生长具有促进作用。坐果期,T2处理的葡萄叶片IAA 含量最高,随着叶片发育,IAA含量逐渐下降,开花期,叶片ABA含量较高,随后呈逐渐下降趋势,转色期又有所上升,其原因可能是GABA参与了植物体内ABA水平的调控,IAA和ABA可能正调控可溶性糖和花色苷积累,与葡萄成熟密切相关,这与何娟等[31]的研究结果类似。
适宜的植物生长调节剂能够有效提高葡萄的品质。Shi 等[32]认为,GABA 可能作为一种信号分子,参与调节植物中许多基因的表达,在植物中以铝激活的苹果酸转运体(ALMT)发挥作用,调节包括激素相关的代谢途径,从而减轻对植物的胁迫影响。研究结果表明,酚类物质在植物的生长发育中发挥着重要作用,类黄酮、总酚和单宁是葡萄果实中重要的酚类化合物,且具有生物活性功能[33],GABA可以增加抗氧化活性中的作用是由于其能够增加抗氧化化合物的产生[34]。杨湘[35]等研究结果表明,可滴定酸、可溶性糖和可溶性固形物含量与气候、葡萄的栽培条件、成熟期和采收期都有关,与本试验结果一致。本试验结果表明,对外源GABA 处理的果实测定发现,降低了其可滴定酸含量,可能是延缓了果实中可滴定酸和苹果酸盐的流失,减少了乙烯的产生,而提高了可溶性固形物和可溶性糖含量,原因可能是外源GABA 处理抑制了蔗糖降解相关酶基因PpSUS5的表达,减缓了果实中蔗糖的含量降低,从而提高果实抵抗胁迫的能力,改善了果实品质。同时,果皮色素含量是酿酒葡萄果实重要的品质指标之一,它主要取决于总花色苷的组分和含量[36]。本试验结果表明,适宜浓度GABA 处理提高了总花色苷的含量,所以认为GABA有利于葡萄果实着色,对果实成熟有一定的促进作用。
4 结论
本试验结果表明,喷施适宜浓度的GABA 可提高酿酒葡萄叶片光合色素和IAA、KT及GA3等内源激素含量,改善了果实品质。相关性分析以及主成分分析综合评价排序结果表明,10 mmol/L GABA可有效促进葡萄生长和改善葡萄品质,处理效果最佳,可为优质高效葡萄栽培提供技术支撑与理论依据。

