秦巴硒菇提取物FA-2-b-β 对白血病细胞K562/ADR多药耐药性的逆转作用
白宇,冯文雯,孙延庆,2
(1. 甘肃中医药大学第一临床医学院,甘肃 兰州 730030;2. 甘肃省人民医院血液内科,甘肃 兰州 730030)
慢性髓系白血病(chronic myeloid leukemia,CML)是一种起源于造血干细胞恶性增殖性肿瘤。CML 全球年发病率为1.6/10万~2.0/10万,发病中位年龄为67岁[2]。目前,化疗是CML治疗的重要手段之一,而肿瘤多药耐药性(multidrug resistance,MDR)的产生,使其治疗效果仍不理想。多药耐药基因1(multidrug resistance gene 1,MDR1) 的过度激活和产物P-糖蛋白(p-glycoprotein,P-gp)表达升高是多药耐药性产生的主要原因之一[3]。MDR1是ATP结合盒(ATP-binding cassette,ABC)超家族成员之一,编码的P-gp 蛋白具有药物外排泵功能,已被证明与耐药复发有关[4]。此外,信号通路的调节和改变,在白血病耐药产生过程中也扮演了重要角色,包括经典的NF-κB[5],BMP[6],Wnt/β-catenin[7],MAPK[8]等通路。胃癌细胞KATO III/VCR 中,过表达的抗凋亡蛋白Siva-1可激活NF-κB信号通路,引起MDR1 和MRP1 蛋白表达增加,促使胃癌细胞对 VCR、5-氟尿嘧啶和阿霉素的敏感性显著升高[9]。其他耐药相关机制还包括,凋亡通路阻断[10],药物靶点改变[11],表观遗传因素影响[11],微小RNA 调控[12]及耐药细胞微环境[13]等。可见,探寻能够从多靶点、多机制逆转肿瘤多药耐药性的药物或方案具有重要意义。
近年来中药提取物已被广泛用于肿瘤耐药的治疗和研究当中,取得了一定疗效[14]。食用菌秦巴硒菇(Agaricus blazei)中多种提取物,被证实具有提高免疫力[15],调节血脂血糖[16],抑制肿瘤细胞增殖[17],抗病毒[18]等功效。有研究发现,秦巴硒菇提取物FA-2-b-β 能增加3'-叠氮-3'-脱氧胸腺核苷(Zidovudine,AZT)对胃癌细胞的抑制率[19],这提示FA-2b-β 可能与化疗药物的增敏有关,但具体作用方式和详细机制尚不明确。因此,本研究选取秦巴硒菇提取物FA-2-b-β,测定其对耐药细胞K562/ADR的增敏效果及凋亡作用,并对耐药基因MDR1及编码的P-gp蛋白,和NF-κB通路中关键分子p65进行检测,以期阐明FA-2b-β潜在作用机制,为CML 的临床治疗和用药提供新的思路。
1 材料与方法
1.1 细胞培养及分组
慢性髓系白血病K562 细胞由兰州大学第二附属医院实验室馈赠,K562/ADR 细胞购自于宁波明舟生物科技有限公司,在含有10%胎牛血清的RPMI1640 培养基培养中加入1 μg/mL 阿霉素(Adriamycin,ADR)维持K562/ADR耐药性,并置于37 ℃、含5%的CO2的条件下培养。试验分为空白组(2种细胞不加任何干预做对照)、秦巴硒菇FA-2-bβ干预组(对两种细胞施加FA-2b-β,浓度依次为1、1.5、2、2.5、3 mg/mL)、阿霉素干预组(对2种细胞施加阿霉素,分别测定其对阿霉素的反应,浓度依次为5、10、15、20 μmol/L),以及联合用药组(对耐药株K562/ADR 细胞施加低毒性秦巴硒菇FA-2-b-β干预,再联合阿霉素进行检测)。对于各药物浓度选取,参照本课题组前期研究以及相关文章确定。
1.2 试剂与仪器
秦巴硒菇提取物FA-2-b-β 由北京同仁堂成都有限公司提供,青霉素-链霉素混合液购自德国Hyclone 公司,胎牛血清购自以色列Biological Industries,总RNA 提取试剂盒试剂、Hifair®Ⅱ1st Strand cDNA Synthesis Super Mix for qPCR 反转录试剂盒、Hieff®qPCR SYBR Green Master Mix 扩增试剂盒均购自上海翊圣生物科技有限公司,Annexin VFITC/PI双染凋亡试剂盒购自武汉伊莱瑞特生物科技股份有限公司,CCK-8 细胞计数试剂盒购自于奥默生物技术(上海)有限公司、BCA 试剂盒、ECL 化学发光显色试剂盒均购自中国上海碧云天生物公司,P-gp Mouse mAb、IκBα Rabbit mAb、p65 Mouse mAb、p53 Mouse mAb、BAX Rabbit mAb、BCL-2 Mouse mAb、HRP-山羊抗小鼠、HRP-山羊抗兔均购自于中国,Servicebio公司公司。荧光显微镜IX51购自日本奥林巴斯公司,酶标仪FC购自美国赛默飞公司,荧光定量PCR仪、凝胶成像分析仪购自美国伯乐Bio-Rad 公司,流式细胞仪FACSVia 购自美国BD公司。
1.3 CCK-8 法检测细胞存活率
依照5×104/mL 密度接种细胞于96孔板中,并用不同浓度FA-2-b-β以及阿霉素分别处理24、48、72 h后加入10 μL CCK 8 溶液,继续孵育2 h。酶标仪测量每孔450 nm 处光密度(D)值,计算抑制率及耐药倍数。
抑制率(%)=[1-(试验组D-空白组D)/(对照组D-空白组D)]×100%
选取FA-2-b-β对K562/ADR细胞的低毒浓度(IC90),并联合阿霉素再次干预K562/ADR 细胞,计算逆转倍数。
1.4 RT-PCR 检测细胞中相关基因mRNA 的表达
各浓度FA-2-b-β处理每组细胞48 h后,收集并提取总RNA,进行目的基因逆转录及扩增。反应体系为 20 μL,反应条件:95 ℃ DNA 聚合酶激活20 s,95 ℃变性 3 s、60 ℃退火/延伸30 s,共40个循环。rt-PCR 试验数据结果采用2-△△Ct进行分析,试验重复3次。
1.5 Western-blot 检测细胞中相关蛋白的表达
各浓度FA-2-b-β 处理细胞48 h 后,采用BCA法测定蛋白浓度,制胶并电泳,再将蛋白转至PVDF膜封闭2 h。洗去封闭液,一抗(1∶1 000)孵育4 ℃过夜。再加入对应二抗(1∶5 000),孵育2 h,TBST 洗膜3 次,最后加入ECL 发光液,反应2 min 后上机曝光。试验重复3 次。Image J 软件分析结果条带灰度值。
1.6 免疫荧光检测P-gp蛋白表达
将细胞以2×104个/孔接种于爬片上,经各浓度FA-2-b-β处理48 h后,待固定、封闭结束,加入一抗(1∶200)4 ℃孵育过夜,后加入荧光二抗(1∶500),室温避光孵育1.5 h,使用DAPI 染核 3 min,滴加荧光防淬灭剂封片,荧光显微镜下观察蛋白表达情况。
1.7 流式细胞术检测胞内药物蓄积情况
不同浓度FA-2-b-β(0、1、2、3 mg/mL)处理细胞48 h,吸弃培养基并清洗各孔,加入含10 μmol/L ADR 的新培养基,避光孵育2 h。加入300 μL 的预冷PBS重悬,尼龙网过滤后上机检测。
1.8 流式细胞术检测细胞凋亡
收集不同浓度各组处理后的细胞,PBS 清洗3次。依次加入Annexin V-FITC 结合液300 μL、Annexin V-FITC 5 μL、PI 5 μL 重悬细胞,4 ℃避光孵育15 min,尼龙网过滤后上机检测。
将细胞以2×104个/孔接种于爬片上,经各浓度FA-2-b-β处理48 h后,固定并加入DAPI染色剂染色5 min,PBS 清洗细胞于荧光显微镜下观察并拍照。
1.9 流式细胞术检测细胞周期
收集六孔板中处于对数生长期各组细胞,加入不同浓度FA-2-b-β 处理48 h 后弃上清,清洗1 次,无水乙醇于-20 ℃固定过夜。再次重悬细胞,加入100 μL 的RNase A,37 ℃ 孵育15 min,加入400 μL PI 染色,4 ℃避光孵育30 min,过滤并上机检测。Modfit软件分析结果。
1.10 统计学分析
采用SPSS 22.0统计软件进行分析。计量资料用xˉ±s表示,多组比较采用方差分析(ANOVA),两两比较使用配对t检验,以P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 秦巴硒菇FA-2-b-β和阿霉素对K562、K562/ADR细胞增殖抑制作用
不同浓度FA-2-b-β 和阿霉素处理K562、K562/ADR 细胞后,存活率随浓度及时间增加而下降(图1)。秦巴硒菇FA-2-b-β对2种细胞的IC50分别为1.05、3.42 mg/mL;ADR对2种细胞的IC50分别为0.452,18.2 μmol/L,耐药系数为40.2。

图1 秦巴硒菇提取物FA-2-b-β对CML细胞增殖的影响Figure 1 Effect of FA-2-b-β on CML cell proliferation
选取低毒浓度FA-2-b-β(IC90=1.08 mg/mL)干预后的K562/ADR细胞,发现此时ADR对K562/ADR 细胞的IC50为10.99 mg/mL,逆转耐药倍数为1.65倍(表1)。与对照组比较,经秦巴硒菇FA-2-bβ分别处理后的2种细胞抑制率均显著升高,且FA-2-b-β 联用阿霉素组细胞增殖抑制率较单用阿霉素组升高,差异具有统计学意义(P<0.05)。
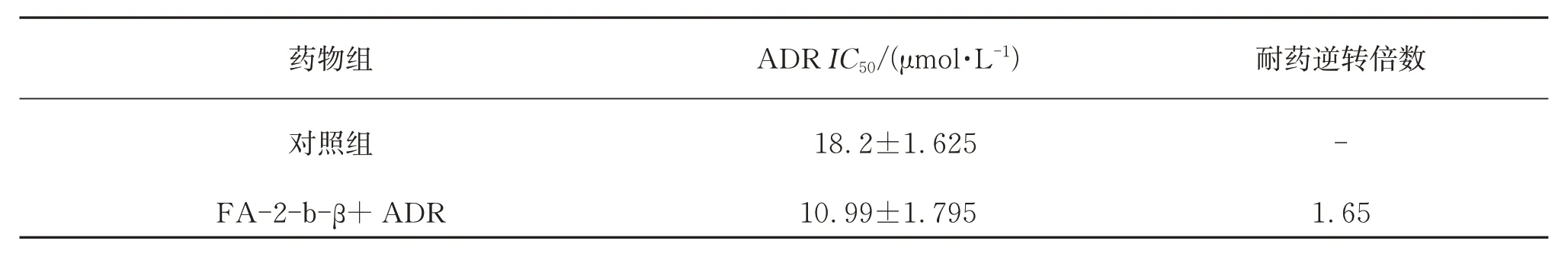
表1 秦巴硒菇提取物FA-2-b-β对K562/ADR细胞的耐药逆转作用Table 1 Anti-drug reversal effect of FA-2-b-β on K562/ADR cells
倒置显微镜观察完全培养基中K562/ADR 细胞形态,Control 组(0 mg/mL)FA-2-b-β 中细胞胞质透亮均匀,核仁区域形态正常,细胞生长较好。试验组干预48 h 后各组细胞胞质染色加深,透光性减弱,凋亡细胞胞膜破裂,内容物大量释出并附着于膜上(图2)。提示FA-2-b-β 对K562/ADR 细胞生长具有明显抑制作用。

图2 秦巴硒菇提取物 FA-2-b-β对K562/ADR细胞干预48 h后形态学的影响Figure 2 Effect of FA-2-b-β on the morphology of K562/ADR cell intervention after 48 h
2.2 FA-2-b-β 对 K562/ADR 中耐药和凋亡相关基因mRNA表达水平的影响
RT-qPCR结果显示,经FA-2-b-β干预,K562/ADR细胞 Bax、TP53 mRNA表达上调,K562/ADR细胞 MDR1 及p65 mRNA 表达下调,与对照组相比,差异有统计学意义(P<0.05,图3)。

图3 秦巴硒菇提取物FA-2-b-β干预CML细胞48 h后相关基因mRNA表达水平的影响Figure 3 Effect of FA-2-b-β on mRNA expression levels after 48h in CML cells
2.3 FA-2-b-β 对FA-2-b-β 细胞耐药、凋亡及FA-2-b-β通路相关蛋白表达水平的影响
不同浓度FA-2b-β 处理K562/ADR 细胞48 h后,Western-blot结果显示,3 mg/mL组中P-gp、P65蛋白表达降低(图4-A),P53、Bax、IKB-α 蛋白表达升高(图4-B),与对照组相比有统计学差异(P<0.05)。免疫荧光结果显示,各组细胞膜上P-gp蛋白荧光强度随药物浓度增加逐渐减弱(图5)。这与印迹结果大致一致。

图4 秦巴硒菇提取物FA-2-b-β作用于CML细胞48 h后相关蛋白表达水平的影响Figure 4 Effect of FA-2-b-β on the expression level of the associated protein after 48h in CML cells
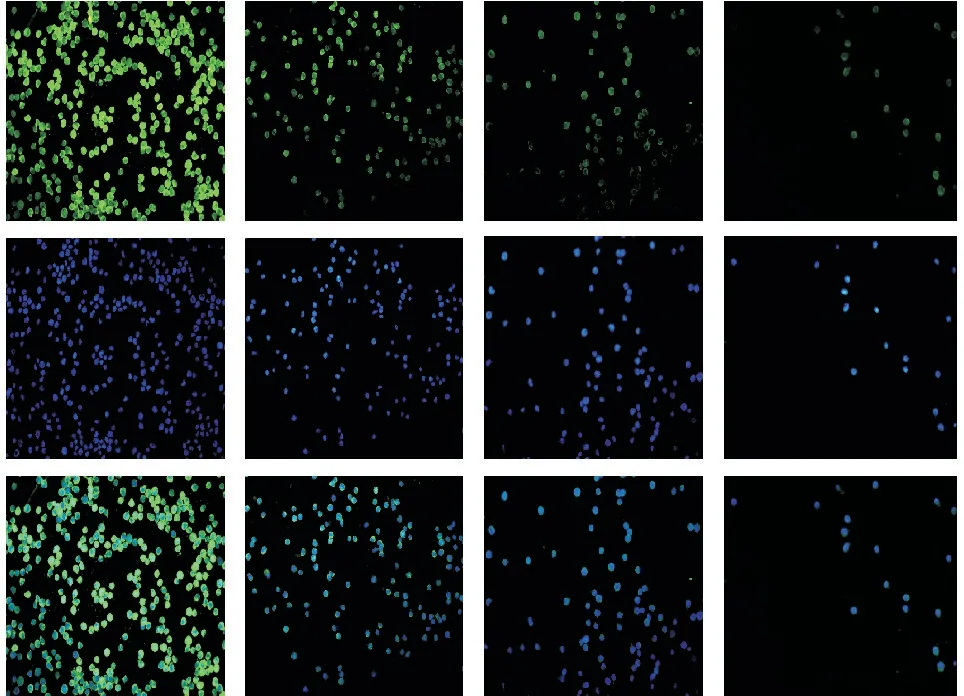
图5 免疫荧光染色观察秦巴硒菇提取物FA-2-b-β干预K562/ADR细胞48 h后耐药蛋白P-gp表达水平Figure 5 Immunofluorescence staining to observe FA-2-b-β intervention in K562/ADR cells after 48 h of drugresistant proteins P-gp expression level

图6 胞内荧光染色观察秦巴硒菇提取物FA-2-b-β干预K562/ADR细胞48 h后胞内药物的蓄积量Figure 6 Intracellular fluorescence staining to observe the accumulation of intracellular drugs after 48 h of FA-2-b-β intervention in K562/ADR cells.
2.4 秦巴硒菇FA-2-b-β 对 K562/ADR 细胞内药物蓄积量的影响
FA-2-b-β(1、2、3 mg/mL)干预各组细胞48 h后结果显示,与对照组相比(0 mg/mL),K562/ADR细胞内阿霉素蓄积量随浓度增加而增加(P<0.001)。
2.5 秦巴硒菇FA-2-b-β 对K562、K562/ADR 细胞凋亡的影响
细胞凋亡结果显示,与对照组比较,随着FA-2-b-β 浓度的增加,K562 细胞凋亡率依次为9.62%,36.68%,63.93%;K562/ADR凋亡率依次为21.7%,54.44%,64.37%。DAPI 染色显示,处理后K562/ADR 组细胞核区荧光强度逐渐升高,细胞凋亡增多(图7)。

图7 流式细胞术观察秦巴硒菇提取物FA-2-b-β对CML细胞作用48 h后凋亡的影响Figure 7 Flow cytometry to observe the effect of FA-2-b-β on apoptosis of CML cells after 48 h

图8 DAPI染色观察秦巴硒菇提取物FA-2-b-β对K562/ADR细胞作用48 h后凋亡的影响Figure 8 DAPI staining observed the effect of FA-2-b-β on apoptosis of K562/ADR cells after 48 h
2.6 秦巴硒菇FA-2-b-β 对K562、K562/ADR 细胞周期的影响
K562、K562/ADR 细胞与不同浓度(1、2、3 mg/mL)FA-2-b-β共同孵育48 h,结果显示,与对照组相比,K562 细胞G0/G1百分比增加,依次为26.03%,43.77%,54.49%;K562/ADR 细胞G2/M百分比增加,依次为21.7%,30.64%,35.1%,37.75%(图9)。

图9 秦巴硒菇提取物FA-2-b-β对CML细胞作用48 h后周期调控的影响Figure 9 Effect of FA-2-b-β on cell cycle regulation after 48 h of CML
3 讨论
化疗耐药是白血病治疗失败的主要原因之一。随着化疗药物和方案不断更新完善,白血病的治疗手段也有了更多选择。与此同时,肿瘤细胞所产生多药耐药问题也凸显出来。目前,调节耐药相关蛋白P-gp 表达及功能,是减少胞内化疗药物外排,提高化疗敏感性,是逆转肿瘤复发耐药的一个重要方向。例如,使用PI3K/mTOR 通路抑制剂Voxtalisib后,HL60/ADR和K562/A02中P-gp和MRP1基因的表达下调,并对阿霉素表现出一定的敏感性[20]。LncRNA FENDRR 还 能 够 通 过 miR-184/FENDRR/HuR/MDR1 信号通路来降低慢性粒细胞白血病中MDR1 蛋白的表达,以达到降低细胞对阿霉素耐药性的目的[21]。本研究通过对耐药株K562/ADR 使用秦巴硒菇提取物FA-2-b-β 干预,证实了FA-2-b-β 具有减少耐药蛋白P-gp 表达、增加胞内药物蓄积、阻滞细胞周期,并促进细胞凋亡的作用。同时也观察到,经典的NF-KB信号通路中关键蛋白表达也在药物干预后出现了变化。
经典NF-κB 信号通路中,RELA(p65)及NFKB1(p50)通过与IκB 的相互作用使其保持在非活性状态[22]。大量刺激物驱动(如炎症细胞因子、细菌脂多糖、病毒RNA,甚至神经递质等[23])后,导致IκB中的IKK依赖性磷酸化和蛋白酶体降解,二聚体p65/p50解除抑制并分离,并由此激活和参与了体内多种基因表达和蛋白的调节。其中包括对多药耐药蛋白1(MDR1/P-gp) 的表达水平的调节。研究表明,在抑制PI3K/AKT/NF-κB 通路后,人乳腺癌细胞MCF-7/ADR 中P-糖蛋白(P-gp)的表达也随之降低,MCF-7/ADR 对阿霉素表现出较低的耐药性[24]。本研究发现,高浓度的FA-2b-β能够上调通路中抑制性蛋白IκB-α的表达,同时减少二聚体蛋白p65 的表达,对NF-κB 信号通路活性表现出了明显的抑制作用。这与结果中耐药蛋白MDR1的表达降低相一致。可见,提取物FA能够通过抑制经典NFκB信号通路,降低K562/ADR细胞中P-糖蛋白的表达,从而增加肿瘤细胞对化疗药物的敏感性。
肿瘤抑制因子p53 参与DNA 修复、代谢、细胞周期停滞、细胞凋亡和衰老的众多基因的转录[25]。一方面能诱导转化细胞的凋亡[26],并在转录层面上上调凋亡相关蛋白(如Puma、Noxa、Bid 和Bax)表达,另一方面还可与Bcl-2 和Bcl-xL 的抗凋亡活性相互作用,共同调节细胞的凋亡过程[27]。p53的双重作用使得其发生的突变(主要是错义突变),能够抑制细胞凋亡,并导致治疗耐药性[28]。与p53突变相关的耐药包括顺铂,抗代谢物(吉西他滨),蒽环类药物(多柔比星),烷化剂(替莫唑胺)和具有特定靶标的药物,如EGFR抑制剂(西妥昔单抗)和抗雌激素(他莫昔芬)。可见,对于p53蛋白活性调节与肿瘤细胞耐药以及凋亡密切相关。本试验结果提示,经FA-2b-β 处理后,K562/ADR 细胞内p53 基因及蛋白产物的表达逐渐升高,同时促凋亡蛋白BAX表达也出现上升趋势。不难看出,FA-2b-β对K562/ADR 细胞所表现出的诱导凋亡作用,是通过调节p53蛋白及凋亡蛋白BAX 来实现的。BAX/Bcl-2 作为重要的凋亡相关蛋白,已被证实参与了多种肿瘤耐药的形成。据报道[29],Bcl-2相关转录因子1 (BCLAF1)的过度表达是非小细胞肺癌A549/DDP细胞产生耐药性重要机制之一。而促凋亡蛋白Bax的表达下降也与肿瘤细胞多药耐药性的产生相关联[30]。上文已述,FA-2-b-β 能够上调Bax 表达,同时又表现出对NF-κB信号通路的抑制作用。这两种效应之间的关联,可能与Bax/BCl-2 结合该通路中抑制性蛋白IκB-α 并且促进其降解,从而增强NF-κB 通路的活性有关[31],类似的,在其他白血病耐药相关研究中也发现了这一现象[32]。另外,流式细胞术也反映了FA-2-b-β 对K562 及K562/ADR 细胞的凋亡作用,并能够分别将2种细胞阻滞于G0/G1期和G2/M。此结果与本课题组前期研究相类似[33]。针对敏感株与耐药株所产生的不同阻滞效应,这可能和药物作用时所涉及到多个信号通路激活有关。在姜黄素诱导宫颈癌细胞凋亡的研究中,存在Wnt/β-catenin 和NF-κB 信号通路被药物共同抑制的现象,并将肿瘤细胞阻滞于G2/M 期[34]。本课题前期已证明,FA-2-b-β对K562细胞周期的阻滞及诱导凋亡作用均有wnt/β-catenin通路的参与[33],在本研究中FA-2-b-β同样表现出了对经典的NF-κB 信号通路的显著抑制性,并能够诱导细胞发生凋亡和周期阻滞。由此,我们可以推论,FA-2-b-β在体内发挥逆转耐药及诱导肿瘤细胞凋亡的过程是多通路,多蛋白,多靶点共同参与完成的,对于该过程中所涉及到的具体信号通路及其明确的作用方式,有待后续更为深入研究来阐明。
4 结论
综上,秦巴硒菇提取物FA-2-b-β 一方面抑制K562/ADR细胞中NF-κB信号通路活性,减少耐药基因及相关蛋白表达,并抑制转运蛋白功能。另一方面,FA-2-b-β上调促凋亡基因Bax和p53及相关蛋白,对K562/ADR 细胞生长发挥抑制和促凋亡作用。但对于更为具体作用机制和作用方式的探究,需结合后续体内试验做进一步论证。总之,秦巴硒菇提取物FA-2-b-β具有多靶点,多机制逆转K562/ADR细胞耐药性的潜在效力。

