单细胞核测序揭示成年小鼠心脏构成细胞的分群及占比
梁春宝,李立林,蔡冬青*
(暨南大学 1.再生医学教育部重点实验室;2.科技部广东省国际科技合作基地;3.发育与再生生物学系,广东 广州 510632)
目前研究已证实心脏的构成细胞主要包括心肌细胞、血管内皮细胞、成纤维细胞、非成纤维类间质细胞、平滑肌细胞、周细胞、少量的炎症及免疫细胞等,但不同物种之间(例如鼠类和人)的心脏细胞构成的占比存在差异[1-5]。因此,探究不同物种之间的心脏构成细胞的差异,揭示心脏构成细胞的标记基因,分析不同类型细胞的组成比例,对阐明心脏细胞彼此间相互作用的调控机制有重要意义,同时也可为精准靶向干预心脏某一种细胞提供作用靶标。
目前小鼠及其不同基因修饰品系已经成为生物医学研究的重要模型[6]。Banerjee等[1]使用抗细胞表面标记抗体的流式技术分析了成年小鼠心脏约56%的细胞为心肌细胞,27%为成纤维细胞,7%为内皮细胞,10%为血管平滑肌细胞。Pinto等[2]使用基因标记结合细胞标记技术分析了小鼠心脏的非心肌细胞,其中内皮细胞占比大于60%,成纤维细胞占比小于20%,造血系来源细胞占比5%~10%。而单细胞测序作为新兴的测序技术,能在单个细胞水平揭示细胞基因表达个体的异同,通过对个体基因表达的聚类分析实现对组织与器官构成细胞进行有效地分群,确定其相对特异表达的标记基因及计算不同群细胞在每个组织与器官的占比[7-8]。与单纯依赖细胞相对特异性表达标记物对组织与器官的构成细胞进行分群及占比分析技术相比,单细胞核测序优点在于:可不依赖标记物进行构成细胞的精确分群;揭示其相对特异的标记基因;实现单细胞水平展示某个细胞群在总构成细胞的百分比[9-10]。本研究使用单细胞核测序探究成年小鼠心脏构成细胞的分群及各群细胞所属类别,相对特异标记基因及各细胞群在心脏构成细胞的占比。
1 材料与方法
1.1 材料
1.1.1 实验动物
采用2只健康状况良好、达到实验研究要求的2月龄C57BL/6J雄鼠。实验小鼠购于北京维通利华公司(实验动物使用许可证:SYXK[粤]2022-00174,实验动物生产许可证:SCXK[粤]2021-0057,质量合格证:NO.44826500001948),体质量为22~23 g,饲养于暨南大学实验动物管理中心,恒温(22±1)℃,相对湿度50%~70%,小鼠自由摄取食物、水,昼夜循环光照。动物护理、手术和处理程序按照中华人民共和国科学技术部[(2006)398]规定并经暨南大学动物护理委员会批准(审批号:IACUC-20180712-04)。
1.1.2 试剂与仪器
主要试剂:无水乙醇购于广州化学试剂厂。细胞核分离试剂盒(Cat.on.52009-10)、MACS® 细胞分离缓冲液(BSA) Stock Solution(Cat.on.130-091-376)、台酚蓝染液(C0011)等购于上海伯豪公司。
主要仪器:混匀仪(Vortex-6)为其林贝尔公司产品,高速冷冻离心机(Allegra X-15R)为德国 Eppendorf 公司产品,细胞计数仪(CountessTMⅡ Automated Cell Counte)为美国Thermo Fisher公司产品。数据分析使用服务器(Dell R450)为本实验室自备。心脏单细胞核测序委托上海伯豪测序公司完成。
1.2 研究方法
1.2.1 小鼠心脏单细胞核测序样本制备
(1)心脏组织裂解 将2只C57BL/6J小鼠安乐死,并置于乙醇中浸泡消毒,分离并取出心脏。使用细胞核分离试剂盒制备心脏构成细胞的细胞核,主要步骤如下:裂解液中加入现配的 MACS® BSA Stock Solution,使其终质量分数为 1%,加入1 mL 配制好的含质量分数1% MACS® BSA Stock Solution的裂解液到一个2 mL EP 管中,并加入心脏组织样本,使用组织匀浆仪研磨组织至液态后,冰中放置 10 min 使其充分裂解。
(2)心脏细胞核制备 使用40 μm孔径滤膜去除充分裂解心脏组织溶液的组织碎片,使用2 mL EP管收集滤过液,在4 ℃,1 600 r/min离心5 min后去掉上清液,并加入300 μL含1%BSA的裂解液,充分吹打重悬收集的细胞核,将悬液移入一个新的2 mL EP管中,加入300 μL抽提试剂1(PB1)溶液,使用1 mL移液枪,充分吹打混匀。使用1 mL移液枪吸取600 μL抽提试剂2(PB2)溶液,将枪头插到如上含PB1溶液的经收集细胞核混合液的EP管最底部,缓慢加入PB2溶液,使溶液分层,然后使用1 mL移液枪吸取600 μL抽提试剂3(PB3)溶液,将枪头插到含PB1和PB2溶液的经收集细胞核混合液的EP管最底部,缓慢加入抽提试剂PB3溶液,待溶液分层,在4 ℃,10 000 r/min离心20 min使经收集的心脏细胞的细胞核被分离于PB2与PB3溶液层的交界处,然后,使用移液枪依次移除最上层的上清溶液约600 μL及细胞核层以上的溶液约500 μL后,收集经分离的细胞核层(约150 μL)并置于1.5 mL EP管。
(3)心脏细胞核计数 加入1 mL 重悬溶液(NB)充分吹打混匀经收集的细胞核,使用40 μm孔径滤膜去除组织碎片,4 ℃ 1 600 r/min离心5 min后去除上清,加入0.5 mL NB溶液,吹打重悬细胞核进行清洗,并重复该清洗步骤1次。取5 μL经清洗的心脏细胞核悬液,使用台酚蓝染色后,在显微镜下对经收集的细胞核进行计数,将经确认浓度的心脏构成细胞的细胞核用于10× Genomics单细胞测序分析。
1.2.2 10× Genomics单细胞测序
(1)cDNA反转录及质控 将制备好的心脏细胞的细胞核悬液(约1 500个/μL)与cDNA(33.4 μL)反转录试剂混合,10× barcode凝胶磁珠(50 μL)和测序包裹用的油液(45 μL)分别加入到Chromium Chip B的小室,使用微流控设备的“双十字”交叉系统形成GEM(Gel Beads-in-emulsion),将形成的GEM转移到PCR管中,并置于PCR仪进行反转录,然后经凝胶磁珠上含有30nt oligo-dT的反转录引物,使收集细胞核中的poly-A RNA被反转录为带有Barcode和UMI信息的cDNA,然后使用SPRIselect磁珠纯化系统(60 μL)纯化经反转录的cDNA,并使用PCR对所有的cDNA一链进行扩增,使用Qubit检测cDNA浓度,使用Agilent 2100检测对经制备的cDNA片段大小进行质控。
(2)测序文库构建 经制备的cDNA使用Fragment酶进行酶切,使其片段化后,使用磁珠筛选350~500 bp的最适片段,并进行末端修复以加入PolyA及接头连接Read2的测序引物,通过PCR扩增的方式构建含有P5和P7接头的cDNA文库,然后使用SPRIselect磁珠对文库进行纯化,使用Qubit检测cDNA浓度,使用Agilent 2100检测对经制备的cDNA片段大小进行质控。
(3)上机测序 按照Illumina User Guide完成 Cluster生成和第一向测序引物杂交,将携有Cluster的Flow cell 上机,选用Paired-end 程序进行双端测序,整个测序过程由 Illumina的Data collection software 进行控制,并进行实时数据分析,从而获取原始测序数据。
(4)测序后原始数据提取 使用Cellranger软件[11]将测序的数据从Fastq文件转为细胞表达矩阵,并在Ensembl数据库下载小鼠基因库数据及对应的Gtf文件,使用Cellranger 软件的Mkref命令建立以小鼠基因为背景的参考数据集,使用Cellranger count、Cellranger aggr 和Cellranger reanalyze命令处理经解析的Fastq文件,建立以小鼠基因为背景的基因表达矩阵文件,供Seurat分析使用。
1.2.3 单细胞核测序数据分析
(1)数据质控 使用scCancer分析包[12]对建立的基因表达矩阵文件数据进行质控参数分析,获取单个细胞核所检测到的基因数目(nFeature_RNA)在200~2 829区间内的原始数据(图1)的细胞表达矩阵文件数据导入Seurat(R包)软件[13],使用Subset命令对数据集进行质控筛选,通过执行质控指标去除基因表达数目过高(一个凝胶磁珠含有多个核)或者过低(细胞碎片)的数据。

图1 单个细胞核所检测到基因数目分布
(2)数据标准化 使用NormalizeData命令对达到质控要求的基因表达矩阵数据进行数据归一,其参数选取normalization.method = “LogNormalize”,scale.factor = 10 000。
(3)数据降维 使用ScaleData和Runpca对上述获得的数据进行缩放、降维处理,根据Elbowplot指标筛选数据中的主成分,同时使用FindVariableFeatures函数甄别出数据集中细胞间表现为高变异性特征的基因(即在某些细胞中高表达却在其他细胞中低表达的基因)。本部分的分析,使用 selection.method = “vst”,nfeatures = 2 000的参数,对细胞与细胞之间表达存在高变的基因进行分类分析。
(4)细胞聚类 基于 t-distributed Stochastic Neighbor Embedding(tSNE)聚类分析要比 Uniform Manifold Approximation and Projection(UMAP)聚类分析具有更为精细的分群功能[14],本研究使用tSNE进行分群聚类。
(5)细胞类型注释 使用FindeMarkers函数,提取各个细胞群的标记基因,甄别出每个细胞群与其它群的差异基因,作为该细胞群的标记基因,结合使用cellmarker数据库[15]与目前广为认可的不同细胞类型的标记基因进行匹配,运用Featureplot函数可视化,并在tSNE聚类分群图中注释出相应群的细胞属性类别。
2 结果
2.1 单细胞核测序显示小鼠心脏构成细胞分群
使用scCancer分析软件包对单细胞核测序的原始数据进行分析,设定单个细胞核所检测到的基因数目(nFeature_RNA)的参数区间为200~2 829个(图1)进行去除死细胞,细胞碎片,多细胞液滴及空液滴,使线粒体基因的占比为零(图2),然后进行有效细胞的统计,相应结果显示:数据质控前共检测到12 965个细胞,质控后共有12 411个细胞,达到单细胞分析的质控要求,可以用于进一步的细胞分群等分析。对达到单细胞质控要求的单细胞测序数据,使用NormalizeData函数进行归一化,使用ScaleData函数进行标准化,然后使用PCA函数进行主成分分析,并根据ElbowPlot使用位列前30位的主成分进行后续分析(图3)。使用tSNE聚类法,以聚类参数Dims(主成分)为30,Resolution(分辨率)为0.5对相应的主成分数据进行细胞聚类,可将小鼠心脏细胞分为0至18,共19个群(图4)。
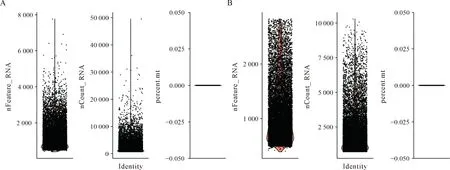
A:单细胞核测序原始数据的nFeature_RNA和nCount_RNA分布图;B:单细胞核测序原始数据去除死细胞,细胞碎片,多细胞液滴及空液滴后的nFeature_RNA和nCount_RNA分布图;当nFeature_RNA数目在200~2 829基因数目区间时,线粒体基因的占比为零;nFeature_RNA:每个细胞中检测到的基因数量;nCount_RNA:细胞内检测到的分子总数;percent.mt:数据中线粒体相关基因所占比例

A:主成分分析;B:前30个主成分碎石图

图4 小鼠心脏细胞的tSNE聚类
2.2 心脏构成细胞种类及相对特异的标记基因
使用目前普遍认可的Cellmarker库的不同细胞类型的标记基因(表1),对该19个心脏细胞群(图4)进行细胞类型注释,经注释后可将其分为10个细胞类型群(图5),其中,第2,3和7群被注释为心肌细胞(cardiomyocytes),其特异性表达Actn2,Tnnc1,Rcan2和Tnnt2基因(图6);第0,4,8和9群被注释为内皮细胞(endothelial Cells),其特异性表达Pecam1和Cdh5基因(图7);第1群被注释为成纤维细胞(fibroblasts),其特异性表达Col1a2,Col3a1,Col1a1和Pdgfra基因(图8);第5群被注释为周细胞(pericytes),其特异性表达Rgs5和Abcc9基因(图9);第6,17和18群被注释为免疫细胞(immune Cells),其特异性表达Cd74,Cd83,Cd86和Cd163基因(图10);第10群被注释为心内膜细胞(endocardial Cells),其特异表达Hmcn1和Cgnl1基因(图11);第11和12群被注释为平滑肌细胞(smooth muscle cells),其特异性表达Dgkb,Acta2,Kcnab1和Myh11基因(图12);第13和14群被注释为心脏胶质细胞(cardiac glial cells),其特异性表达Cadm1和Slc35f1基因(图13);第15群被注释为间皮细胞(mesothelial cells),其特异性表达Wdr17,Gpm6a,Msln和Bnc1基因(图14);第16群被注释为成肌细胞(myoblasts),其特异性表达Pard6g,Mmrn1和Reln基因(图15)。上述10个细胞群的前10个高表达及低表达差异基因的比较热图,揭示上述各群细胞在相应基因的表达存在差异(图16A)。
2.3 心脏各构成细胞群的占比
对上述经注释的各细胞群占总细胞数的百分比进行统计显示:内皮细胞占39.46%,心肌细胞占26.56%,成纤维细胞为13.46%,周细胞为6.63%,免疫细胞为5.17%,平滑肌细胞为2.97%,心内膜细胞为2.12%,心脏胶质细胞为2.05%,间皮细胞为0.96%,成肌细胞为0.63%。其中内皮细胞,心肌细胞,成纤维细胞是心脏位列前3位的构成细胞(表1和图16B)。

表1 tSNE聚类细胞属性Table 1 tSNE cell attribute
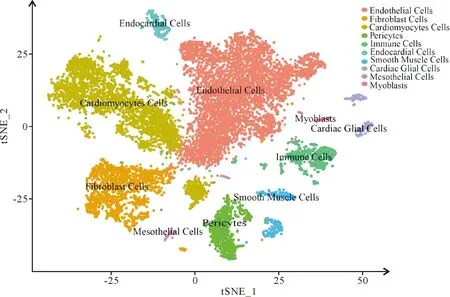
图5 小鼠心脏细胞tSNE聚类的细胞属性注释

图6 tSNE聚类展示心肌细胞的标记基因

图7 tSNE聚类展示内皮细胞的标记基因
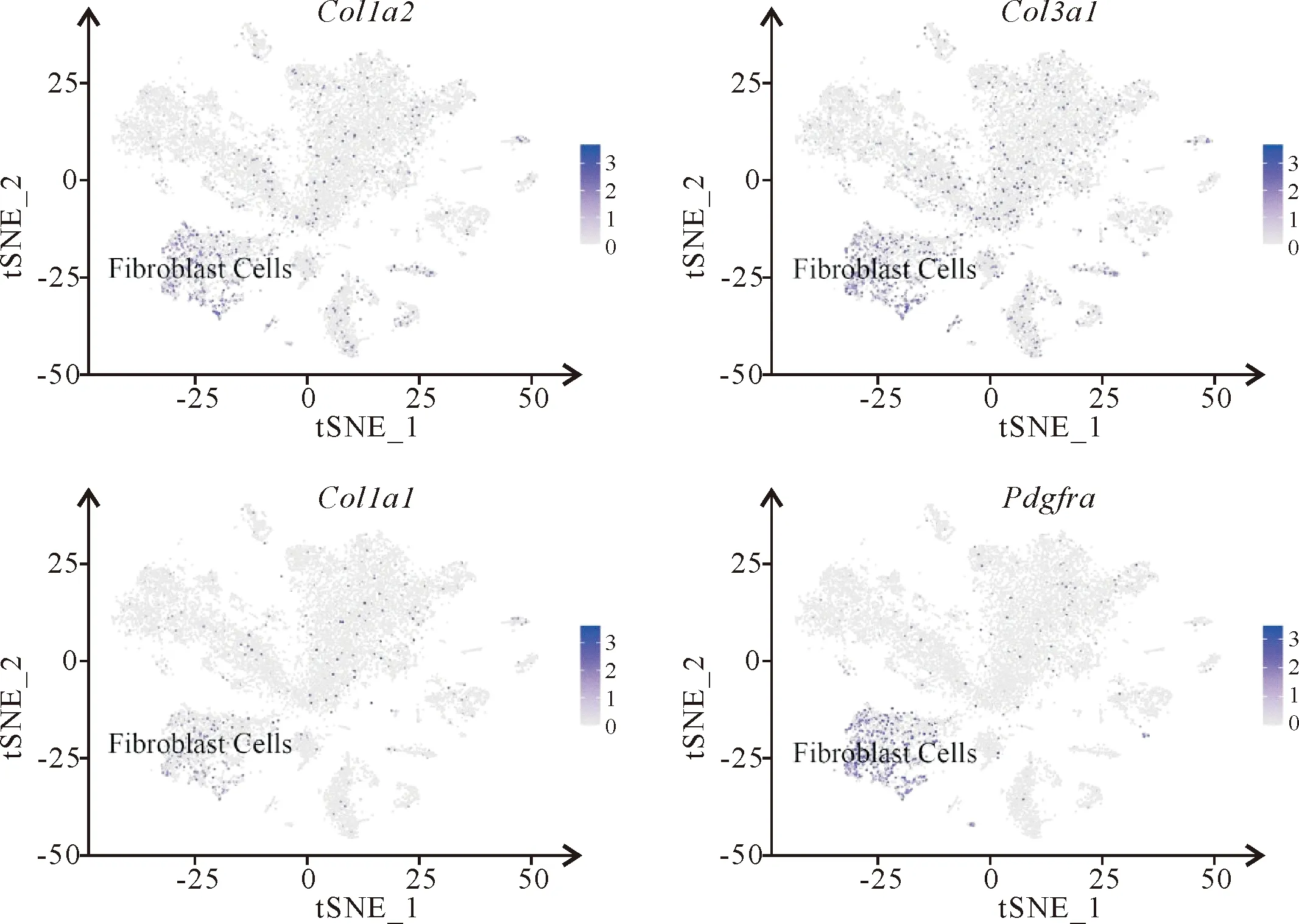
图8 tSNE聚类展示成纤维细胞的标记基因

图9 tSNE聚类展示周细胞的标记基因

图10 tSNE聚类展示免疫细胞的标记基因
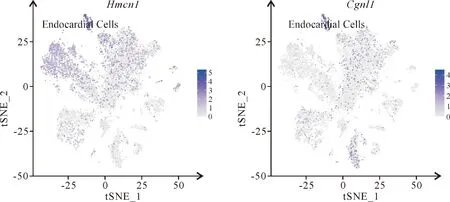
图11 tSNE聚类展示心内膜细胞的标记基因

图12 tSNE聚类展示平滑肌细胞的标记基因
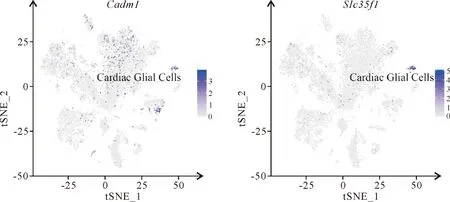
图13 tSNE聚类展示心脏胶质细胞的标记基因

图14 tSNE聚类展示间皮细胞的标记基因

图15 tSNE聚类展示成肌细胞的标记基因

A:小鼠心脏不同细胞群前10位差异表达基因的热图;B:小鼠心脏不同细胞类型的占比图
3 讨论
过往对心脏构成细胞的共识认为心肌细胞约占心脏构成细胞的30%~40%[15-16],而对心脏其他构成细胞具体分群和不同心脏构成细胞在心脏细胞的占比,有待深入研究。单细胞测序研究新进展证明:单细胞测序(包括单细胞和单细胞核测序)能通过对每个单细胞转录谱的相似聚类及比较分析,实现对组织与器官构成细胞进行精准的分群,细胞种类注释,相应细胞群标记基因及构成细胞的占比等比较分析[17-20]。本研究使用单细胞核测序,从单细胞水平揭示成年小鼠心脏的构成细胞主要有10种细胞类型,血管内皮细胞占心脏构成细胞的39.46%,心肌细胞为26.56%,成纤维细胞为13.46%,周细胞为6.63%,免疫细胞为5.17%,平滑肌细胞为2.97%,心内膜细胞为2.12%,心脏胶质细胞为2.05%,间皮细胞为0.96%,成肌细胞为0.63%。血管内皮细胞为心脏构成细胞数目最多的细胞,心肌细胞次之,而成纤维细胞位列第3。本研究的结果与Banerjee等[1]使用抗细胞表面标记抗体的流式分析法的研究报道存在显著的不一致,他们的研究显示:成年小鼠心脏约56%的细胞为心肌细胞,27%为成纤维细胞,7%为内皮细胞,10%为血管平滑肌细胞,导致差异的原因可能与使用的细胞分离技术、能否有效把心脏的构成细胞进行有效分离与回收以及有效清除分离心肌细胞时产生的死亡细胞碎片等有关。本研究使用单细胞测序分析,可有效避免了心肌细胞体积大,心肌细胞分离产生碎片等对测序结果准确性的影响,单细胞水平检测具有精确度高的优点[7,9],因此,本研究的心脏构成细胞分群及其各群在心脏细胞的占比具有较高的可信性。本研究结果与Pinto等[2]结果相似,他们使用细胞命运示踪结合细胞标记物流式分析技术显示小鼠心脏中血管内皮细胞占心脏非心肌细胞的60%左右,成纤维细胞占心脏非心肌细胞的20%左右。如将本研究的成年小鼠心脏心肌细胞去除,血管内皮细胞和成纤维细胞占心脏非心肌细胞比例分别为53.72% 和18.33%,两者的结果十分接近,均提示鼠类心脏构成细胞中,细胞占比最高的为血管内皮细胞,心肌细胞次之,而成纤维细胞位列第3。
本研究结果也显示,心脏构成细胞除了上述3种细胞类型外,还有周细胞、免疫细胞、平滑肌细胞、心内膜细胞、心脏胶质细胞、间皮细胞和成肌细胞等,均为心脏重要的构成细胞。过往基于形态结合特异性标记物的免疫组化及免疫荧光等的系列研究均证明心脏的构成细胞中存在周细胞[21]、免疫细胞[22]、平滑肌细胞[23]、心内膜细胞[24]、心脏胶质细胞[25]和间皮细胞[26],并在心脏的生理与病理调控充当重要功能,但对上述细胞在心脏构成细胞的占比尚有待明确,本研究从单细胞测序角度,揭示了上述细胞在成年小鼠心脏构成细胞的占比,为进一步研究上述细胞在心脏功能中发挥的作用等提供了重要依据。最近研究表明心脏不同构成细胞之间存在彼此密切的相互作用,心肌细胞可以分别与血管内皮细胞及包括心脏成纤维细胞在内的心脏间质细胞等构成一个彼此密切互作的“心肌功能单位”,在心脏生理与病理活动中发挥重要的作用[27]。因此在阐述心脏正常功能维持及心脏病理发生的相应机制时,应同时考虑上述细胞的功能及其分别与心肌细胞、血管内皮细胞和成纤维细胞的相互作用,才能更为全面揭示心脏生理与病理的调控机理。本研究还提示在心脏构成细胞中存在约0.63%既往没有被报道过的成肌细胞群,其细胞表型及功能等还有待进一步地研究。最近研究认为成年心脏中有约1%的心肌细胞具有分裂增殖功能[28],而本研究发现心脏构成细胞中存在成肌细胞群,该类细胞是否与其可以分裂的成年心肌细胞有关,值得进行深入研究。
通过在单细胞水平对上述各细胞群的相对特异性基因进行比较分析,本研究发现构成心脏的血管内皮细胞、心肌细胞、成纤维细胞、周细胞、免疫细胞、平滑肌细胞、心内膜细胞、心脏胶质细胞、间皮细胞和成肌细胞的相对特异性表达的标记基因,利用其相对特异的标记基因,结合目前公认的相应细胞群的标记基因,进行深入的功能验证研究,将有可能进一步揭示上述不同群细胞在心脏生理与病理中所发挥的作用,为针对心脏构成细胞的精准干预疗法提供参考。
作者贡献声明
梁春宝:实验的实施、数据分析、图表制作、论文撰写;李立林:小鼠心脏单细胞测序样本准备;蔡冬青:提出研究框架、研究设计、论文修改。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。

