颈动脉斑块超声造影特征与急性脑梗死面积的关系
方桂婷,井珍,张华国,李金花,赖晓敏,钟兴*
(1.暨南大学 附属第一医院 超声医学科,广东 广州 510630;2.暨南大学 附属第一医院 神经内科,广东 广州 510630)
脑卒中是目前我国首位的致死和致残的疾病,其中70%~80%为缺血性脑卒中即脑梗死,其导致的身体功能残疾取决于首次脑梗死的发病时间和严重程度[1-2]。大面积脑梗死是缺血性脑卒中预后最差且死亡率最高的原因,因大面积脑梗死起病急、发展迅速、并发症多,临床处理困难,死亡率高达53%~78%[3-4]。故对急性大面积脑梗死的早期预测和预防有重要的临床意义。颈动脉粥样硬化斑块是导致急性脑梗死发生发展的重要原因之一,斑块的易损性与脑梗死的发生和复发关系密切[5-7],但关于颈动脉斑块与脑梗死面积关系的临床研究较少,这个问题值得深入探讨。高频超声是临床上检查颈动脉最常采用的方法,本研究对比急性脑梗死患者与非脑梗死患者的颈动脉斑块的超声造影特征,分析急性脑梗死面积大小与颈动脉斑块超声造影特征的关系,以期为急性脑梗死病情判断提供参考依据。
1 资料与方法
1.1 研究对象
回顾性分析2017年10月至2018年5月期间80例行颈动脉超声造影检查的病例资料。本研究通过暨南大学附属第一医院伦理管理委员会批准(伦理审批号为KY-2023-061)。急性脑梗死组的纳入标准:①根据《中国急性缺血性脑卒中诊治指南2018版》[8],经头颅磁共振成像(magnetic resonance imaging,MRI)检查明确显示有急性脑梗死病灶者。②脑梗死病灶的同侧颈总动脉/颈内动脉至少有一个厚度大于2.0 mm的斑块。无脑梗死对照组的纳入标准:①经MRI检查明确无急性脑梗死病灶。②双侧颈总动脉/颈内动脉至少有一个厚度大于2.0 mm的斑块。急性脑梗死组与对照组的排除标准:①存在其他脑部病变。②颈动脉斑块内有较大的钙化影响超声造影。③对超声造影剂过敏者。急性脑梗死患者采用Adams分型[9]进行分类,根据头颅MRI中扩散加权成像序列(diffusion weighted imaging,DWI)显示的脑梗死面积进行分组:脑梗死病灶最大层面直径≥3.0 cm为大面积脑梗死组,脑梗死病灶最大层面直径<3.0 cm为小面积脑梗死组。本研究脑梗死组共纳入56个斑块,其中大面积脑梗死组24个,小面积脑梗死组32个;而对照组颈动脉斑块共24个。
1.2 研究方法
1.2.1 检查仪器
采用飞利浦iU elite彩色多普勒超声诊断仪,选取9~11 MHz血管线阵探头,超声造影剂为意大利 Bracco公司六氟化硫微泡(SonoVue)。
1.2.2 检查及评估方法
(1)颈动脉超声检查 患者仰卧位,将头转向检查对侧,脑梗死组观察脑梗死病灶侧的颈动脉斑块,选取最厚(厚度≥2.0 mm)的斑块作为目标斑块进行观察;对照组观察两侧颈动脉的斑块,选取最厚(厚度≥2.0 mm)的斑块作为目标斑块进行观察。
(2)颈动脉超声造影检查 患者取仰卧位,将头转向检查对侧,选择造影双辐模式,调节机械指数(MI 0.10),将目标斑块的最大切面放置于屏幕中央。嘱患者在造影过程中平静呼吸、避免吞咽动作及咳嗽。用0.9%无菌氯化钠注射液5 mL充分稀释造影剂后,快速推注入肘静脉,随后推注5 mL 0.9%的无菌氯化钠注射液,启动机器计时器并存储动态图像约2 min。
(3)颈动脉斑块超声造影评估方法 颈动脉斑块超声造影半定量评估[10]:Ⅰ级为斑块内无微泡或见少量微泡;Ⅱ级为斑块肩部有微泡或斑块内见中等量微泡;Ⅲ级为微泡弥漫分布整个斑块内。
(4)颈动脉斑块的时间-强度曲线定量分析评估 造影结束后导出数据,运用飞利浦定量分析软件(QLAB)勾勒整个斑块区域为斑块感兴趣区及斑块邻近的血管腔感兴趣区,制作时间-强度定量曲线后导出相对应的定量参数:增强强度(enhance intensity,EI)、上升时间(rise time,RT)、峰值强度(peak intensity,PI)、平均通道时间(mean transit time,MTT)、曲线下面积(area under the curve,AUC)、峰值降半时间(time from peak to one half,TPH)、达峰时间(time to peak,TTP)。
由两名超声造影经验丰富的高年资医师分析斑块超声造影图像,评估斑块超声造影的半定量分级。当两名医生判断结果不一致时,则经讨论后得出最终判断结果。
1.3 统计学分析
2 结果
2.1 临床资料比较
本研究80例患者中,大面积脑梗死组24例,男20例,女4例,年龄38~82岁,平均(63.33±10.58)岁;小面积脑梗死组32例,男23例,女9例,年龄43~82岁,平均(66.06±11.45)岁,对照组24例,男17例,女7例,年龄45~77岁,平均(64.24±10.80)岁。各组年龄及性别之间比较差异无统计学意义(P>0.05),具有可比性。
2.2 颈动脉斑块的超声造影半定量参数比较
大面积脑梗死组半定量参数Ⅰ级占比为8.33%,Ⅱ级占比为25.00%,Ⅲ级占比为66.67%;小面积脑梗死组Ⅰ级占比为21.87%,Ⅱ级占比为40.63%,Ⅲ级占比为37.50%;对照组:Ⅰ级占比为37.50%,Ⅱ级占比为41.67%,Ⅲ级占比为20.83%,3组间差异有统计学意义(2=11.44,P=0.01),见图1~2。
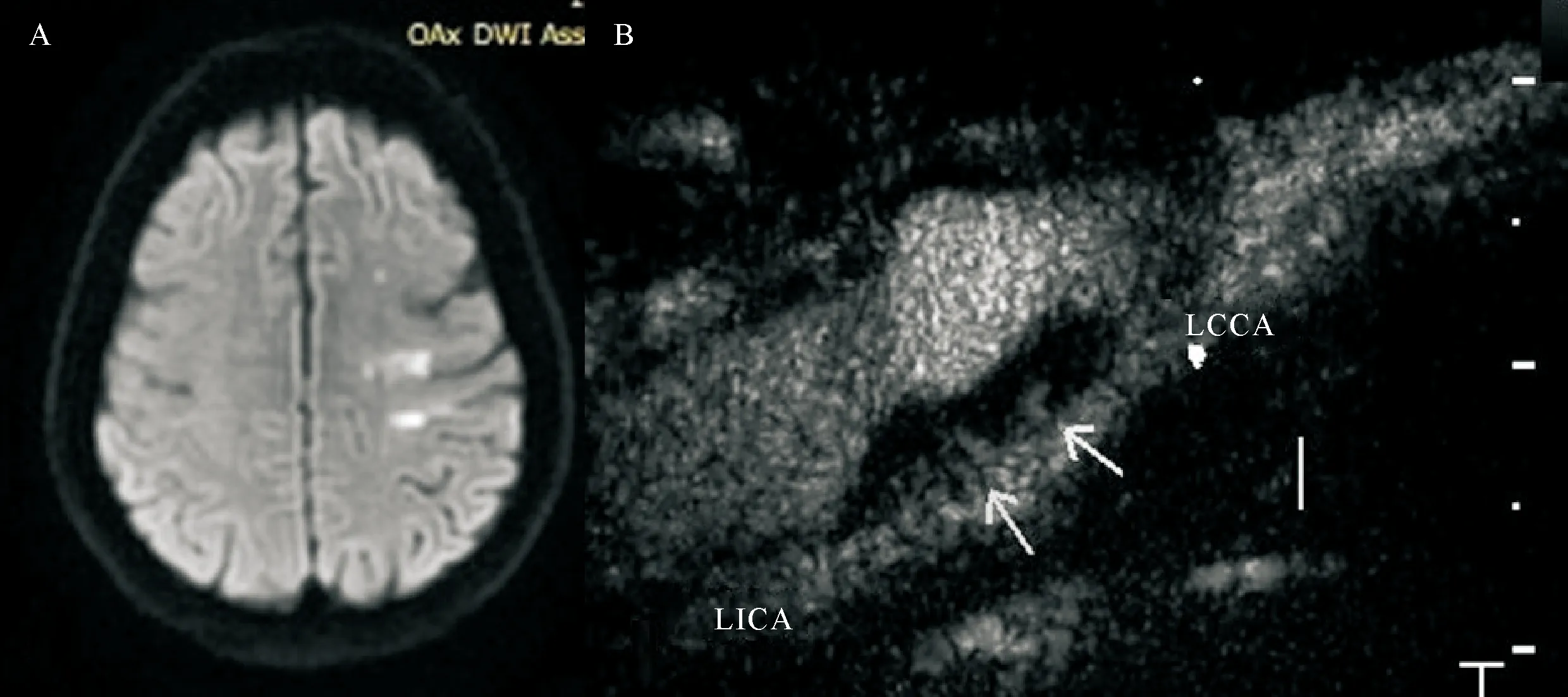
A:头颅MRI示左侧颞枕叶急性小面积脑梗死;B:同一患者左侧颈内动脉起始处斑块的超声造影,内见中等量微泡(新生血管分级为Ⅱ级)

A:头颅MRI显示右侧额叶急性大面积脑梗死;B:同一患者右侧颈内动脉起始处斑块的超声造影,内见弥漫分布微泡(新生血管分级为Ⅲ级)
2.3 颈动脉斑块的超声造影定量参数比较
时间-强度曲线结果分析显示,大面积脑梗死组、小面积脑梗死组、对照组3组间EI的差异有统计学意义(F=7.01,P=0.01)。其中大面积脑梗死组EI为(4.23±3.06)高于小面积脑梗死组为(24.87±1.81)及对照组为(1.95±1.17),组间差异均有统计学意义(P=0.01)。3组间的峰值强度(PI)值差异有统计学意义(F=5.84,P=0.01);其中大面积脑梗死组为(5.69±2.71)高于小面积脑梗死组的(3.97±2.48),差异有统计学意义(P=0.01);小面积脑梗死组PI为(3.97±2.48)高于对照组(3.53±1.63),但差异无统计学意义(P>0.05),见表1。

表1 3组间颈动脉斑块超声造影定量参数比较Table 1 Comparison of quantitative parameters of contrast-enhanced ultrasound in carotid plaque among three groups
3 讨论
颈动脉粥样硬化斑块与急性脑梗死发生关系密切,相对于颈动脉管腔狭窄,颈动脉易损斑块的破裂、脱落导致远端动脉堵塞是导致急性脑梗死的重要原因[11-12]。
斑块内的新生血管是易损斑块的重要特征之一[13-14]。斑块内缺氧微环境刺激外膜的滋养血管向内膜扩展生长,导致斑块内未成熟新生血管的形成以供应更多的氧气和营养物质。而斑块内未成熟新生血管由于通透性增加,导致炎症细胞渗漏,进一步刺激新生血管生成。斑块内新生血管因通透性增加及管壁发育未成熟,容易导致红细胞发生渗漏和新生血管破裂出血,导致斑块不稳定[15-19]。颈动脉粥样硬化斑块的超声造影是目前临床上安全、无创显示斑块内新生血管的重要方法。Feinstein[20]研究发现短暂性脑缺血发作患者颈动脉斑块超声造影图像显示的新生血管与病理样本的新生血管有很好的相关性。Coli[21]的研究表明斑块超声造影显示的新生血管密度分级与斑块的组织学血管密度相匹配。
本研究在超声造影模式下将颈动脉斑块内的新生血管通过半定量和定量两种方式进行分析。参照文献[10]将新生血管半定量分级分为Ⅰ~Ⅲ级,发现大面积脑梗死组斑块内Ⅲ级占比最高,对照组斑块Ⅲ级占比最低,提示大面积脑梗死组患者的颈动脉斑块新生血管密度高于小面积脑梗死组及对照组。QLAB软件定量分析斑块的增强时间-强度曲线显示急性脑梗死组的斑块EI值较对照组增高,并且大面积脑梗死组EI值高于小面积脑梗死组,差异均有统计学意义;同时,大面积脑梗死组的PI值高于小面积脑梗死组,差异也有统计学意义。EI和PI为超声造影中定量反映斑块内新生血管密度的指标,提示大面积脑梗死组新生血管密度高于小面积脑梗死组与对照组,说明脑梗死面积与颈动脉斑块内新生血管密度有关,即斑块内新生血管越丰富,斑块越不稳定,容易发生出血、破裂及脱落,造成大面积脑梗死的发生[22]。
因此,超声造影对颈动脉斑块内新生血管分布情况有很好的显示作用,通过半定量和定量分析评估斑块的新生血管密度,在一定程度上可帮助临床早期识别大面积脑梗死,有助于预测急性脑梗死的发生和判断预后。
本研究存在一定的局限性:①本研究纳入样本数量有限,后续研究将继续扩大样本量。②本研究纳入的样本为脑梗死病灶侧颈动脉厚度最大的斑块,而该斑块不一定是导致脑梗死发生的责任斑块。
作者贡献声明
方桂婷:提出研究思路,协助实验;井珍:协助实验;张华国:统计分析及校对工作;李金花:协助实验;赖晓敏:协助实验;钟兴:提出研究思路和框架,协助实验,修改论文。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。

