腐植酸对漆酶诱导雌激素自聚合动力学的影响
高曦,陈美骅,孙凯*
(1.苏州中晟环境修复有限公司,江苏 苏州 215104;2.农田生态保育与污染防控安徽省重点实验室,安徽农业大学资源与环境学院,合肥 230036)
近30 年来,随着我国工业化和城镇化进程的快速发展,环境雌激素污染问题日益凸显[1]。环境中的17β-雌二醇(E2)、17α-炔雌醇(EE2)和双酚A(BPA)等雌激素主要通过城市污水排放、畜禽养殖废水释放和地表径流等途径进入水生态系统[2-3]。目前,在世界各地的水土介质中已频繁检测到雌激素[4]。雌激素在环境中具有分布广、浓度低、毒性高和多态性等特征,它们可破坏有机体的生殖基因和激素平衡,从而造成生物体内分泌失调、生殖障碍、神经系统紊乱等危害[5]。例如,低剂量(nmol•L-1)的环境雌激素长期暴露即可导致雄鱼的雌性化[6]。雌激素通过皮肤接触、饮食摄取等路径被人体吸收和积累后,会对人体的生殖、免疫和神经系统等产生一系列的干扰和毒害作用[7]。因此,环境雌激素已严重威胁到生态系统的稳定和人类的健康安全。
腐植酸(HA)普遍存在于天然水生态环境中,其浓度范围一般为10~30 mg•L-1,占水中总有机物的50%~90%[8]。已有研究证实,HA 是一种含有大量酚羟基、羧基、氨基和芳香基等功能团的超分子聚合物[9]。该聚合物能够显著影响雌激素的生物毒性、迁移转化、生物地球化学循环和归趋等环境行为[10-11]。例如,Bedard 等[12]研究指出,HA 可以与E2 的芳香环相互作用,从而降低母体化合物的雌激素活性。明确HA与雌激素的相互作用已成为环境污染控制与修复的关键科学问题之一。物理化学吸附、高级氧化、微生物降解、植物吸收等常规水处理技术已广泛应用于规避雌激素污染,但这些技术无法有效去除痕量浓度的雌激素,且存在处理费用高、降解周期长等缺陷[13-17]。与之相比,真菌漆酶具有催化效率高、操作条件温和、能量损耗低、绿色环保等优点[18-19]。漆酶属于一类蓝色的胞外含铜多酚氧化还原酶,该绿色生物催化剂可用于处理多种有机污染物[20]。漆酶以水中溶解氧作为最终电子受体,催化酚类污染物的单电子氧化,生成复杂多样的聚合物[21-22]。尽管如此,国内外关于HA 对漆酶诱导雌激素转化动力学、产物分布和作用机制影响的研究仍几近空白。
本文选择氧化还原电位较高的变色栓菌(Tram⁃etes versicolor)漆酶作为供试生物酶,采用批量平衡试验方法研究HA 对漆酶诱导E2、EE2 和BPA 3 种雌激素转化动力学的影响,利用高分辨质谱(HRMS)筛选方法识别酶促反应中雌激素的自聚物,并定性分析自聚物随时间变化的分布特征,综合地揭示HA 影响漆酶诱导雌激素自由基聚合的作用机制。研究结果不仅有望利用酶促聚合反应规避雌激素污染风险,而且也可以增加环境中有机碳含量。
1 材料与方法
1.1 化学试剂
漆 酶(来 源于Trametes versicolor,≥0.5 U·mg-1,CAS:80498-15-3)、E2(C18H24O2,CAS:50-28-2)、EE2(C20H24O2,CAS:57-63-6)、BPA(C15H16O2,CAS:80-05-7)、2,6-二甲氧基苯酚(2,6-DMP,C8H10O3,CAS:91-10-1)、HA(CAS:1415-93-6)均购自Sigma-Al⁃drich 化学公司;柠檬酸(C6H8O7,CAS:77-92-9)和磷酸氢二钠(Na2HPO4,CAS:7558-79-4)购自J.T.Baker化学公司;色谱纯甲醇(CH3OH,CAS:67-56-1)和乙腈(C2H3N,CAS:75-05-8)购自Fisher Scientific 公司。采用超纯水(18.2 MΩ•cm)配制10 mmol•L-1柠檬酸-磷酸盐缓冲溶液(C-PBS,pH 5.0),作为漆酶诱导雌激素转化的反应体系。
1.2 漆酶诱导雌激素转化动力学
采用批量平衡试验方法,研究HA 对漆酶诱导雌激素转化动力学的影响。酶促反应体系包含20 mL 10 mmol•L-1C-PBS(pH 5.0)、10 μmol•L-1雌激素、0 或20 mg•L-1HA[23]。添加1 U·mL-1漆酶,在25 ℃室温环境下启动反应。以雌激素和高温灭活的漆酶作为空白对照组。在预先选择的时间间隔内(5、10、15、30、45、60、90、120、150、180 min),用移液枪准确吸取0.5 mL 反应液,并立即加入等体积(0.5 mL)甲醇淬灭反应。将混合液过0.22 μm 纤维滤膜后,置于液相小瓶中4 ℃冰箱保存待测。通过高效液相色谱(HPLC)测定溶液中雌激素的残留浓度。所有试验均设置3 组平行。拟合假一级动力学模型,分别通过公式(1)和公式(2)计算雌激素转化动力学常数(k,h-1)和半衰期(t1/2,h):
式中:t表示反应时间,h;C0表示雌激素的初始浓度,μmol•L-1;Ct表 示 雌 激 素 在t时 刻 的 残 留 浓 度,μmol•L-1。
1.3 漆酶活性测定
采用紫外-可见分光光度计(UV-2550,Shimad⁃zu,日本)比色法,通过氧化1 mmol·L-12,6-DMP检测反应体系中漆酶的活性变化[14]。在比色皿中添加20 μL 含有漆酶的反应液、3.4 mL 含有1 mmol·L-12,6-DMP 的C-PBS(pH 3.8),充分混合均匀后,于468 nm处测定溶液吸光度变化。试验每隔30 s读数一次,测定5 min。漆酶活性单位定义为每分钟氧化1 mmol·L-1底物所需的酶量。所有试验均设置3 组平行。分别利用公式(3)和公式(4)计算漆酶活性(A,U·mL-1)和相对酶活(Er,%):
式中:r表示5 min 内吸光度随时间的变化速率,U;20为添加的含有漆酶反应液的体积,μL;A0表示漆酶的初始酶活,U·mL-1;At表示漆酶在t时刻的酶活,U·mL-1。
1.4 HPLC定量测定雌激素残留浓度
采用HPLC(Shimadzu LC 20TA)分析法,检测溶液中雌激素的残留浓度。HPLC色谱柱型为Agilent HCC18(4.6 mm×250 mm,5 μm 填料粒径,美国安捷伦科技有限公司);流动相为乙腈∶纯水=30%∶70%,流速1.0 mL•min-1,进样量20 μL,柱温40 ℃,检测波长278 nm,检测时间10 min。标准样品中3种雌激素的回收率范围为98.8%~103.2%(n=5)。
1.5 雌激素转化产物鉴定
利用高分辨质谱(HRMS)鉴定漆酶诱导雌激素的 转 化 产 物。在 含 有10 μmol•L-1雌 激素、0 或20 mg•L-1HA 的20 mL 10 mmol•L-1C-PBS(pH 5.0)中添加1 U·mL-1漆酶,25 ℃室温条件下启动酶促反应。反应1 h 后向体系中加入1 mol•L-1盐酸,将pH 调节至1.5(淬灭反应)。随后,加入20 mL 乙酸乙酯剧烈振荡,并用超声仪萃取30 min(每隔5 min 充分混匀溶液),该过程重复3 次,以充分提取有机相。采用分液漏斗分离上层乙酸乙酯萃取液,萃取液通过氮吹仪浓缩干燥后,甲醇定容至1 mL,置于4 ℃冰箱保存。设置添加高温灭活的漆酶处理组作为空白对照。HRMS 鉴定采用Triple TOFTM 5600+质谱仪(AB SCI⁃EX,美国)完成,在质荷比(m/z)为150~1 500 范围内扫描雌激素转化产物。该系统提供了质量误差小于5.0×10-6的高精度分辨能力。在流速为5 μL•min-1的条件下,采用电喷雾电离源(ESI:-3.5 kV),超纯度氮气(>99.999%)用于干燥或辅助气体,超纯度氦气(>99.999%)作为载气。离子传输毛细管温度设置为550 ℃并接地(0 V)。HRMS 分析后,运用Xcalibur 软件(V3.0,Thermo Scientific)推导雌激素转化产物的可能化学结构式。
1.6 雌激素聚合产物微观形貌
通过大规模试验方法,收集漆酶诱导雌激素聚合沉淀产物。酶促反应3 d后,添加1 mol•L-1盐酸,将溶液pH 调节至1.5并过夜静置12 h,使聚合物充分析出并沉淀。利用高速冷冻离心机,于9 000 r•min-1离心30 min。将聚合沉淀产物用超纯水冲洗3 次,去除残留的C-PBS 和漆酶。聚合沉淀产物经过冷冻干燥、研磨、过100 目筛后,利用扫描电子显微镜(SEM)表征聚合物的微观形貌特征。
2 结果与讨论
2.1 HA影响漆酶诱导雌激素转化动力学
HA 分子中含有大量的活性官能团,它们能够影响漆酶诱导雌激素的去除和转化。如图1 所示,酶促反应3 h 内,水体中E2 和EE2 的去除率分别高达99.9%和99.7%。漆酶催化E2 和EE2 转化符合假一级动力学方程(R2>0.95),它们的k值分别为2.48 h-1和2.03 h-1,t1/2值 分 别 为0.28 h 和0.34 h。添 加20 mg•L-1HA 有效抑制了E2 和EE2 的转化,其去除率分别降低至94.9%和79.6%,t1/2值分别延长至0.67 h 和1.09 h。在添加灭活的漆酶处理组中,E2 和EE2 的浓度没有发生显著性变化。Sun 等[23]研究指出,来源于云芝(Pleurotus Ostreatus)的漆酶(1 U·mL-1)在25 ℃、pH 5.8 条件下,3 h 内对E2 的去除率在99%以上,而添加HA则明显降低了E2的去除率。HA阻碍漆酶催化E2 和EE2 转化的原因可能有3 种:一是HA 可结合游离态的雌激素,因此降低了雌激素的表观浓度;二是HA 参与漆酶诱导雌激素的氧化,从而竞争漆酶的催化活性位点[23];三是漆酶催化雌激素-HA 发生自由基共聚合反应,所形成的产物干扰了漆酶的催化活性和稳定性[24-25]。本研究中无论是否添加HA,漆酶活性无显著性变化,证实HA 可能参与酶促反应并结合E2和EE2。
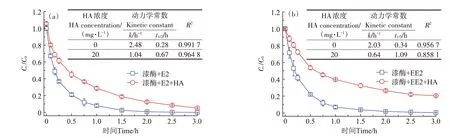
图1 HA对漆酶诱导E2和EE2转化动力学的影响Figure 1 Influence of HA on laccase-induced E2 and EE2 transformation kinetics
图2 展示了HA对漆酶诱导BPA转化动力学的影响。在未添加HA 处理组中,酶促反应3 h 后BPA 的去除率为96.5%,而添加HA 处理组中BPA 的去除率高达100%。通过拟合动力学模型计算出未添加HA和添加HA 处理组中BPA 的k值分别为1.45 h-1和3.13 h-1,t1/2值分别为0.48 h 和0.22 h,R2>0.93(图2a)。可见,HA 有效促进了漆酶诱导BPA 的氧化和去除,该结果与漆酶诱导E2 和EE2 转化的结果(图1)截然相反。分析原因主要是由于漆酶诱导BPA 转化的过程中酶催化活性逐渐降低,而添加HA 可以维持漆酶的催化活性和稳定性,从而确保BPA的持续氧化和高效去除(图2b)。Li 等[3]的报道表明,漆酶催化氧化BPA生成长链BPA自聚物,这些长链聚合物能够诱捕和封存漆酶分子,从而限制漆酶与底物的接触。添加HA 可以快速结合长链BPA 自聚物、消除高分子自聚物对漆酶的抑制作用,实现BPA的高效转化和去除[26]。
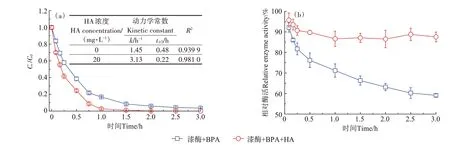
图2 HA对漆酶诱导BPA转化动力学的影响Figure 2 Influence of HA on laccase-induced BPA transformation kinetics
2.2 漆酶诱导雌激素转化产物
采用HRMS 结合Xcalibur 软件的分析方法,推导漆酶诱导雌激素的转化中间产物。由表1 可知,E2、EE2和BPA的主要酶促转化产物均为二聚体、三聚体和四聚体等低聚物。这些高分子聚合物的质量误差均小于5.0×10-6,表明HRMS具有较高的精确度,可用于筛选漆酶诱导雌激素形成的大分子转化产物。例如,通过HRMS 测定的3 种E2 转化产物的m/z分别为541.332 0、811.493 3和1 081.656 6,随后运用Xcalibur软件的分析方法,推测这些产物的化学式分别为C36H46O4、C54H68O6和C72H90O8,它们可能是E2 的二聚体、三聚体和四聚体(质量误差<1.0×10-6)。先前的研究结果也证实,漆酶能够催化雌激素氧化生成结构复杂的大分子聚合物[27-28]。这些产物是由雌激素单体通过自由基脱除2 个氢原子形成的C—C 或C—O—C共价聚合物。本研究并未检测到雌激素高聚物,可能是因为它们分子量较大,无法溶于提取剂[29]。此外,由于空间位阻效应,高分子底物难以进入漆酶催化中心[20]。所有聚合产物也在添加HA 处理组中被检测到。基于上述分析结果,可通过公式(5)计算雌激素及其自聚物的m/z:
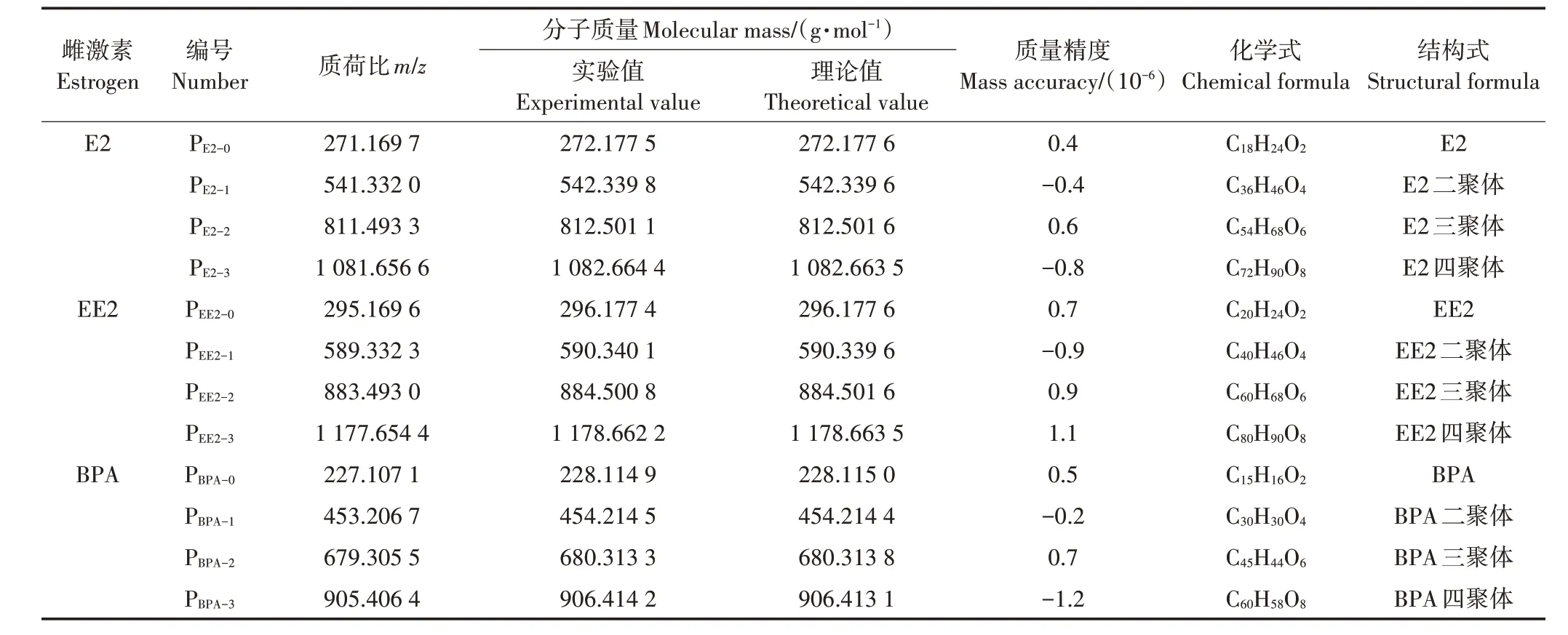
表1 漆酶诱导水溶液中E2、EE2和BPA的转化产物Table 1 Transformation products of E2,EE2,and BPA measured by HRMS
式中:m雌表示雌激素分子质量,g·mol-1;1.007 8 表示1个氢原子质量,u;n表示雌激素单体数量(n=1,2,3,4等),个。
通过大规模试验方法,酶促反应3 d 后收集雌激素聚合沉淀物。如图3 所示,漆酶诱导E2、EE2 和BPA 自聚合形成的沉淀产物均为球状结构,其中E2自聚物的分子尺寸较大。因此,可以采用高速离心或膜过滤的方法去除大分子雌激素自聚物。这些聚合物具有高度疏水性,它们在酶促聚合反应中可以被挤压浓缩成沉淀颗粒物[30]。这些结果进一步证实,漆酶能够诱导雌激素的单电子氧化和聚合,生成结构复杂的大分子C—C或C—O—C共价聚合沉淀产物。

图3 E2、EE2和BPA自聚物的微观形貌Figure 3 Morphological characteristics of E2,EE2,and BPA self-polymerization products observed by scanning electron microscope
2.3 HA对雌激素自聚合产物分布的影响
由于缺乏标准参考样品,本研究采用相对丰度值,探索HA 对雌激素自聚物时间分布的影响。HA对E2 二聚体、三聚体和四聚体产量相对丰度的影响如图4 所示。在添加HA 条件下,E2 单体的酶促聚合反应速率低于缺乏HA体系(图4a),该结果与图1a类似,进一步证实HA能够抑制漆酶诱导E2的氧化和聚合。E2 二聚体和三聚体的产量在聚合反应前期逐渐增加,随后呈现下降趋势,且添加HA 处理组中E2 二聚体和三聚体的产量下降较明显(图4b 和图4c),主要是由于E2 二聚体仍具有酚羟基官能团,它们可继续作为酶促反应底物被转化为E2三聚体、四聚体、低聚物和高聚物。E2 四聚体的产量变化如图4d 所示,在缺乏HA 的反应体系中,3 h 内E2 四聚体的产量呈现缓慢上升的趋势,而存在HA时E2四聚体的产量先增加后迅速下降。同理,图5 和图6 分别展示了HA对漆酶诱导聚合反应中EE2 自聚物和BPA 自聚物相对丰度的影响,结果类似于E2 自聚物的产量变化。Qin 等[29]报道指出,Fe3+饱和的蒙脱土能够催化E2 生成低聚物,其生物有效性和流动性显著低于E2,所形成的低聚物的产量在2 h内迅速增加,之后缓慢下降。可见,添加HA 有效降低了漆酶诱导雌激素自聚物的产量,这可能是因为HA 与雌激素及其自聚物发生共聚合反应,形成雌激素-HA共聚合产物。
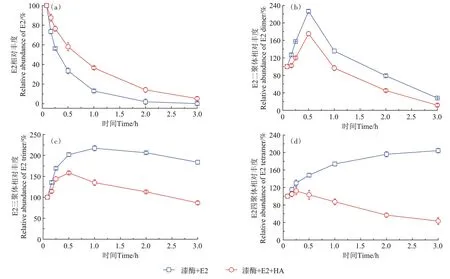
图4 漆酶诱导聚合反应中E2低聚物的形成动力学Figure 4 Formation kinetics of E2 self-oligomers in the absence and presence of HA during laccase-induced polymerization
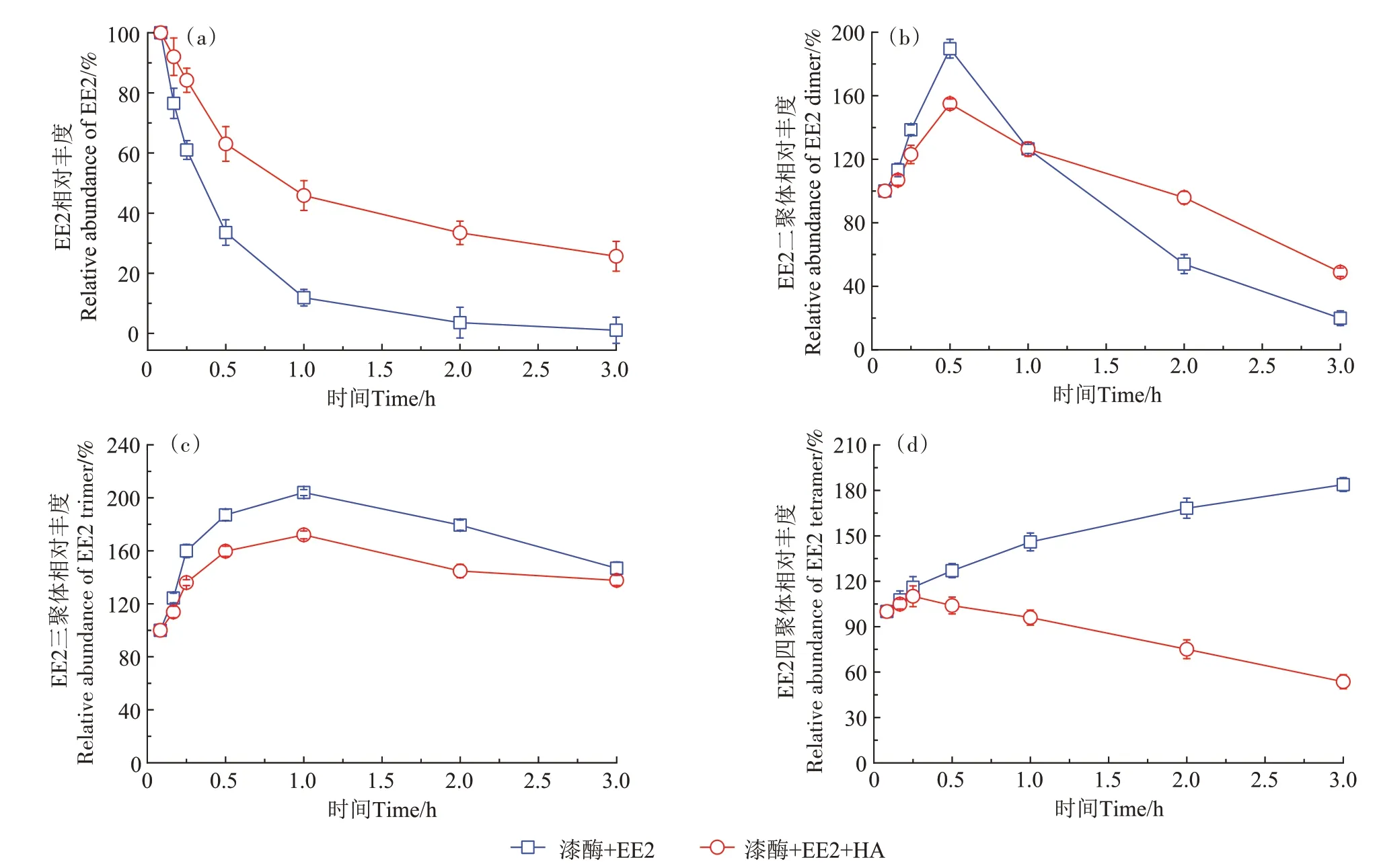
图5 漆酶诱导聚合反应中EE2低聚物的形成动力学Figure 5 Formation kinetics of EE2 self-oligomers in the absence and presence of HA during laccase-induced polymerization
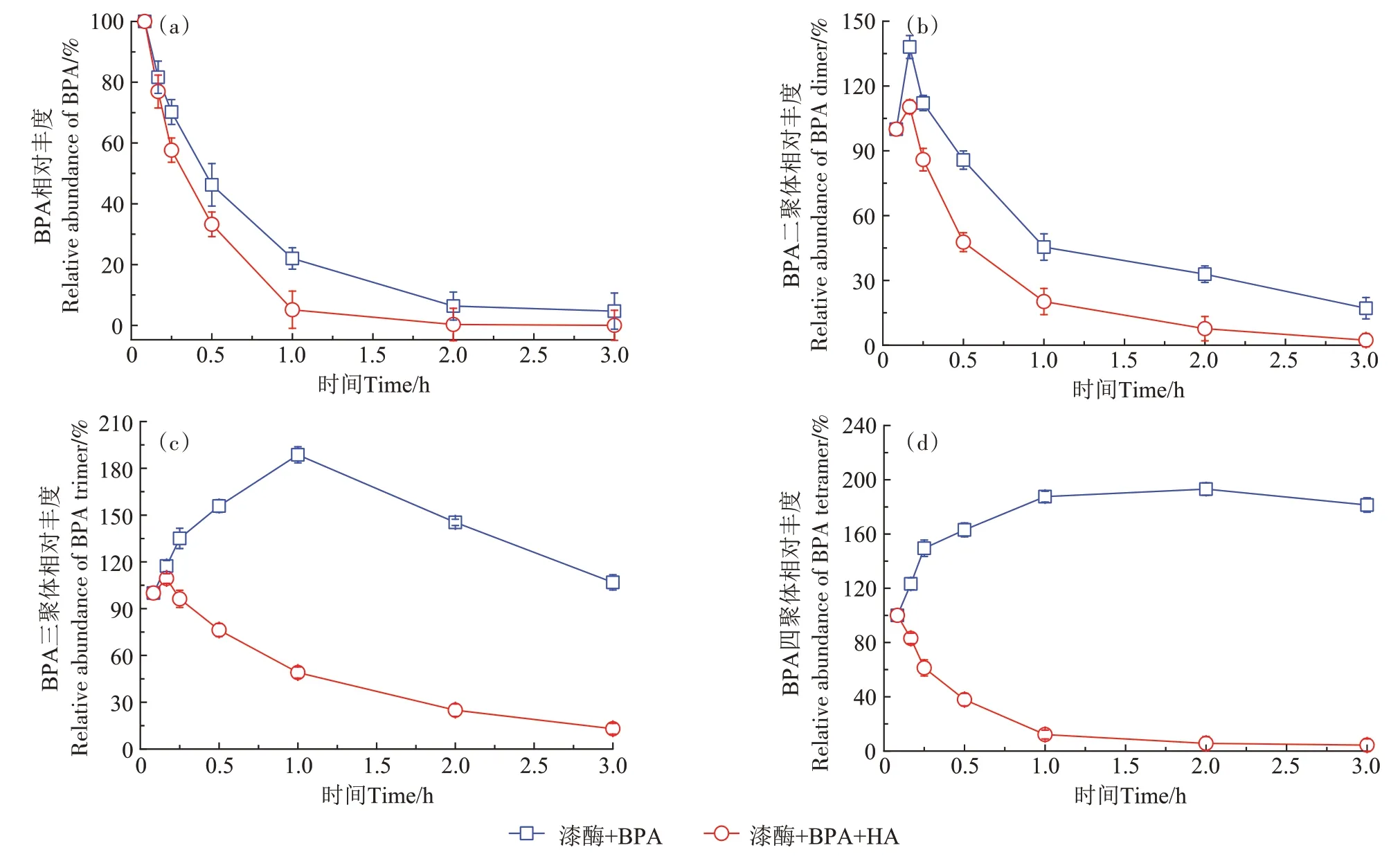
图6 漆酶诱导聚合反应中BPA低聚物的形成动力学Figure 6 Formation kinetics of BPA self-oligomers in the absence and presence of HA during laccase-induced polymerization
2.4 漆酶诱导雌激素-HA共聚合的作用机制
漆酶催化雌激素-HA 聚合反应的作用机理如图7所示(以E2作为代表性雌激素)。首先,漆酶能够诱导雌激素和HA 发生单电子氧化,形成不稳定的活性自由基中间体,与此同时将1 个分子氧还原成2 个分子水[20]。随后,这些不稳定的活性中间体在酶促反应位点之外通过C—C、C—O—C 或C—N—C 键共价结合,生成大分子的雌激素二聚体或HA 二聚体[31]。由于二聚体仍保留着酚羟基官能团,它们可继续作为漆酶的催化底物,被进一步氧化聚合成三聚体、四聚体、低聚物和高聚物等[29]。此外,雌激素也会与HA 发生共聚合反应,产生化学结构复杂多样的雌激素-HA共聚合产物[32-33]。雌激素聚合物的形成不仅有效降低了母体化合物的生物毒性,也增加了环境中有机碳的储备[18,21,26]。
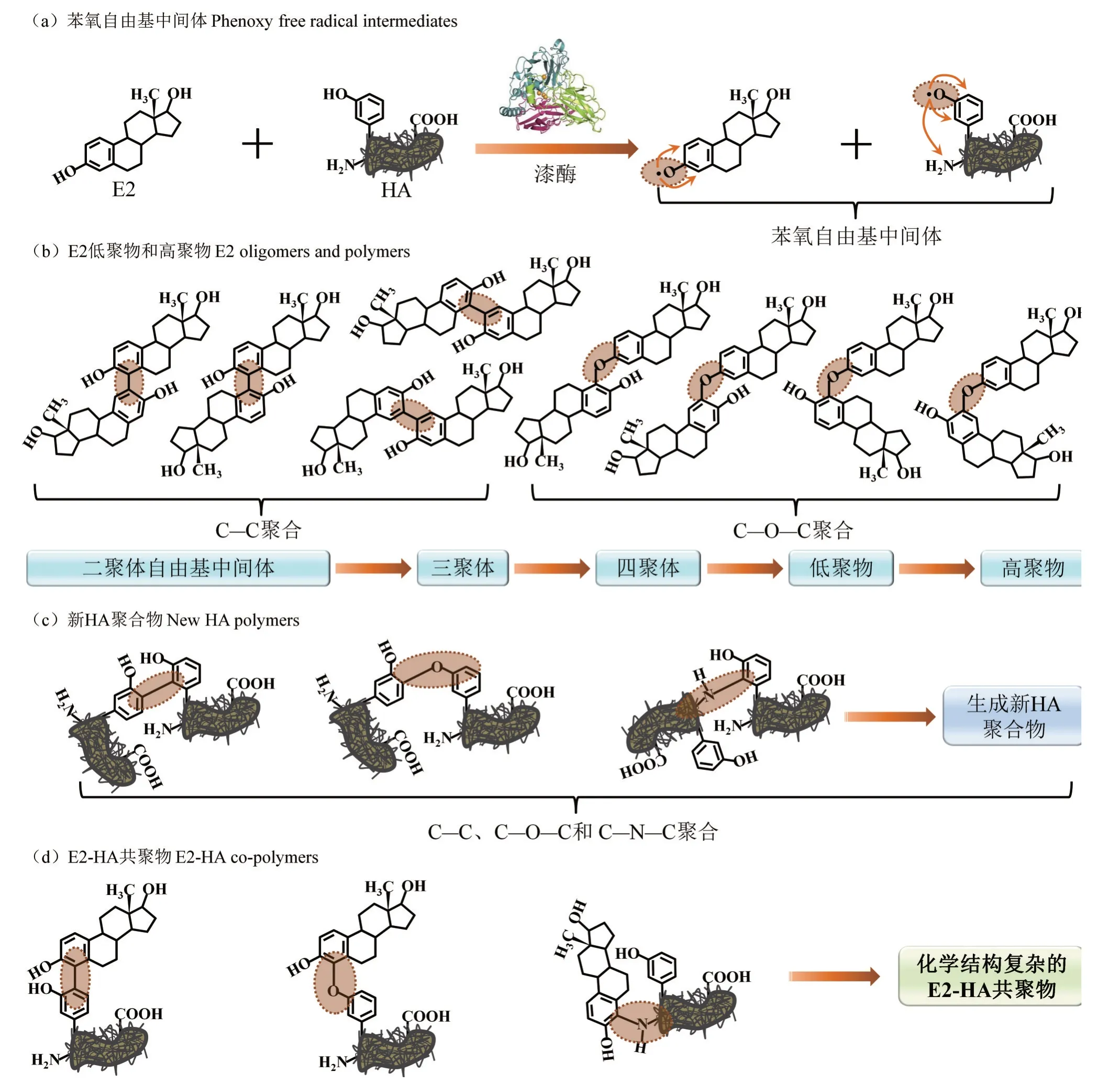
图7 漆酶诱导E2-HA共聚合的作用机制Figure 7 Laccase-started the co-polymerization mechanisms of E2 and HA
3 结论
(1)变色栓菌漆酶能够高效氧化和去除雌激素,添加HA抑制了17β-雌二醇(E2)和17α-炔雌醇(EE2)的转化,但促进了双酚A(BPA)的去除。
(2)漆酶诱导雌激素单电子氧化形成二聚体、三聚体和四聚体等低聚物,腐植酸(HA)能够与长链BPA自聚物快速发生共聚合反应,从而维持漆酶催化活性和稳定性。
(3)雌激素自聚物的产量随着酶促反应时间的增加呈现先升高后降低的趋势,添加HA 有效降低了雌激素自聚物的产量。
(4)漆酶诱导雌激素-HA 发生共聚合反应,生成结构复杂的C—C、C—O—C 或C—N—C 共价结合产物;所形成的聚合产物显著降低了母体化合物的生物毒性。

