滇黄精炭疽病病原分离鉴定及10 种植物源化合物的抑菌效果评价
窦 敏, 夏 燕, 邹越纪, 鲁茸格丁, 李迎宾,2,王海宁, 朱书生, 张治萍*,,3
(1.云南农业大学 农业生物多样性与病虫害控制教育部重点实验室,昆明 650201;2.云南农业大学 植物保护学院 农药系,昆明 650201;3.云南农业大学 园林园艺学院 园艺系,昆明 650201)
0 引言
黄精为百合科、黄精属药用植物,主要分布在中国、朝鲜、蒙古等地,适宜生长在土质疏松、肥沃的地区[1]。黄精的种类繁多,目前记载的有 70 多种,其中滇黄精Polygonatum kingianumColl.et Hemsl.是《中华人民共和国药典》中记载的3 个中药黄精基源植物 (滇黄精P.kingianum、黄精P.sibiricumRed.和多花黄精P.cyrtonemaHua.) 之一,具有较高的药用价值[1-3]。近年来,随着云南省林下中药材产业的蓬勃发展,对滇黄精种苗的需求量不断增加,然而,炭疽病已成为限制其种苗安全生产的重要因素之一[4]。炭疽菌种类复杂多样,已报道的就有 600 多种[5],如胶孢炭疽菌Colletotrichum gloeosporioides、尖胞炭疽菌C.acutatum、博宁炭疽菌C.boninense等[6-7]。此外,炭疽菌寄主广泛,可侵染危害多种谷物、蔬菜、花卉、中药材、果树及林木等[8-10]。
炭疽菌作为庞大的复合种,分类鉴定相对复杂,目前通常采用形态学、多基因系统发育分析及与致病性测定相结合的方法进行鉴定。形态学主要通过菌落形态和生长速率、分生孢子形态和大小、附着胞形态和大小等特征进行鉴定。由于炭疽菌种群复杂,且菌株在不同培养条件下形态学特征变化较大,因此,还需进一步结合多基因系统发育分析的方法对菌株进行鉴定,其系统发育分析常基于ITS(internal transcribed spacer)、ACT(actin)、CAL(calmodulin)、CHS-1(chitin synthase-1)、GAPDH(glyceraldehyde-3-phosphate dehydrogenase) 和TUB2(β-tubulin 2) 等基因序列进行[11]。
2019 至2022 年,本研究团队通过对云南省昆明市寻甸县滇黄精育苗基地的调查发现,其炭疽病发病率超过了 50%,严重区域甚至高达 90%~100%,严重制约了当地滇黄精种苗的培育。目前,针对炭疽菌常采用化学、物理、生物等防控手段,其中化学防治是最有效的方法之一。然而,化学药剂的过量投入,不仅易造成环境污染,还可能使病原菌产生抗药性,影响药剂施用效果[12]。近年来,随着人们对植物源化合物生物活性、使用方法和作用机理的深入探究,发现一些天然的植物源化合物可替代化学药剂用于防控植物病害。例如,萜烯类化合物(R)-樟脑、(R)-香芹酮、(S)-柠檬烯等对镰刀菌、黑曲霉有较好的抑制活性[13],香芹酚能有效抑制番木瓜炭疽病菌[14]等,但尚未见关于植物源化合物在黄精炭疽病防治方面的研究报道。因此,筛选对滇黄精炭疽病病原菌具有活性的植物源化合物至关重要。
基于此,本研究首先对引起滇黄精种苗炭疽病的病原菌进行了分离与鉴定,并进一步采用平板熏蒸法或带药平板法,筛选对该病原菌具有抑制活性的植物源化合物,以期为滇黄精的有机种植及其病害绿色防控提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 样品采集 从 2019—2022 年,于云南省昆明市寻甸县滇黄精育苗基地采集疑似感染炭疽病的滇黄精种苗样品12 份。
1.1.2 供试植物源化合物 见表1。纯度 ≥ 95%,均购自上海源叶生物科技有限公司。

表1 供试植物源化合物Table 1 Plant-derived compounds used in this study
1.1.3 培养基 马铃薯葡萄糖琼脂 (PDA) 培养基:马铃薯 200 g,琼脂 15 g,葡萄糖 20 g,用蒸馏水定容至 1 L[15],121 ℃ 灭菌 20 min,备用。
1.1.4 其他供试材料 Biomed Fungi Genomic DNA Extraction Kit 试剂盒,北京博迈德基因技术有限公司;2 × Power Taq PCR masterMix,北京擎科生物科技有限公司;引物 (表2) 合成,北京擎科生物科技有限公司。

表2 滇黄精炭疽病病原菌鉴定所用引物序列Table 2 Primers for identification of pathogens causing anthracnose of Polygonatum kingianum
1.2 试验方法
1.2.1 病原物分离纯化 采用组织分离法[16]进行病原菌分离:用无菌手术刀将病健交界处切成0.5 cm × 0.5 cm 的小块,经75% 的酒精消毒1 min,灭菌水清洗 2~3 次,充分晾干;将上述准备好的植物组织接种于 PDA 培养基上,于27 ℃培养 3~5 d,待长出菌落后进行菌株的分离纯化。进一步采用单孢分离法[3]纯化分离物,于4 ℃ 冰箱保存,备用。
1.2.2 病原物形态学观察 将分离物置于 PDA 培养基中,恒温 27 ℃ 培养 7 d,观察菌落形态和颜色等形态特征;随后在培养基中加入适量灭菌水洗脱菌丝体和孢子,经3 层纱布过滤后,通过光学显微镜观察并拍照记录分生孢子和附着胞的形态特征及大小[15-16]。其中,分生孢子观察 100 个,附着胞观察 50 个,测量记录并统计其长和宽。
1.2.3 DNA 提取及分子鉴定 刮取在PDA 培养基上培养 7 d 的菌丝,采用Biomed Fungi Genomic DNA Extraction Kit 试剂盒提取真菌基因组 DNA,利用ITS、ACT、CAL、CHS-1、GAPDH及TUB2基因的引物 (表2) 进行 PCR 扩增。PCR 体系为25 μL:模板 DNA 4 μL (150 ng/mL),2 × Power Taq PCR masterMix 12.5 μL,上、下引物各 1 μL(10 μmol/L),以灭菌 ddH2O 补足 25 μL。以ddH2O 替代模板 DNA 作为阴性对照。PCR 扩增反应程序为:98 ℃预变性 2 min;98 ℃ 变性10 s,退火温度和 72 ℃ 延伸时间见表2,35 次循环;最后于 72 ℃ 延伸 2 min;4 ℃ 保存。所得PCR 原液送至北京擎科生物科技股份有限公司进行测序,将测得的序列在 NCBI (http://www.ncbi.nlm.nih.gov) 中进行BLAST 序列比对,下载相似性高的序列及其相应的模式菌株序列 (表3),按照ITS-ACT-CAL-CHS-1-GAPDH-TUB的顺序进行串联,借助 MEGA 11 软件,采用邻接法 (Neighbor Joining) 构建系统发育树,自展次数 (bootstrap) 1000。
1.2.4 柯赫氏法则验证 选择 2 株代表性菌株进行致病性测定,每个菌株分别接种 3 株健康的一年生滇黄精种苗。具体步骤为:将分离物在PDA 平板上培养 7 d 后,用直径 6 mm 的灭菌打孔器于菌落边缘生长旺盛区域打取菌饼,待用;创伤黄精种苗叶片后接种菌饼,使菌丝与伤口完全贴合,以接种无菌 PDA 培养基的叶片作为空白对照;置于27 ℃ 培养间保湿培养,10 d 后观察记录发病情况,确定是否与田间病害症状一致。从发病部位再分离病原菌,采用 1.2.2 节和 1.2.3 节方法鉴定分离物的菌落及孢子形态等特征,并与接种菌株进行比较[15-16]。
1.2.5 抑菌活性测定 将病原菌接种于 PDA 培养基中,恒温 27 ℃ 培养 5 d 后,于菌落边缘生长旺盛区域打取直径 6 mm 的菌饼,待用。将粉末状植物源化合物 (大黄素甲醚、小檗碱、黄藤素及蛇床子素) 分别采用相应溶剂 (表1) 溶解,配制成1 ×107μg/L 的母液,采用孔径 0.22 μm 的无菌滤膜将母液与液体植物源化合物分别过滤除菌后备用。
平板熏蒸法:将菌丝块接种于 PDA 培养基平板中央;取直径 1 cm 的无菌盖子,置于 PDA 培养皿盖中央,使其与菌丝块处于同一垂直线上,倒置平板;在所放置的 1 cm 无菌盖子里滴加不同体积的植物源化合物母液,使浓度达到计算设定值,每个浓度处理重复 3 次。4-松油醇供试终浓度为0、25、50、70、100 和 150 μL/L;D-(+)-樟脑为0、20、40、60、80 和 100 μL/L;α-松油醇为0、25、50、70、100 和 150 μL/L;香芹酚为0、50、70、100、120 和 150 μL/L;其余液体植物源化合物供试终浓度为0、25、50、100、150和 200 μL/L。
带药平板法:分别取不同体积的植物源化合物母液与15 mL 已灭菌的 PDA 培养基混匀,制成不同浓度的带药培养基,以加入相应溶剂的 PDA平板作为对照;待平板冷凝后,将菌丝块接种于带药平板中央,倒置平板,每浓度处理重复 3 次。粉末状植物源化合物供试终浓度 (质量浓度) 为0、25、50、100、150 和200 μg/L。
操作完成后,迅速用封口膜进行封闭处理,恒温 27 ℃ 培养 5 d 后,采用十字交叉法测量菌落直径,按公式 (1) 计算菌丝生长抑制率。以各组植物源化合物浓度对数为x轴、菌丝生长抑制率为y轴, 求出毒力回归曲线方程、相关系数r和半数有效抑制浓度 (EC50)[17]。
式中:I为菌丝生长抑制率,%;Dt表示处理组菌落直径,mm;D0表示对照组菌落直径,mm。
1.3 数据处理
采用 Excel 2019 和 SPSS 26.0 计算软件进行数据分析;通过单因素方差、Duncan 氏法和独立样本t检验进行数据差异性比较,P< 0.05 则表示具有显著性差异。
2 结果与分析
2.1 病害症状
病原物侵染初期,滇黄精种苗叶片表面出现椭圆形或梭形病斑;随着病情加重,黄褐色病斑逐渐扩大,并在最外层出现黄色晕圈,病斑呈近似轮纹状;发病严重的叶缘处,病斑呈近半圆形或不规则形状,或呈凹陷状,叶片变薄,叶缘处破损 (图1 A、B)。

图1 滇黄精上果生炭疽菌的发病情况及形态学特征Fig.1 Incidence and morphological characteristics of C. fructicola for P. kingianum
2.2 分离物形态学鉴定
针对采集到的 12 份病样进行病原菌的分离纯化,共获得 10 株疑似Colletotrichum菌株。将所得10 株菌株接种于PDA 培养基上培养 7 d 后,所有菌株均表现出相同的形态学特征:菌落正面呈灰绿色,边缘白色 (图1 C);菌落背面有灰褐色色素沉着,边缘为黄白色 (图1 D)。分生孢子为圆柱形,透明、无隔、壁光滑,两端钝圆至稍圆,大小为 (10.60~22.99) μm × (2.42~6.45) μm (平均值13.95 μm × 3.98 μm,n= 100) (图1 E);附着胞呈卵圆形、棕色至深棕色、顶端稍钝,大小为 (4.71~10.04) μm × (3.17~6.33) μm (平均值 7.31 μm ×5.07 μm,n= 50) (图1 F)。
2.3 病原菌多基因系统发育分析
提取 DNA 进行PCR 扩增,用 1% 的琼脂糖凝胶进行电泳,在 250~1000 bp 范围内均可看到单一、清晰、明亮的条带 (图2)。测序后经序列比对发现,10 个分离物的ACT、CAL、CHS-1、GAPDH、ITS及TUB2基因序列一致性均为100%。选择其中代表性的分离物 HJ-35 构建系统发育树,并将其扩增获得的 6 个基因序列上传至NCBI,基因序列的 GenBank 登录号依次为:LC494273.1 (ACT)、MF627920.1 (CAL)、LC494275.1 (CHS-1)、MT407955.1 (GAPDH)、MZ961711.1 (ITS) 和MZ852393.1 (TUB2)。在基于ITS-ACT-CAL-CHS-1-GAPDH-TUB多基因构建的NJ 系统发育树中 (图3),菌株 HJ-35 与C.fructicola的自展值 (bootstrap) 为 100,表明 HJ-35 与C.fructicola的亲缘关系最近,为同一种。

图2 PCR 扩增产物电泳图Fig.2 Electrophoresis of PCR amplification products
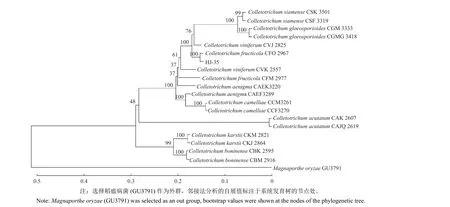
图3 基于ITS-ACT-CAL-CHS-1-GAPDH-TUB 多基因序列联合构建的系统发育进化树Fig.3 Phylogenetic tree inferred from combined partial ITS-ACT-CAL-CHS-1-GAPDH-TUB sequences
综合上述形态学和多基因序列分析,确定 HJ-35 菌株为果生炭疽菌C.fructicola。
2.4 分离物侵染能力
将单孢纯化的代表性菌株 (HJ-35 和HJ-29) 接种至健康的一年生滇黄精种苗,其致病性测定结果显示:接种叶片表现出与田间病害一致的症状,初期叶片正面出现黄褐色针尖大小的病斑,外围呈现黄褐色轮状晕圈;随后病斑逐渐扩大,外围由黄褐色变为深褐色;接种 10 d 后,病斑处叶片变薄,有的甚至出现穿孔,病斑长度为 0.9~1.2 cm (图1 G)。将发病叶片再次进行病原菌分离,所获得的菌株其形态学 (菌落形态、颜色,分生孢子及附着胞) 特征和分子生物学特征均与原接种菌株一致。
2.5 植物源化合物对果生炭疽菌的抑制活性
供试 10 种植物源化合物对果生炭疽菌的抑制活性测定结果显示:α-松油醇、4-松油醇及香芹酚的抑制活性较为显著,EC50值均低于 100 μL/L,其中α-松油醇的抑制效果最好(表4) ;而其余 7种供试植物源化合物的EC50值均大于 150 μL/L(数据未列出)。随着药剂浓度增加,α-松油醇、4-松油醇和香芹酚对果生炭疽菌菌丝生长的抑制效果均更加显著,在 150 μL/L 时,3 种药剂对果生炭疽菌菌丝生长的抑制率均高于 70%,其中 4-松油醇的抑制率超过 80% (图4)。

图4 不同浓度4-松油醇、α-松油醇及香芹酚对果生炭疽菌的抑制活性Fig.4 Inhibitory activities of different concentrations of 4-terpineol, α-terpineol, carvacrol against C. fructicola

表4 供试3 种植物源化合物对果生炭疽菌的抑制活性Table 4 Inhibitory activity of 3 plant-derived compounds on C. fructicola
3 结论与讨论
本研究首次明确了云南省昆明市寻甸县滇黄精种苗种植基地的滇黄精种苗炭疽病由果生炭疽菌C.fructicola引起。马云云等[3]通过ITS序列分析发现,炭疽菌属真菌对多年生滇黄精植株具有危害;但雨柔等[16]采用ITS-ACT-CHS-TUB多基因系统发育分析的方法,明确了多花黄精炭疽病由松针炭疽菌C.fioriniae和博宁炭疽菌C.boninense侵染引起。不同研究中分离得到不同种类的炭疽菌可能与寄主种类、寄主不同生长时期 (本研究为滇黄精种苗)、种植模式和种植区域有较大关系,不同的区域和种植模式不仅会影响植物的生长发育,还可能影响病原菌的生长和侵染能力。此外,由于炭疽菌种群庞大、种类多样,而本研究中采集的样本有限,因此在后续工作中可扩大样本采集地点和采集数量,进一步明确为害云南省寻甸县种植基地滇黄精的炭疽病菌种类,为黄精炭疽病的防控提供可靠依据。
炭疽菌作为世界十大危害严重的病原真菌之一[18],具有广泛的寄主侵染性。除侵染黄精外,中药材人参[6]、铁皮石斛[19]、云黄连[20]等亦可被炭疽病危害。炭疽病曾造成我国长白山地区林下参30% 的损失,造成日本和朝鲜林下参 50% 的损失,在俄罗斯远东地区的人参幼苗上发病曾达到100%[21]。此外,炭疽菌还可侵染水果、花卉、蔬菜等多种经济作物并给当地农业生产造成损失。例如,胶孢炭疽菌为害草莓,给草莓种植业带来严重经济损失[22];尖孢炭疽菌侵染枇杷,影响果实产量和质量[23];果生炭疽菌侵染柿子,影响果实品质[24];胶孢炭疽菌侵染玫瑰,引起植株枯萎死亡[25];平头炭疽菌C.truncatum侵染白菜种苗,导致白菜产量下降[26]等。这些研究进一步说明,炭疽菌具有广泛寄生性和严重危害性。目前通常采用化学药剂防治炭疽病[27],长期大量使用易造成环境污染、残留风险及耐药性等问题,而大部分植物源化合物是天然杀菌剂,可在一定程度解决上述问题,提高农产品食用安全保障[13]。因此,筛选安全有效的植物源化合物防控炭疽病具有重要现实意义。
近年来,科研工作者们不断发现和解析了多种植物源化合物的抑菌活性和机理:王江来等[17]发现香芹酚能有效抑制腐皮镰刀菌Fusarium solani的生长;于婧[14]发现香芹酚可以抑制番木瓜炭疽菌C.okinawense的生长;元维军等[28]发现0.8% 大黄素甲醚悬浮种衣剂对小麦纹枯病防治效果较好;周清等[29]的研究表明,大蒜素可抑制辣椒炭疽病菌C.capsici和辣椒疫病菌Phytophthora capsica菌丝的生长和孢子萌发;4-松油醇和α-松油醇可抑制念珠菌Candida strains的生长[30]等。然而,还鲜有植物源化合物防控果生炭疽菌的相关研究报道。本研究选择 9 种已获准登记使用的植物源化合物和黄藤素 (表1),采用平板熏蒸法或带药平板法进行了抑菌活性评价,结果较为直观。
本研究发现,α-松油醇、4-松油醇和香芹酚对果生炭疽菌的生长均具有较好的抑制作用,EC50值依次为 54.26、81.74 和94.78 μL/L,这不仅为滇黄精炭疽病的绿色防控提供了方向,同时还为拓宽植物源化合物的使用提供了理论依据。另外,本课题组在对云南省多个滇黄精种苗基地疑似炭疽病染病样品的病原菌分离鉴定中,也明确了其致病菌为果生炭疽菌,后期我们将进一步扩大采样范围,连续监测果生炭疽菌的动态流行;同时,针对黄精炭疽病害的绿色防控,将继续扩大植物源化合物的筛选范围,并结合田间试验对筛选获得的植物源化合物进行药效评估,以期为生产中滇黄精炭疽病的绿色防控提供技术指导。