裂殖壶藻SlMYB118基因的克隆及生物信息学分析
陈 菁,苏永昌,孙化淼,陈由强,薛 婷*,代容春*
(1.福建师范大学生命科学学院,福建 福州 350117;2.海洋生物医药与制品产业化开发技术公共服务平台,福建 福州 350117;3.福建省特色海洋生物资源可持续利用重点实验室,福建 福州 350117;4.福建省水产研究所,福建 厦门 361013)
DHA(Docosahexaenoic acid),即二十二碳六烯酸,是一种多不饱和脂肪酸,在人体内无法自行合成,具有促进大脑发育、保护视网膜、降低甘油三酯含量、改善血管功能和治疗心脑血管疾病等重要作用[1-3]。DHA的主要来源是深海鱼油和海洋微藻[4],其中鱼油是DHA的传统来源,但受鱼的品种、部位、季节、产地的影响而产生波动,DHA含量不稳定,此外鱼油生产工艺较为复杂,产品多具有腥味,且易受海洋污染物的影响[5-8];而可生成DHA的微藻能够弥补鱼油资源有限的缺陷,其培养具有不受季节、地域等条件的限制,培养周期短、产量高、不含有鱼腥味、脂肪酸组成和提取纯化工艺简单、不破坏生态环境的特点和优势,打破了传统鱼油应用的限制[9-10]。因此,利用海洋微藻生产DHA具有更加广阔的应用前景。
裂殖壶藻(SchizochytriumlimacinumSR21)是一种单细胞海洋真菌[11],同时又是一种富含DHA的海洋微藻。裂殖壶藻具有生长速度快、生物量高、发酵周期短且安全、易于提纯等优势[12]。根据《中华人民共和国食品安全法》和《新资源食品管理办法》的规定,卫生部批准的新资源食品中包括DHA藻油,其中裂殖壶藻被列为DHA藻油的来源之一。鉴于其DHA藻油商业化应用的许可不存在行政障碍,且世界很多国家已有其藻油DHA商业生产的成功先例,商业化应用较为成熟,因此选择裂殖壶藻为天然DHA的合成工具,作为DHA规模化、商业化应用的理想藻株。
目前,裂殖壶藻的研究还停留在结合DHA合成途径菌株性能的改善、发酵过程的调节以及油脂的提取和纯化[13]。而近年来,植物转录因子的研究已成为热点之一,调控脂肪酸合成和油脂积累的转录因子更是备受青睐。转录因子并不单独作用,而是形成代谢调控网络,共同发挥调控脂肪酸合成的作用,这些转录因子分属各个家族,包括AP2家族、B3家族、DOF家族、MYB家族、HAP3/CBP和CHD3等[14]。研究报道,拟南芥MYB118基因是与种子发育时胚胎建成、脂肪酸从头合成和代谢及油脂积累相关的关键转录因子,过表达MYB118基因能够正调控一系列与脂肪酸合成、糖酵解途径相关的基因,从而调控种子中脂肪酸的生物合成和油脂的积累[15],但该基因在其他物种中有关脂肪酸生物合成的调控研究尚未见报道。为了挖掘裂殖壶藻DHA合成相关的转录因子,本课题组前期利用氮源胁迫下不同培养时期的细胞RNA-Seq数据,通过加权基因共表达网络分析(Weighted gene co-expression network analysis,WGCNA)方法构建网络,寻找到1个与DHA含量特异相关的模块,且该模块中的关键基因[包含SlMYB118基因(GenBank登录号:OQ784160.1)]与脂肪酸的合成相关,由此推断该模块中SlMYB118基因是潜在的裂殖壶藻 DHA合成调控的转录因子[16]。因此,本文对裂殖壶藻的SlMYB118基因进行研究,经PCR实验过程获取该基因的cDNA全长,并对SlMYB118基因进行蛋白质理化性质分析,预测蛋白质的亲/疏水性、保守结构域、结构预测以及系统进化等生物信息,为后续确定SlMYB118基因的结合位点在转录调控机制研究、DHA合成相关转录调控网络的建立奠定了理论基础。
1 材料与方法
1.1 实验材料
1.1.1 藻种
裂殖壶藻购买于美国马里兰洲洛克菲勒的美国模式培养物集存库(American type culture collection,ATCC)。
1.1.2 试剂
TransZol Up Plus RNA Kit、TransScript One-Step gDNA Removal and cDNA synthesis SuperMix反转录试剂盒、Trans5α Chemically Competent Cell、EasyPure©Plasmid MiniPrep Kit、X-gal(20 mg/mL)、IPTG(500 mmol/L)购自北京全式金生物技术有限公司;TIANgel Maxi Purification Kit购自天根生化科技(北京)有限公司;克隆载体pMD19-T、DNA Marker购自Takara公司;Gloria Nova HS2X Master Mix、琼脂粉购于ABclonal公司;蛋白胨、酵母粉、氨苄青霉素钠购自北京索莱宝科技有限公司;葡萄糖购自西陇科学股份有限公司。
1.1.3 培养基
采用YPD培养基培养裂殖壶藻,配方为1 L海水中加入5 g葡萄糖、1 g蛋白胨和1 g酵母粉,于115℃高压灭菌锅中灭菌20 min,pH为5。
1.1.4 设备
灭菌锅[施都凯仪器设备(上海)有限公司]、新型迷你型恒温培养振荡器(上海智城分析仪器制造有限公司)、全自动样品快速研磨仪(上海净信实业发展有限公司)、小型台式冷冻离心机(德国艾本德股份公司)、DYY-5型稳压稳流电泳仪(北京市六一仪器厂)、Mini PCR仪(美国Applied Biosystems)、凝胶成像仪(美国BIO-RAD公司)、电热恒温水槽(上海恒一科技有限公司)、电热恒温培养箱(福州科远贸易有限公司)。
1.2 实验方法
1.2.1 裂殖壶藻总RNA的提取
取2 mL、密度为5.58×107个/mL、处于对数生长期的藻液接种,加入装有100 mL YPD培养基的锥形瓶中,振荡培养箱的温度设置为28°C、转速设置为200 r/min。培养至对数生长期时,取50 mL裂殖壶藻,利用离心机8 000 r/min离心5 min。将藻泥装入1.5 mL离心管中,用液氮速冻,取出后加入TransZol Up试剂1 mL,然后加入直径为4 mm的钢珠,利用自动研磨仪进行研磨,参数设置为60 Hz、3 min。之后的步骤按照TransZol Up Plus RNA Kit的说明书进行提取,提取结束后,利用2.0%琼脂糖凝胶电泳验证该RNA的质量,以及利用NanoDrop-2000分光光度仪检测RNA的浓度。利用所提的RNA为模板,遵循反转录试剂盒的要求,合成cDNA的第一链,并保存于-20°C以备用。
1.2.2SlMYB118基因的扩增
利用SnapGene软件设计引物。依据本实验室建立的裂殖壶藻基因组数据库中的SlMYB118基因序列来设计一对引物:上游(F)、下游(R)(表1),下划线为EcoRⅠ、SalⅠ酶切位点,并且送到福州尚亚生物技术有限公司进行合成。
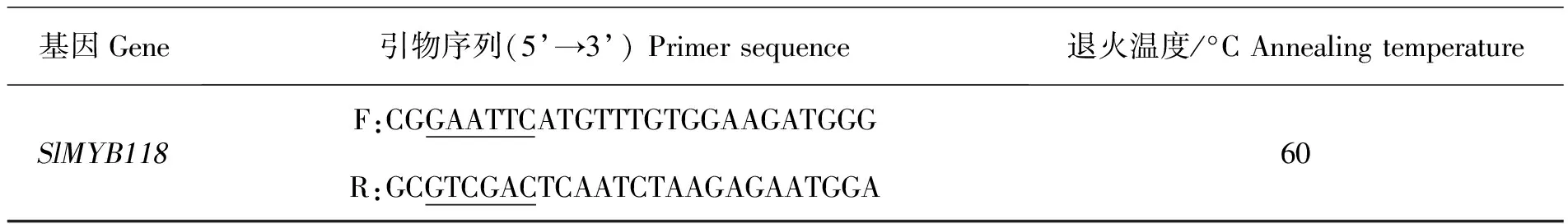
表1 SlMYB118基因引物序列
以cDNA为模板扩增SlMYB118基因,采用Gloria Nova HS2X Master Mix,以F和R为引物进行PCR扩增。PCR反应体系50 μL:cDNA模板2 μL,F、R引物各1 μL,Gloria Nova HS2X Master Mix 25 μL,ddH2O 21 μL。在PCR仪中,首先94°C预变性5 min;其次94°C变性30 s,60°C退火30 s,72°C延伸1 min,35个循环;再72°C终延伸7 min;最终4°C保存。利用1.0%琼脂糖凝胶电泳对PCR产物进行检测并分离,之后利用DNA凝胶回收试剂盒回收目的片段。
1.2.3 目的基因的克隆及测序
在16°C连接仪中,将回收的PCR产物与pMD19-T载体过夜连接,连接产物转化至Trans5α Chemically Competent Cell,并涂布于蓝白斑筛选平板培养基上,在37°C培养箱中倒置、过夜培养。挑单菌落进行培养,菌液进行抽提质粒验证并送至杭州擎科生物技术有限公司进行测序。
1.2.4 裂殖壶藻SlMYB118蛋白质的生物信息学分析
裂殖壶藻SlMYB118蛋白质的生物信息学内容如表2所示。
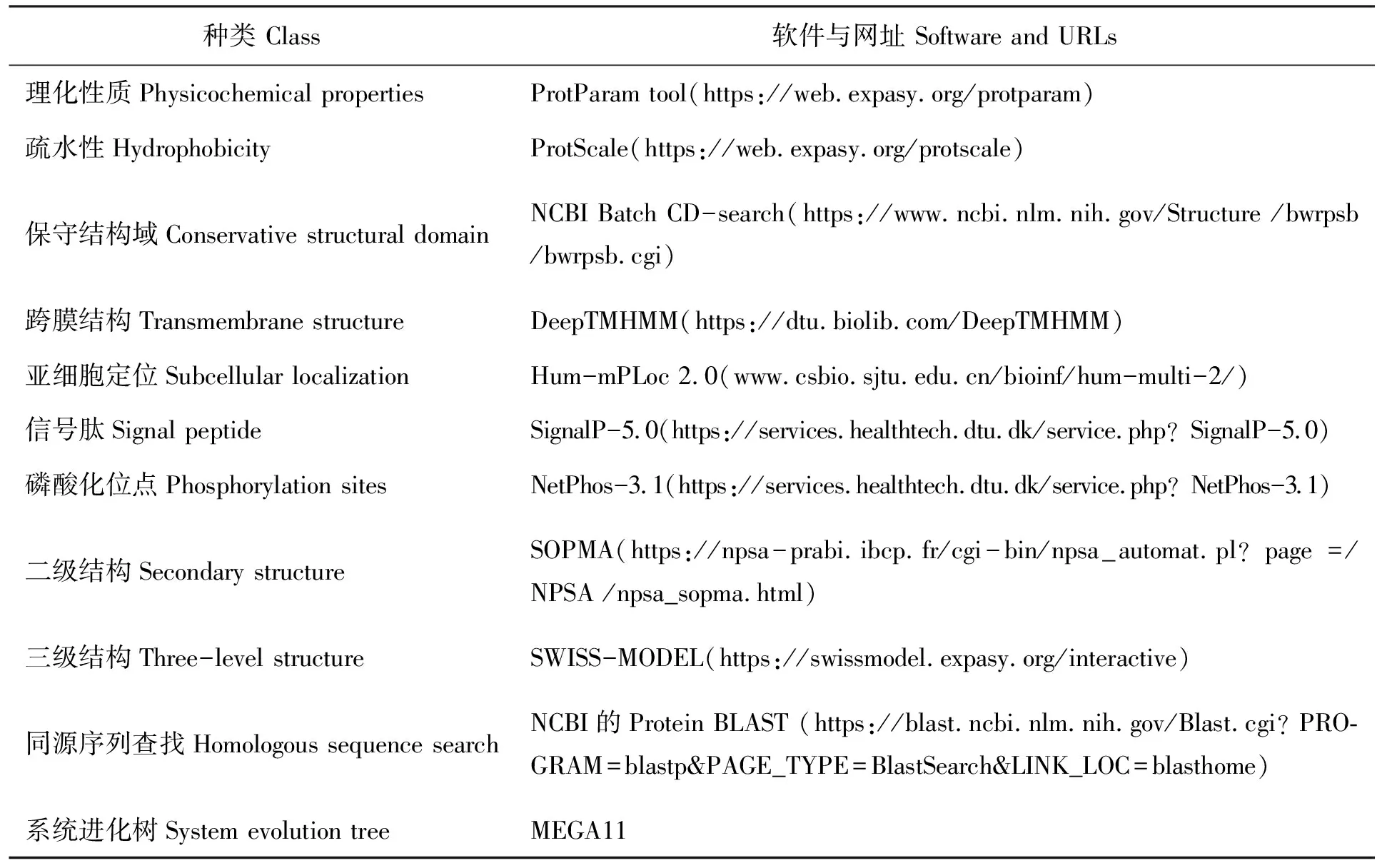
表2 蛋白质结构与功能预测的相关软件网站
2 结果与分析
2.1 裂殖壶藻总RNA的提取
图1是裂殖壶藻总RNA的凝胶电泳结果。从图1可以看出,有两条清晰的条带在凝胶上,条带分别是28 S和18 S。图像结果证实试验所提取的总 RNA 较完整。RNA经超微量紫外分光光度计检测,所提取的总RNA的浓度为220 ng/μL,OD260 /OD280 比值为1.81,表明所提取的总RNA符合反转录的实验要求。
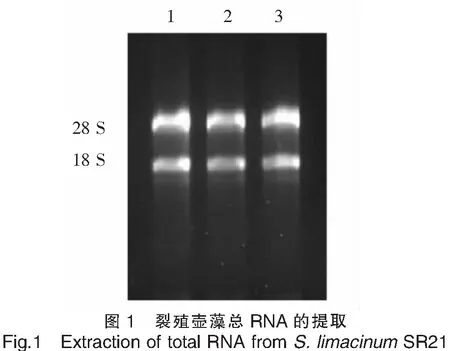
注:1、2、3为裂殖壶藻的总RNA。
2.2 以裂殖壶藻cDNA为模板的PCR扩增结果
以裂殖壶藻cDNA为模板进行PCR扩增,经琼脂糖凝胶电泳检测,与DL 2000 marker进行对比,可见扩增片段约为2 000 bp,与目的片段大小吻合(图2)。

注:M为DL 2000 marker;1为cDNA扩增。
2.3 pMD19-T克隆目的片段的检测结果
抽提质粒,电泳结果如图3所示。电泳图显示,重组质粒片段约为5 026 bp,目的片段的大小与预期的相一致,表明SlMYB118基因的cDNA成功连接在PMD19-T质粒上。将成功克隆的质粒进行测序,经SnapGene软件分析的测序结果与裂殖壶藻SlMYB118基因的cDNA序列比对一致(图4),表明重组质粒PMD-SlMYB118构建成功。

注:M为Supercoiled ladder;1为PMD-SlMYB118质粒。
2.4 裂殖壶藻SlMYB118基因的生物信息学分析
2.4.1 裂殖壶藻SlMYB118蛋白质的理化性质
经Bioedit软件分析,裂殖壶藻SlMYB118基因的cDNA序列全长为2 280 bp,其中G+C含量为53.11%,A+T含量为46.89%。使用ProtParam Tool分析,SlMYB118蛋白质分子量为84.81 kDa,分子式为C3601H5604N1194O1155S22,理论等电点(pI)为8.75。该蛋白质的不稳定指数为70.54(<40为稳定蛋白质),推测其为不稳定蛋白质。预测该蛋白质在大肠杆菌中表达的半衰期大于10 h,在酵母中表达的半衰期大于20 h,而在哺乳动物网状细胞中体外培养表达的半衰期为30 h。SlMYB118蛋白质由20种基本氨基酸组成,氨基酸残基较多的是谷氨酰胺(Gln,8.6%)、组氨酸(His,8.8%)和丝氨酸(Ser,12.9%),氨基酸残基较少是苯丙氨酸(Phe,1.7%)、酪氨酸(Tyr,1.4%)、色氨酸(Trp,1.1%)以及半胱氨酸(Cys,0.5%)。由表3可知,SlMYB118蛋白质带有负电荷的氨基酸72个(Asp+ Glu)、正电荷的氨基酸76个(Arg+ Lys)。


表3 SlMYB118蛋白质的氨基酸组成
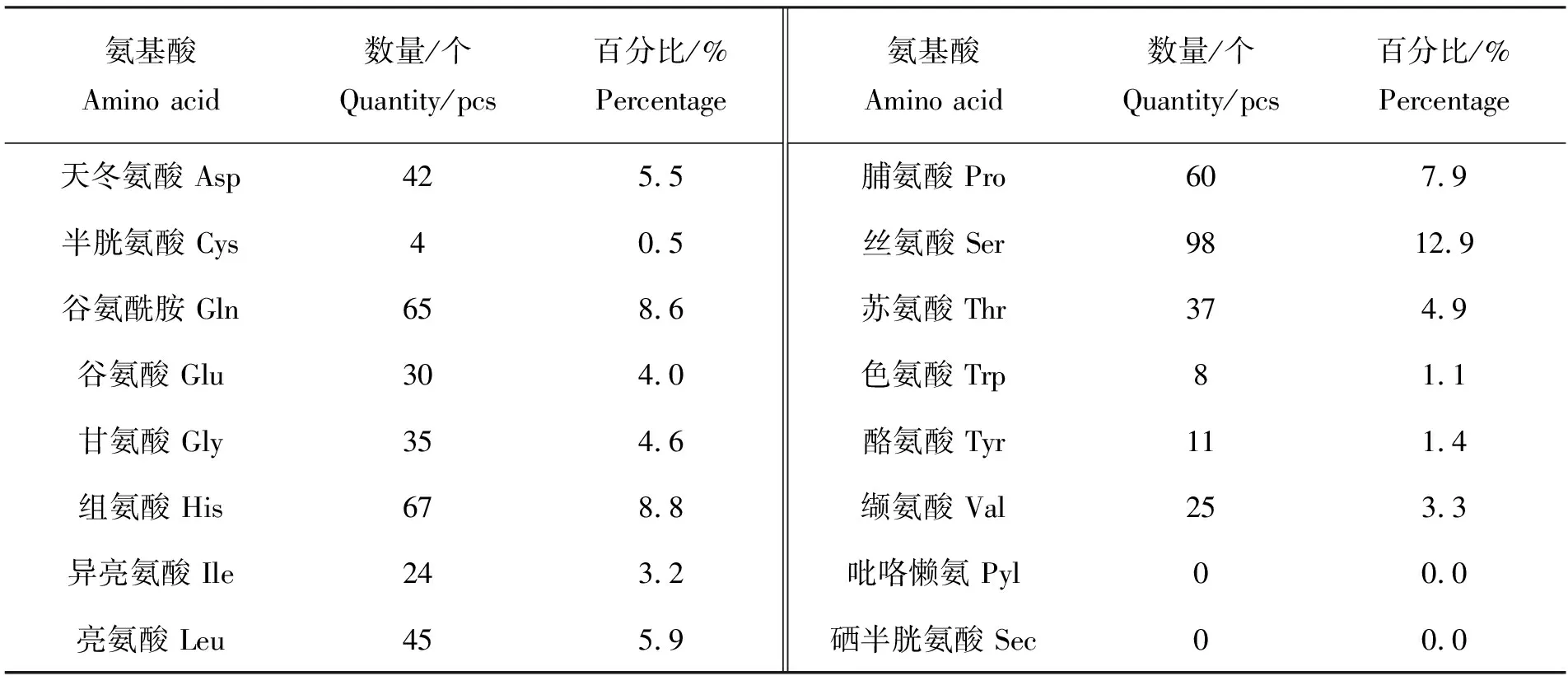
续表3
2.4.2 亲/疏水性分析
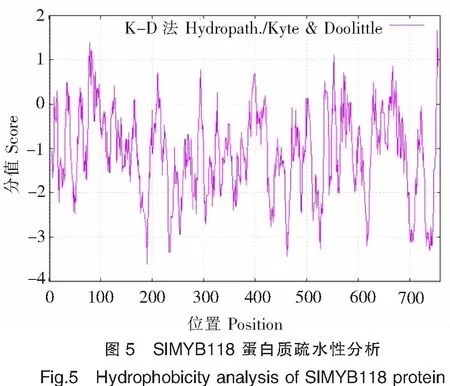
经ProtScale在线程序分析,亲/疏水性最大值为1.667(位于第754位氨基酸处),最小值为-3.622(位于第190位氨基酸处),总平均疏水性为-1.087,同时SlMYB118蛋白质含有较多的亲水域,说明SlMYB118蛋白质为亲水性蛋白质(图5),其脂肪系数为53.04。
2.4.3 结构预测
图6中,根据NCBI保守结构域数据库(CDD)的结果表明,该蛋白质具有Myb_DNA-binding结构域,同时该结构域同属于SANT超家族。SANT超家族是Myb超家族蛋白质,包括转录因子和mRNA剪接因子(转录/RNA加工修饰/细胞分裂和染色体分割),符合对该蛋白质的预期。DeepTMHMM预测SlMYB118蛋白质处于膜内,因此SlMYB118蛋白质不存在跨膜结构域;Hum-mPLoc 2.0预测该蛋白质定位于细胞核。经过SignalP5.0在线预测信号肽的可能性为0.001 2,显然小于阈值0.500 0,因此SlMYB118蛋白质不存在信号肽序列。SlMYB118蛋白质磷酸化位点由NetPhos3.1在线软件进行预测,结果如图7所示,当潜在磷酸化位点的阈值为0.5时,可能存在106个磷酸化位点在SlMYB118蛋白质中,其中包括3个酪氨酸(Tyr)位点、22个苏氨酸(Thr)位点及81个丝氨酸(Ser)位点。


2.4.4 二级和三级结构预测
图8中,SlMYB118蛋白质的二级结构由在线软件SOPMA进行预测。SlMYB118蛋白质二级结构包括α-螺旋、延伸链、β-转角、无规则卷曲。这些结构中所占比例最高的为无规则卷曲(56.92%),其次为α-螺旋(25.96%),所占比例最低的为β-转角(5.67%)。由此可知,SlMYB118蛋白质二级结构主要是由无规则卷曲和α-螺旋组成,隶属混合型蛋白质。图9为SlMYB118蛋白质三级结构的预测结果,其是通过SWISS-MODEL对SlMYB118蛋白质三级结构的同源建模。


2.4.5 系统进化树
将SlMYB118蛋白质序列提交至NCBI-Blastp进行比对,结果显示裂殖壶藻SlMYB118蛋白质序列与HondaeafermentalgianaMYB98蛋白质序列相似度最高,为80.57%;与H.fermentalgianaMYB44蛋白质序列的相似度次之(48.60%)。在MEGA11软件中,采取邻接法(Neighbor-joining algorithm)、bootstrap重复次数为1 000次(图10),将其中15种与裂殖壶藻相似度较高的MYB蛋白质序列与目的蛋白质构建系统发育进化树。结果显示裂殖壶藻SlMYB118蛋白质与H.fermentalgianaMYB98蛋白质聚为一支,亲缘关系最近。

3 讨论
MYB类转录因子家族是指含有MYB结构域的一类转录因子,是植物中较大转录因子的家族之一。MYB转录因子的共同特征是具有保守的MYB结构域由N端1-4个R基序组成,根据R基序重复的数目可以分为1R-MYB、R2R3-MYB、3R-MYB、4R-MYB等 4种类型[17]。裂殖壶藻SlMYB118蛋白质通过保守结构域分析,表明该蛋白质具有2个Myb_DNA-binding结构域,属于R2R3-MYB。在植物中,R2R3-MYB普遍数目较多,且发挥多种重要功能,包括形态建成、次级代谢调节和抗逆性等生理生化活动[18-24]。如拟南芥AtMYB37、AtMYB38和 AtMYB84能够调控其侧分生组织的形成[18];月季RhMYB113c基因通过MYB-bHLH或MYB-bHLH-WD40复合物调节花青素苷的合成,从而影响月季红色花瓣的着色[19];三七PnMYB1基因能够调控三七皂苷生物合成途径中基因的表达,促进三七皂苷的合成[20];Ye Z M等[21]的研究表明,CitMYB21基因负调控柑橘类类黄酮生物合成;在拟南芥中,过表达荷花的NnMYB4基因,使其AtC3H、At4CL1、AtF5H、AtCOMT1等木质素合成关键酶的表达量下调,从而负调控植物木质素的合成[22];在干旱胁迫条件下,白羊草中的BiMYB142、BiMYB143和BiMYB35基因通过调控其靶基因的表达,增强了白羊草抗旱的能力[23];在低温胁迫下,番茄SlMYB102基因对6种外源激素的积累具有积极作用,推测其可能参与了这6种激素对抗寒性的调控通路[24]。本课题组前期利用氮源胁迫下不同培养时期的细胞RNA-Seq数据,通过WGCNA分析,证实SlMYB118基因与脂肪酸的合成相关,由此推测SlMYB118基因是裂殖壶藻DHA合成调控的潜在转录因子。本研究通过蛋白序列比对,表明SlMYB118蛋白序列与H.fermentalgianaMYB98蛋白质序列最为相似;系统进化树显示H.fermentalgiana的MYB98、MYB44及MYB118蛋白质序列与裂殖壶藻的SlMYB118蛋白质序列聚为一支,可见2个物种之间的亲缘关系较近。裂殖壶藻与H.fermentalgiana均为破囊壶菌科,这与NCBI分类数据库一致。
转录因子在动、植物的生长发育及其对外界环境的反应中起着重要的调控作用,一直以来都是研究内容之一,现也是生物学研究领域的热点。多种微藻中调控DHA的机理已被研究[25-26],而裂殖壶藻调控DHA的机理目前仅局限于在不同供氧条件下的转录组和基因表达的分析[27]。大量研究推测,裂殖壶藻多不饱和脂肪酸的合成可能存在2种途径:一是以乙酰辅酶A为起点,经过一系列的碳链延长和脱饱和反应得到多不饱和脂肪酸(FAS途径);二是以乙酰辅酶A为起点,不经过一系列的碳链延长酶和脱饱和酶反应,而是形成多酮基与多羟基的化合物(PKS途径)[28]。随着测序技术的不断发展,已开展利用基因组、转录组来揭示参与DHA合成途径的关键功能基因(如延长酶、去饱和酶、聚酮合成酶等),目前利用过量表达脂肪酸合成途径中的单个关键酶/酶的亚基基因,或是通过同时过量表达代谢途径中的多个酶基因的方法来提高DHA含量,但这些方法在一定程度上都无法突破脂肪酸合成通量的限制[29-30]。DHA合成受多个层面的调控,不仅涉及到脂肪酸合成途径相关功能基因的表达,也与转录因子的导向作用密切相关,但参与DHA合成的关键转录因子还不清楚,且该信号通路激活的下游基因仍未知,及其参与调控裂殖壶藻DHA合成在国内、外也少有研究。因此,挖掘调控DHA合成的关键转录因子,并鉴定其下游靶基因,解析其参与DHA合成调控的分子机制是高产DHA裂殖壶藻藻种构建和选育亟需解决的关键科学问题。本研究为后续对裂殖壶藻SlMYB118基因的结构、功能及其对脂肪酸合成调控的研究提供了依据。

