循环水养殖模式对凡纳滨对虾养殖水质及生长性能的影响
牛江波,吴赵军,李亚松,康秋平,徐 波,郭 兵,蒋礼平,宋向果,梁勤朗*
(1. 通威渔业科技有限公司,四川 成都 610041;2.通威农业发展有限公司,四川 成都 610041)
凡纳滨对虾(Litopenaeusvannamei)隶属十足目、对虾科、滨对虾属,其全球产量约占对虾总产量的70%[1-2]。该品种于1988年被引入中国,因生长快、抗逆性强、出肉率高、市场需求旺盛等优势,现已成为我国重要的水产经济养殖品种[3-5]。它适应的盐度范围为1~40,生存适温为8~32℃,并常栖息于低于70 cm的水深环境中[6]。2021年我国凡纳滨对虾海水养殖总产量为127.36×104t,同比增长6.38%[7]。然而,随着集约化、高密度养殖的不断发展,病害和环境污染问题逐渐突出,绿色、健康发展养殖模式已成为社会关注的热点,传统工厂化养殖模式转型升级已刻不容缓[8-10]。
目前,循环水养殖模式作为新型绿色高效养殖的模式之一,具备节约水资源、单产高、环境友好等多重优势[11-13]。而近些年,养殖户依靠工厂化养鱼的经验,开始探索凡纳滨对虾工厂化养殖,并逐步受到渔业从业者的推崇[14]。然而,循环水养殖模式是一种较为前沿的水产技术,因工艺设计及配套设施设备性能不同,对循环水水质及凡纳滨对虾的影响也会有所差异,因此在此方面仍需开展深入研究。本文以凡纳滨对虾为养殖对象,探究在传统工厂化换水养殖模式和循环水养殖模式下凡纳滨对虾的生长及其养殖水质状况,以期为凡纳滨对虾的适宜养殖模式及循环水养殖系统的技术熟化等方面提供科学实践依据,并为凡纳滨对虾循环水养殖模式的改进与优化提供基础数据与经验借鉴。
1 材料与方法
1.1 试验材料与设计
凡纳滨对虾苗种来自青岛海壬水产种业科技有限公司,规格均匀,体质健康。苗种进场后集中饲养,稳定后开始试验,试验对虾初始平均体质量为(2.39±0.20)g。本试验设置循环水养殖组(Recirculating aquaculture group,RAG)和传统工厂化养殖组(Industrial aquaculture group,IAG)。试验组各设置3个重复,养殖池(3 m×6 m)水深1 m,有效养殖水体体积为18 m3,放养密度为750尾/m3。养殖水体盐度为18,养殖试验时间为2022年7月23日至9月10日,共持续50 d。
1.2 循环水养殖设施
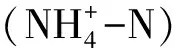
工艺流程:养殖池内的凡纳滨对虾在生长过程中产生的代谢废物及虾壳通过虾壳收集器及自动虹吸排污集中输送至微滤机,在微滤机前端可将虾壳集中去除,小颗粒废物则在微滤机反冲洗程序中排出系统。过滤后的养殖水体进入蛋白质分离器,利用臭氧杀菌,同时去除部分悬浮物。随后进入活性炭降解器,去除水体中物理颗粒微小悬浮物及降解臭氧。物理过滤后进入生物滤池,在硝化作用下净化关键水质因子,再经过脱气塔去除水体二氧化碳(CO2)。经过处理的养殖水体最后经紫外杀菌器杀菌后,到达缓冲池,再经进水管道(配备增氧锥)进入养殖池,以此达到循环。
1.3 养殖管理
试验用饲料为凡纳滨对虾专用通威饲料(粗蛋白≥44.00%、粗脂肪≥6.00%、粗纤维≤5.00%、粗灰分≤16.00%、钙0.70%~3.00%),每4 h投喂1次,日投喂6餐(01:00、05:00、09:00、13:00、17:00、21:00)。整个养殖期间,日投喂量按虾体总重的3%~6%确定。循环水养殖系统循环量为4.5 h/次,日均换水率为8.31%,由微滤机和活性炭降解器反冲洗程序排出。传统工厂化养殖组每日10:00排污1次,采用排换水方式维持水质,换水量为40%~70%。每天不定期巡视养殖车间,视察设备运行情况及凡纳滨对虾状态,车间配备昼夜值班人员。每日完成养殖记录,每10 d从各试验组养殖池分别随机打捞约0.5~1.0 kg凡纳滨对虾,清点尾数并放回,记录各池凡纳滨对虾平均尾重和总重,作为此后确定日投喂量的依据。
1.4 水质检测

使用称重法不定期测定悬浮物浓度,通过玻璃纤维滤膜抽滤水样,在60℃烘箱中烘干24 h后称重,使用精度为0.001 g的天平称量悬浮物重量,再除以水样采集体积,得到最终的悬浮物浓度。
1.5 生长指标计算
存活率SR(Survival rate,%)=Nt/N0×100
(1)
增重率WGR(Weight gain rate,%)=(Mt-M0)/M0×100
(2)
特定生长率SGR(Specific growth rate,%/d)=(lnMt-lnM0)/t×100
(3)
饵料系数FCR(Feed conversion ratio)=Fi/(Mt-M0)
(4)
摄食率FR(Feeding ratio,%)=Fi/[0.5×(Mt+M0)×t]×100
(5)
几何平均体质量GMM(Geometric mean mass,g)=(M0×Mt)0.5
(6)
式中,Nt为终末尾数;N0为初始放养尾数;M0为凡纳滨对虾初始平均体质量,g;Mt为凡纳滨对虾终末平均体质量,g;t为饲养天数,d;Fi为每尾虾的平均总摄食量,g。
1.6 数据分析
采用SPSS 26.0软件进行试验数据的统计与分析;使用独立样本T检验(Independent-sample T test)进行显著性检验。P<0.05为差异显著;P<0.01为差异极显著。试验数据结果使用平均数±标准差(Mean ± SD)表示。利用Graphpad Prism 6.00进行作图。
2 结果与分析
2.1 水质指标
2.1.1 水温和溶解氧
在养殖过程中,循环水养殖组整体水温持续高于工厂化养殖组,且在养殖中后期更为明显,但第11 ~18天,试验组间水温无明显差异(图1A)。循环水养殖组水温变动范围为26.40~31.61℃,小于工厂化养殖组水温的变动范围(25.70~31.72℃)。循环水养殖组周期内平均水温为(28.89±1.09)℃,显著高于工厂养殖组的(28.38±1.33)℃(P<0.05)。
0~31 d循环水养殖组溶解氧浓度整体高于工厂化养殖组,但在31 d后的养殖中后期,试验组间溶解氧浓度基本相似(图1B)。整个养殖期间,循环水养殖组平均溶解氧浓度[(5.55±0.68)mg/L]较工厂化养殖组[(5.42±0.64)mg/L]高2.45%。
2.1.2 pH值和总碱度
循环水养殖组pH和总碱度指标在养殖期间持续低于工厂化养殖组。各组间的pH值与总碱度浓度变化趋势相似(图2)。0~26 d试验组间的pH值变化差异较小,而到养殖中后期差异较为明显。养殖周期内的循环水养殖组平均pH值(7.48±0.28)极显著低于工厂化养殖组的(7.78±0.17)(P<0.01)。养殖开始后,循环水养殖组总碱度浓度开始下降,在人为补充碳酸氢钠后,恢复至与工厂化养殖组相当的水平,而在养殖中后期继续开始递减,并在疏虾换水后逐步回升。养殖周期内的循环水养殖组平均总碱度[(150.40±27.62)mg/L]极显著低于工厂化养殖组的[(198.40±13.30)mg/L](P<0.01)。

2.1.3 三态氮与磷酸盐

2.1.4 悬浮物
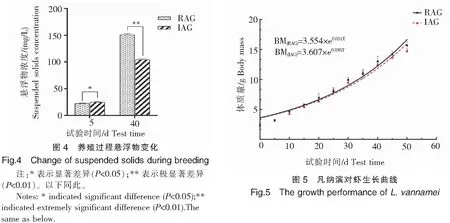
在养殖第5天时,循环水养殖组悬浮物浓度值为(22.48±0.77)mg/L,显著低于工厂化养殖组[(24.67±1.05)mg/L](P<0.05)。在40 d时,循环水养殖组悬浮物浓度[(150.78±2.51)mg/L]极显著高于工厂化养殖组[(104.08±2.19)mg/L](P<0.01,图4)。
2.2 生长性能
2.2.1 生长曲线
养殖过程中,凡纳滨对虾的体质量随着试验时间的推移而不断增加(图5)。经过50 d的养殖,循环水养殖组凡纳滨对虾收获个体重量高于工厂化养殖组,但两者差异不显著(P>0.05)。在养殖期间的采样记录中,循环水养殖组凡纳滨对虾的体质量均高于工厂化养殖组,但也无显著性差异(P>0.05)。
2.2.2 生长情况
循环水养殖组凡纳滨对虾平均体质量由(2.42±0.30)g/尾增重至(15.70±1.02)g/尾,工厂化养殖组由(2.36±0.08)g/尾增重至(14.82±0.41)g/尾,分别增重13.28 g和12.45 g,日增重率分别为26.56%和24.90%(表2)。循环水养殖组个体质量较工厂化养殖组提高5.94%,单位水体产量提高0.68%。但循环水养殖组成活率显著低于工厂化养殖组(P<0.05)。
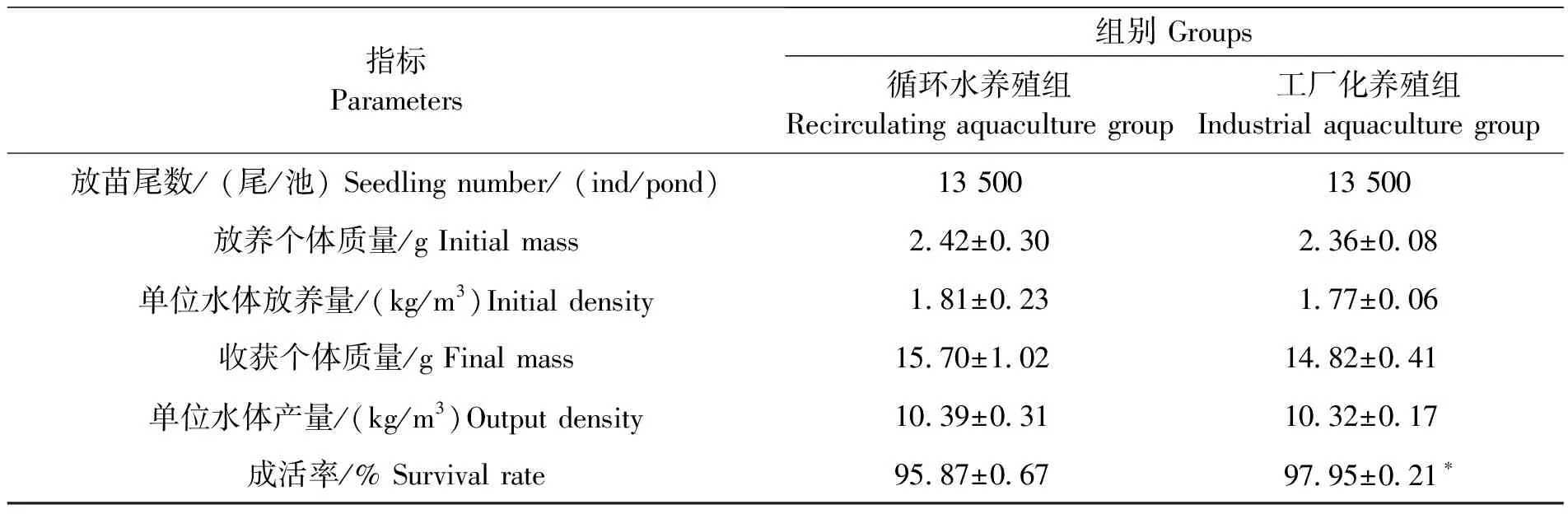
表1 不同养殖模式凡纳滨对虾养殖情况比较
2.2.3 生长速度
各试验组的特定生长率整体上随着养殖时间的延长而表现出逐渐降低的趋势。循环水养殖组在养殖周期内的特定生长率为3.75%/d,高于工厂化养殖组,但两者无显著性差异(P>0.05)。0~10 d养殖阶段,循环水养殖组特定生长率为6.54%/d,高于工厂化养殖组的6.02%/d;10~40 d养殖阶段,各试验组特定生长率从4.03%/d左右逐步下降至2.72%/d;40~50 d养殖阶段,循环水养殖组特定生长率下降至1.86%/d,工厂化养殖组下降至1.66%/d(图6 A)。各试验组0~20 d增重率下降明显,整个养殖阶段均差异不显著(P>0.05)。0~10 d循环水养殖组增重率为93.7%,高于工厂化养殖组;10~40 d各试验组增重率下降缓慢,下降幅度为18.5%;40~50 d循环水养殖组增重率降低至20.51%,高于工厂化养殖组的18.08%(图6 B)。而在20~40 d阶段,工厂化养殖组特定生长率与增重率均高于循环水养殖组,原因可能与该阶段总碱度浓度与pH值快速下降有关。

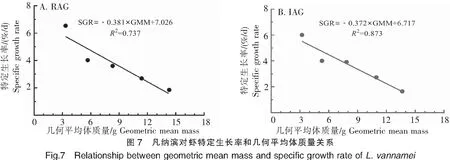
2.2.4 几何平均体质量与特定生长率
循环水养殖组(图7A)凡纳滨对虾的几何平均体质量与特定生长率具有显著的负相关关系(P<0.05),工厂化养殖组(图7B)则表现出极显著的负相关关系(P<0.01)。在同一个几何平均体质量水平时,循环水养殖组凡纳滨对虾的特定生长率高于工厂化养殖组,表明循环水养殖有利于凡纳滨对虾的生长。
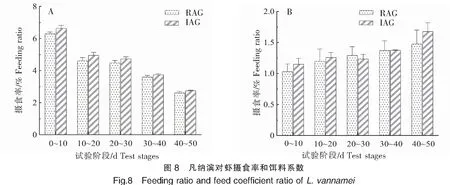
2.2.5 摄食率和饵料系数
总体上,两种养殖模式下的凡纳滨对虾摄食率均呈现出逐步降低的趋势,而且每个阶段工厂化养殖组均高于循环水养殖组,但两者差异不显著(P>0.05,图8A)。两种养殖模式下的饵料系数总体上表现出逐步升高的趋势,但各阶段无显著性差异(P>0.05,图8B)。养殖周期内循环水养殖组饵料系数为1.27,稍低于工厂化养殖组的1.34。
3 讨论
3.1 循环水养殖模式下水质特征
3.1.1 水温与溶解氧
水环境作为水产动物生存的必要条件,适宜的水温范围会促进水产动物生长、代谢及饵料转化,超出合理范围则会出现抑制现象[15-17];当溶解氧充分满足水产动物机体需要时的水环境可促进水产动物的生长,反之则会抑制[18-19]。本研究结果显示,循环水养殖组的养殖周期平均水温显著高于工厂化养殖组,溶解氧浓度高出2.45%,这表明相比传统工厂化换水模式,循环水养殖模式的水温及溶解氧条件能更好地满足凡纳滨对虾生长的需求。
3.1.2 pH与总碱度
循环水养殖组养殖周期内的总碱度和pH平均值都极显著低于工厂化养殖组,这主要与生物滤池硝化细菌和凡纳滨对虾生长的消耗有关。通常在总碱度浓度和pH值降低后,循环水养殖组会添加碳酸氢钠以调节总碱度浓度和pH值。有研究表明,适宜凡纳滨对虾生长需求的pH范围值为7.5~8.5[1]。本养殖周期内各试验组的pH均值大多在凡纳滨对虾生长的适宜范围内,仅20~40 d循环水养殖组pH平均值为7.3,无法满足凡纳滨对虾生长的需求。总碱度代表着水中的碳酸根和碳酸氢根,而凡纳滨对虾脱壳、硬壳及生长均需消耗大量的碳酸根和碳酸氢根[20]。在20~40 d时,循环水养殖组未人为补充碳酸氢钠而导致其总碱度浓度逐步降低至100 mg/L,但工厂化养殖组保持在180 mg/L以上;在第40天,循环水养殖组逐步补充碳酸氢钠后,总碱度浓度与pH值缓慢提升,凡纳滨对虾在40~50 d阶段的生长再次优于工厂化养殖组。这表明总碱度浓度与pH值的极显著降低会抑制凡纳滨对虾的生长。因此,在凡纳滨对虾循环水养殖模式下,随着养殖时间的延长,均会存在总碱度浓度和pH值降低的现象,为保证凡纳滨对虾的健康生长,应密切关注并及时调控总碱度浓度和pH值,使其处于较高水平。
3.1.3 三态氮指标
3.1.4 水体悬浮物
循环水养殖水体中的悬浮物主要由饲料和代谢物产生,其中25%的投入饲料量会转化成水体中的悬浮物[27-28]。在养殖前期第5天时,循环水养殖组悬浮物浓度显著低于工厂化养殖组;在第40天时循环水养殖组悬浮物浓度则极显著高于工厂化养殖组。产生此结果的原因,除了凡纳滨对虾快速生长、代谢加快导致的本身悬浮物增多外,还与循环水系统活性炭降解器因超负荷运行后出现故障而被移出系统有关。此结果与Chen S等[29]的报道相似,悬浮物的积累会造成养殖设施堵塞,增加生物滤池负担,进而影响到硝化反应的功能[30-31]。综合表明,在循环水设备正常运行的情况下,循环水具备明显的降低悬浮物浓度作用,而有关设备及工艺在养殖后期的性能优化还需进一步提升。
3.2 循环水养殖模式下凡纳滨对虾生长性能
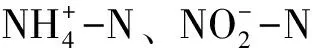
养殖过程中,除20~30 d和30~40 d的工厂化养殖组凡纳滨对虾的特定生长率和增重率高于循环水养殖组外,工厂化养殖组在其他阶段和整个养殖周期均不具备优势,且阶段规格持续低于循环水养殖组。结果表明,传统换水工厂化养殖模式在规格6.46~12.55 g/尾阶段具有一定的生长优势,但从整个养殖周期来看,循环水养殖模式更有利于凡纳滨对虾生长。这与张龙等[22]和索建杰等[5]的研究结论相似,在循环水养殖条件下凡纳滨对虾的收获规格、单位产量及特定生长率均高于传统换水工厂化养殖模式,但在本研究中两者并无显著差异。有研究表明,水体中悬浮物的积累会引起养殖动物的应激反应,降低抗病能力[33],进而引起成活率的下降。在本次研究中,循环水养殖组成活率相对较低的主要原因可能是在养殖后期,系统工艺中的活性炭降解器超负荷运行后产生故障而被移出系统,导致水体中的悬浮物浓度增高。此外,摄食率是反映水产养殖动物摄食生理的指标,直接受到本身栖息环境的影响[34]。本研究中,循环水养殖组各阶段的摄食率和饵料系数均低于工厂化养殖组,说明循环水养殖模式较传统工厂化换水养殖对对虾饲料的利用率更高。
4 结论
本次研究结果表明,循环水养殖模式在能获得更高的对虾产量情况下,还具备关键水质因子生态处理、水资源利用及环境保护等方面的优势,具有开展高密度集约化对虾养殖的良好潜力,但需要以循环水养殖系统设施设备的稳定性为前提。在注重水质调控、系统稳定情况下,凡纳滨对虾体质量和后期成活率的提高将进一步提升其产量。关于循环水系统的高效运行,需要结合工艺设计及设备性能选型,以进一步优化。

