雷珠单抗治疗视网膜分支静脉阻塞继发黄斑水肿过程中玻璃体的状态变化及其对疗效影响
王硕,刘畅,贾雯,朱恺,王凯,李晓俊,顾永昊
视网膜分支静脉阻塞(branch retinal vein occlu‑sion,BRVO)是一种常见的导致视功能障碍的视网膜血管病变,继发的黄斑水肿(macular edema,ME)可持续存在[1-3],大多数病人的视力丧失和生活质量的下降都与黄斑水肿有关[4-5]。研究证明血管内皮生长因子(vascular endothelial growth factor,VEGF)在BRVO-ME 中起重要的调控作用,玻璃体腔注射抗VEGF 药物已成为临床治疗BRVO-ME 的一线治疗方案[6,7]。
玻璃体后脱离(posterior vitreous detachment,PVD)是指后部玻璃体皮质与视网膜内界膜的脱离,一般可分为:无玻璃体后脱离,部分性玻璃体后脱离,完全性玻璃体后脱离等[8]。而在PVD 的发展变化过程中,上述分期并非逐级进展,临床中对PVD规范化诊疗及随访的重视程度相对有限[9-10]。病人玻璃体状态可影响多种眼底疾病的预后,如:年龄相关性黄斑变性(age-related macular degeneration,AMD),视网膜静脉阻塞(retinal vein occlusion,RVO),糖尿病性视网膜病变(diabetic retinopathy,DR)以及糖尿病性黄斑水肿(diabetic macular ede‑ma,DME)等[11-18]。有研究表明,RVO 患眼出现玻璃体与中心凹处粘连的频率更高,这种粘连可能促使RVO-ME的发生,表明玻璃体状态(包括无玻璃体后脱离、部分性玻璃体后脱离、完全性玻璃体后脱离等在内的不同分类)可能在RVO-ME 的发病机制中发挥一定作用[19-20],但是玻璃体状态对BRVO-ME 抗VEGF 治疗效果的影响尚未见报道。本研究观察不同玻璃体状态的BRVO-ME 病人对3 次雷珠单抗治疗的效果,以及治疗过程中玻璃体的动态变化情况,分析基线玻璃体状态在BRVO 病人抗VEGF 治疗中的可能影响,为该病的临床治疗和预后提供帮助。
1 资料与方法
1.1 一般资料通过回顾性研究,连续收集2021年2—6 月于中国科学技术大学附属第一医院眼科接受雷珠单抗治疗的BRVO-ME 病人68 例68 眼,根据纳入和排除标准,最终35 例35 眼纳入本研究,其中男15例,女20例,年龄范围32~77岁。纳入标准:①年龄>18 岁; ②以2019 年欧洲视网膜专家协会的《视网膜静脉阻塞诊疗指南》为诊断标准[21],通过眼底检查、FFA 或光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)和光学相干断层扫描(optical coherence tomography,OCT)检查,诊断为由BRVO引起的黄斑水肿。排除标准:①屈光间质浑浊影响OCT 检查;②就诊前接受过玻璃体腔内注射抗VEGF 药物或激素等治疗;③曾行视网膜激光光凝术;④其他原因导致的黄斑水肿的病人;⑤眼部手术史、外伤史;⑥存在黄斑前膜的病人;⑦存在严重的控制不良的糖尿病、肾脏疾病等全身疾病;⑧未能完成初始至3 针治疗或未能完成随访病人。所有研究对象均经至少2位医生筛查后确认入组。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1常规检查 受试者均行眼科常规检查,包括:最佳矫正视力(best corrected visual acuity,BC‑VA),裂隙灯检查眼前节,间接检眼镜检查眼底,非接触眼压计测量眼压等。
1.2.2眼超声检查 天津迈达医学科技有限公司眼科A/B 型超声诊断仪(型号ODM-2100S),超声频率10 MHz,检查玻璃体视网膜情况。检查时嘱病人呈仰卧位,眼睑涂耦合剂后对病人进行多个切面的扫描,在扫描时调整增益,观察玻璃体腔内出现的高回声光带,并嘱病人转动眼球,判断条状光带的活动度和后运动情况。
1.2.3光学相干断层扫描检查 采用RTVue XR AvantiOCT 机(美国Optovue),使用Raster 检查模式,嘱病人注视视标,将黄斑区置于中心进行扫描,扫描深度>3 mm,扫描宽度>10 mm。每次扫描时间不少于3 s,同时通过改变图像对比度和亮度来增强玻璃体后皮质的可视化。
1.2.4病人玻璃体状态的评估 参照Moon 等[22]和Geck等[23]报道的方法,综合使用间接眼底镜,B超及OCT 相结合的检查对玻璃体状态进行评估,本研究中,病人的基线玻璃体状态可分为无PVD,部分PVD,完全PVD。其中部分PVD 可根据玻璃体黄斑粘连(VMA)的长度分为部分PVD 伴黄斑广泛粘连和部分PVD伴黄斑局限粘连。见图1。

图1 视网膜分支静脉阻塞继发黄斑水肿(BRVO-ME)病人玻璃体视网膜B超及OCT检查图像:A为无玻璃体后脱离(PVD)组;B为局限玻璃体黄斑粘连(VMA)组;C为广泛VMA组;D为完全PVD组
首先,使用间接眼底镜在充分散瞳的情况下对玻璃体视网膜界面进行观察,若观察到完全性的玻璃体坍塌或者玻璃体后出现的Weiss 环则认为该眼存在完全PVD。
在B超的动态扫描中若在玻璃体内观察到连续的条带状回声,且不与后极部球壁相连,则认为发生完全性PVD,若未观察到带状条带可诊断为无PVD,若玻璃体内的连续条带状回声有一点以上与后极部球壁相连,活动度和后运动试验均为阳性者诊断为部分PVD[24]。
根据OCT 检查结果[25],选择玻璃体黄斑粘连最长的层面进行测量,将部分PVD 病人分为两组:①局限性VMA:玻璃体黄斑粘连部分≤1 500 µm;②广泛性VMA:玻璃体黄斑粘连部分>1 500 µm[26]。
每例病人的资料由2名检查者对PVD状态进行评估,若评估结果不一致时2 名检查者则对病人图像重查及重新评估,并达成一致。
1.2.5 治疗方法所有病人及近亲属均被告知手术相关风险并签署玻璃体腔注药术的手术知情同意书,按照欧洲视网膜专家协会对于视网膜静脉阻塞的治疗指南建议进行雷珠单抗玻璃体腔注射(ra‑nibizumab)治疗,每月1次,连续3月。治疗前1天使用左氧氟沙星滴眼液滴患眼,每2 小时1 次,术中用安尔碘消毒结膜囊,并嘱病人平躺于手术台,行常规内眼手术消毒铺巾,用配套注射器抽取药物,在颞下方距角膜缘3~4 mm 处垂直进针,确认针头位于玻璃体腔内后缓慢推入雷珠单抗约0.5 mg,退针后压迫进针部片刻,指测眼压,将典必殊眼膏涂于结膜囊内,无菌纱布包眼,手术全程在无菌手术室由同一高年资主治医师完成,术后左氧氟沙星滴眼液每日4次连续滴眼至少3 d,密切观察术眼情况。
1.3 术后随访病人完成初始连续3 月、每月1 针治疗,病人于每次注射后1月复查玻璃体状态,复诊时行视力,眼压,裂隙灯,眼底情况,黄斑部OCT和B超检查,病人随访至少4月。
1.4 评价指标观察在行雷珠单抗治疗玻璃体状态的改变,并记录每次注射后的BCVA 和黄斑中心凹厚度(central macular thickness,CMT),CMT 为OCT 机在Retina Map 模式下自动测量给出的中心凹1 mm2平均厚度,BCVA 采用国际标准化视力表,换算为最小分辨角对数(logaeithm of the minimum an‑gle of resolution,LogMAR)。
1.5 统计学方法采用SPSS 21.0 统计学软件进行统计学分析。本研究中病人按照基线玻璃体状态分为四组,无PVD 组、局限VMA 组(即部分PVD 伴局限VMA 组)、广泛VMA 组(即部分PVD 伴广泛VMA 组)、完全PVD 组。统计资料符合正态分布的计量资料采用±s表示,使用单因素方差分析组间差异,两两比较使用LSD-t进行分析;不符合正态分布的计量资料以中位数(第25、第75 百分位数),即M(P25,P75)表示,采用非参数检验的Kruskal-WallisH检验分析组间差异,两两比较使用Mann-WhitneyU方法和Bonferroni 校正进行分析;同组病人在不同治疗时间与未治疗时的比较使用Wilcoxon 符号秩检验;对照定性资料使用χ2检验,不满足检验条件时使用Fisher 确切概率法,比较病人治疗前后在随访时的差异,P<0.05认为差异有统计学意义。
2 结果
2.1 病人基线情况本组35 只眼中,按基线玻璃体状态分为四组,分别为无PVD,局限VMA,广泛VMA,完全PVD。如表1 所示,除眼轴外,各组病人的各项基线参数均差异无统计学意义(P>0.05)。
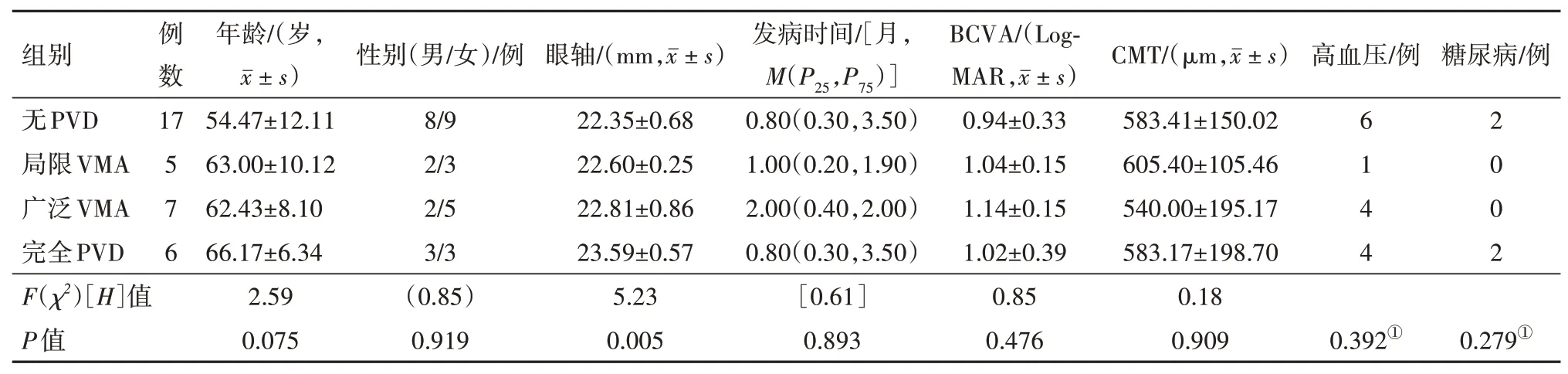
表1 雷珠单抗治疗的视网膜分支静脉阻塞继发黄斑水肿(BRVO-ME)病人35例35眼一般资料比较
2.2 各组病人抗VEGF治疗前后BCVA及CMT的情况各组病人的BCVA 在治疗1次、2次、3次后的BCVA 与治疗前相比都有明显改善(P<0.05),基线玻璃体状态不同的各组病人之间在注药1次后,2次后,3 次后的BCVA 差异无统计学意义(P>0.05),见表2。
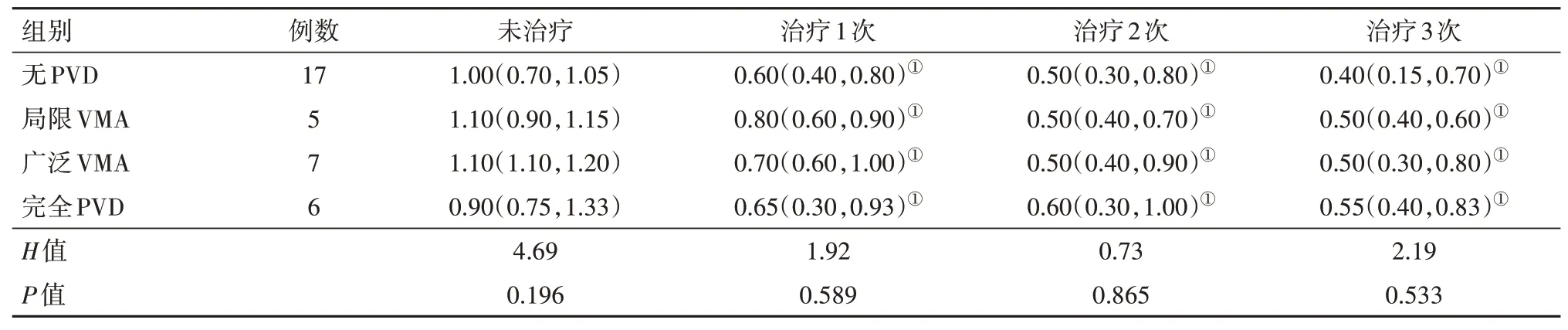
表2 雷珠单抗治疗的BRVO-ME病人35例35眼治疗前后的BCVA/[LogMar,M(P25,P75)]
各组病人的CMT 在治疗1 次后,2 次后,3 次后与治疗前相比均有明显差异(P<0.05)。注药1 次后,局限VMA 组的CMT[452.00(433.50,591.50)µm]与无PVD 组[336.00(311.00,361.00)µm,P=0.016]、广泛VMA组[335.00(251.00,357.00)µm,P=0.028]相比较明显较大。第2 次注药后,局限VMA组的CMT[358.00(330.50,504.00)µm]与无PVD 组[259.00(235.00,291.00)µm,P=0.021]、广泛VMA组[237.00(233.00,278.00)µm,P=0.036]相比较仍然明显较大。而注药3次后各组间的CMT差异无统计学意义(P>0.05),见表3。

表3 雷珠单抗治疗的BRVO-ME病人35例35眼抗VEGF治疗的CMT/[µm,M(P25,P75)]
2.3 抗VEGF治疗过程中病人玻璃体状态变化在35 只眼中,四组玻璃体状态变化差异无统计学意义(P=0.086),第2次治疗后,四组玻璃体状态变化仍差异无统计学意义(P=0.057),第3次治疗后,玻璃体状态整体向后脱离方向发展,差异有统计学意义(P=0.001)。见表4。
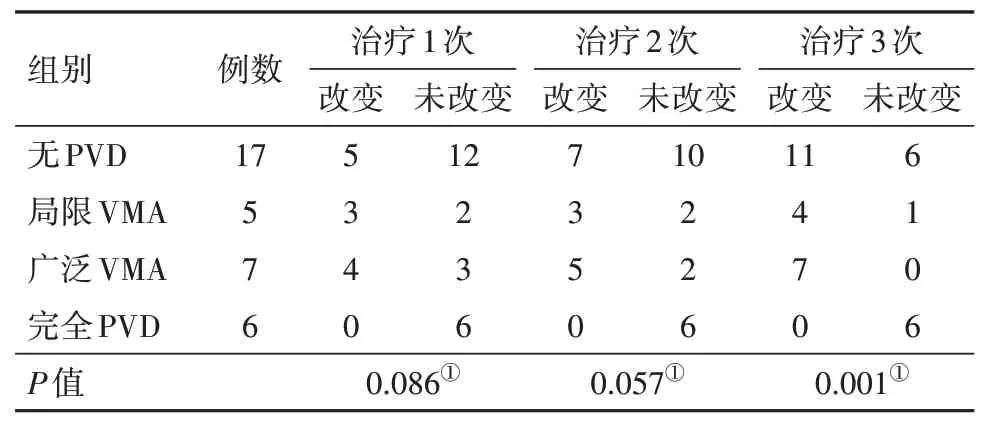
表4 雷珠单抗治疗的视网膜分支静脉阻塞继发黄斑水肿(BRVO-ME)病人35例35眼治疗前后玻璃体状态变化/例
3 讨论
玻璃体状态与黄斑裂孔、视网膜脱离等疾病的发生发展相关[27-29],也有研究表明其可能影响AMD、DR、DME 病人玻璃体腔注射抗VEGF 药物的疗效[13-16]。目前关于基线玻璃体状态对RVO-ME 病人抗VEGF 治疗的影响尚未见报道,本研究即是对不同玻璃体状态BRVO-ME 病人在初始3 针雷珠单抗治疗过程中的疗效进行观察,同时也观察其玻璃体状态的改变。
本研究结果表明,所有入组病人经过初始3 针治疗后BCVA 均有显著改善,且不同基线玻璃体状态的四组病人间BCVA 无显著性差异,说明基线时BRVO-ME 病人玻璃体状态对治疗后视力无明显影响。Singh 等[12]对52 例不同玻璃体黄斑黏附状态的RVO-ME病人进行抗VEGF治疗,随访6个月的结果表明RVO 病人玻璃体黄斑黏附状态与抗VEGF 治疗结果之间无联系,这与我们的研究结果一致。说明基线玻璃体状态对该类病人抗VEGF 治疗的预后无明显影响。
本研究中,基线不同玻璃体状态的RVO-ME 病人经过初始3 针的雷珠单抗治疗,CMT 都获得明显下降;而局限VMA 的病人与无PVD 组及广泛VMA组病人相比,在治疗1 次及2 次后CMT 均明显较大,而在治疗3 次后则差异无统计学意义,说明存在局限VMA 病人的黄斑水肿在早期更加难以消退。李石磊等[30]研究表明BRVO 病人行抗VEGF 治疗观察6 月后,没有VMA 的病人比存在VMA 病人的CMT降低更多。我们认为存在局限VMA 病人会由于玻璃体机械牵拉减少视网膜内的组织压力,使得血管和组织之间的压力差增加,从而促进水肿形成,此外玻璃体后皮质作为支架,可能使VEGF 等细胞因子更难消除,这也不利于早期黄斑水肿的消退[31],在经过3针治疗后病人玻璃体整体向后脱离方向发展后,对CMT即无影响。
本研究中,各组病人在第1 次治疗及第2 次后玻璃体状态无显著变化,但第3 次治疗后玻璃体状态发生明显改变,基线为无PVD 的17 眼中有9 眼变为广泛VMA(53%),基线为广泛VMA 的7 眼中有3眼变为局限VMA,4 眼变为完全PVD,基线为局限VMA 的5 眼中有4 眼变为完全PVD(80%),这表明持续的抗VEGF 治疗会使玻璃体状态向着后脱离方向发展。Stalmans 等[32]在一项VMA 病人的多中心随机双盲研究显示,接受安慰剂注射(0.10 mL)的病人中,也发现有10.1%的眼在手术后28 d VMA 消失,提示除注射药物本身外,玻璃体腔注射的机械作用可能也可能通过改变玻璃体内的牵张力,诱发玻璃体状态改变。
未治疗时,完全PVD 病人在基线水平的眼轴较其余各组更长,与眼轴增长对玻璃体生化结构的影响有关,即长眼轴病人更易出现PVD[33-35],但是本研究中这些并不影响病人的预后。
本研究也存在一些不足:首先,样本量有限,可能对结果造成一定的偏倚,对视盘边缘持续性玻璃体粘连(vitreopapillary adhesion,VPA)等其他类型的病人由于病例数太少未能纳入;其次,未纳入黄斑前膜和黄斑玻璃体牵拉病人,已有研究表明这些病人由于炎性因子更易在黄斑区积聚,同时由于玻璃体后皮质的持续牵拉作用以及前膜在切线方向的收缩,会导致黄斑水肿加重[36-38],影响抗VEGF 治疗的效果[39];第三,不同药物和不同注射量可能对PVD 有影响,受条件所限,我们未能观察到其他药物的影响;最后,受研究时间所限,本组病人随访时间为4个月,未能观察更长时间的影响。
综上所述,本研究结果表明不同玻璃体状态的BRVO-ME 病人,在经过初始三针雷珠单抗治疗之后均能获得明显的视力获益和水肿消退。局限VMA 可能在治疗初期影响水肿消退,但在经过3 针后即无明显差异。同时,经过3针后,病人玻璃体状态整体向后脱离方向发展。

