乳腺癌组织中泛素特异性蛋白酶18/干扰素刺激基因15表达水平及其临床意义
蔡冰,尹香利,刘静
乳腺癌发病率呈逐年增高趋势,对女性生存质量造成严重影响[1]。泛素特异性蛋白酶18(USP18)在喉鳞状细胞癌组织中呈过表达,其有助于评估喉鳞状细胞癌预后情况[2];干扰素刺激基因15(interfer‑on stimulated gene 15,ISG15)在乳腺癌组织中表达上调,其可能是诊治乳腺癌的潜在靶标[3];且USP18 可将ISG15从其靶向蛋白上水解出来,进而在调控细胞多种信号途径中发挥作用[4]。但USP18 在乳腺癌病人癌组织中的表达水平与ISG15的相关性及与乳腺癌预后的关系尚未明确。基于此,本研究通过Ual‑can 数据库检索USP18、ISG15 在乳腺癌中的表达情况及二者与乳腺癌预后的关系,并利用实时荧光定量PCR(qRT-PCR)法、免疫组化法检测乳腺癌病人癌组织USP18、ISG15 表达水平,旨在分析USP18、ISG15相关性及两者与预后的相关性。
1 资料与方法
1.1 一般资料选取2012 年5 月至2015 年7 月于渭南市中心医院行根治性切除术的乳腺癌病人99例为研究对象,均为女性,年龄(49.28±10.22)岁,范围为35~65 岁,<50 岁者53 例,≥50 岁者46 例;肿瘤长径<2 cm 者48 例,≥2 cm 者51 例;TNM 分期Ⅰ~Ⅱ期者66例,Ⅲ~Ⅳ期者33例;绝经者40例,未绝经者59 例;无淋巴结转移者64 例,淋巴结转移者35 例;低分化者25 例,中、高分化者74 例。根据文献[5]及雌激素受体(ER)、表皮生长因子受体-2(HER-2)、孕激素受体(PR)免疫组化检测结果将乳腺癌病人分为Luminal A 型(PR+或ER+、HER-2-)41 例、HER-2过表达型(PR-、ER-、HER-2+)20 例、Luminal B 型(PR+或ER+、HER-2+)23 例、基底细胞样型(PR-、ER-、HER-2-)15例。
诊断标准:参考《乳腺癌诊疗规范(2011 年版)》[6]有关乳腺癌判定标准进行诊断。纳入标准:(1)受试者术后组织样本经病理学检查确诊为浸润性乳腺癌;(2)受试者均行腹部和妇科B 超等检查,检查资料齐全;(3)受试者术前未接受放化疗、内分泌治疗或其他治疗。排除标准:(1)合并胃癌、前列腺癌或其他肿瘤者;(2)合并高血压、急慢性感染、严重心、肝、肾功能不全、糖尿病者;(3)病理诊断不明确或失访者。
受试对象对本研究知情同意,获得渭南市中心医院伦理委员会批准(批号201204152)。
1.2 方法
1.2.1Ualcan 数据库检索 利用Ualcan 数据库(http://ualcan.path.uab.edu)检索USP18、ISG15 表达水平及二者与预后的关系。gene symbol 设置为USP18、ISG15,TCGA 数据集设定为breast invasive carcinoma,进行检索。
1.2.2组织标本收集 取乳腺癌病人在根治性切除术中切除的组织标本(乳腺癌组织和距离癌组织>3 cm 的癌旁正常组织),液氮罐中冻存24 h,移至-80 ℃冰箱中冻存;剩余部分组织标本放置于福尔马林中固定,用于制备石蜡标本切片。
1.2.3qRT-PCR 法检测组织标本USP18、ISG15 mRNA 表达水平 取出“1.2.1”中冻存的标本,研碎,利用TRIzol试剂盒(无锡百泰克生物技术有限公司)提取标本总RNA,应用Revert Aid First Strand cDNA Synthesis Kit(K1622,上海恒斐生物科技有限公司)将组织标本RNA 反转录成cDNA。依照Perfectstart SYBR Green qPCR master mix 试剂盒(TQ2300-02,北京索莱宝科技有限公司)说明书配制反应体系,运用qRT-PCR 仪(ABI7500,上海普迪生物技术有限公司)进行扩增、检测。以2-∆∆Ct法计算USP18、ISG15 mRNA 相对表达量。USP18、ISG15 均以GAPDH 为内参,引物序列详见表1。
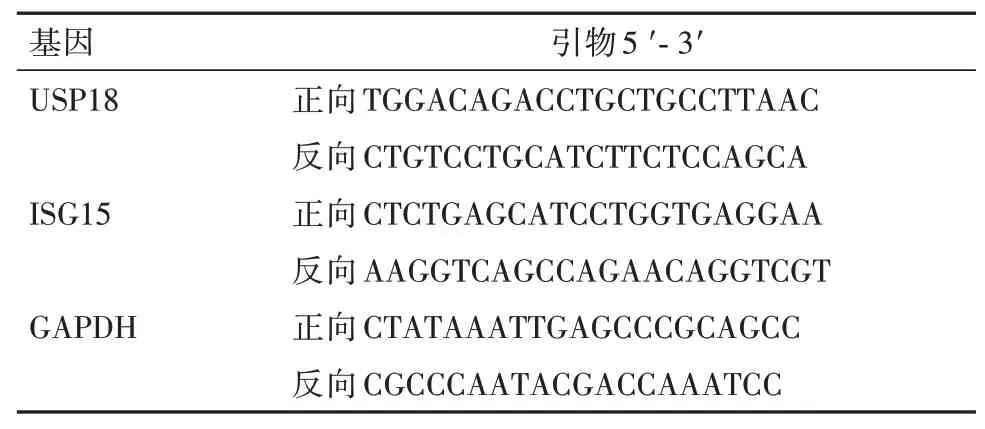
表1 USP18、ISG15、GAPDH引物序列
1.2.4免疫组化法检测组织标本USP18、ISG15蛋白表达水平 取石蜡标本切片(厚约4 µm),利用链霉亲和素-生物素复合物法染色,参考相关试剂盒说明书进行操作,一抗分别为兔抗人USP18 多克隆抗体(上海群己生物科技有限公司,批号H00011274-B01,稀释比为1∶100)、ISG15多克隆抗体(艾美捷科技有限公司,批号A71120-100,稀释比为1∶100),应用二氨基联苯胺显色、苏木素复染、梯度乙醇脱水,封片,显微镜(DMi1,上海徕卡显微系统贸易有限公司)下拍照。按染色程度(A)和阳性细胞比例(B)评分乘积判定USP18、ISG15蛋白表达情况:(1)染色程度:将无色、淡黄色、棕黄色、棕褐色分别定义为0、1、2、3 分;(2)阳性细胞百分比:将<25%、25%~49%、50%~75%、>75%分别定义为0、1、2、3分。判定结果(A×B):<3分定义为阴性,以≥3分定义为阳性[7]。
1.3 随访对99例乳腺癌病人术后进行9~60个月随访,以院内复查、微信为主要随访方式,以乳腺癌病人手术次日为随访起点,2020 年7 月或乳腺癌病人死亡为随访终点,记录乳腺癌病人预后生存状况。
1.4 统计学方法运用SPSS 25.0 软件处理数据。以±s表示连续变量资料,组间比较行独立样本t检验;以例(%)表示计数资料,乳腺癌组织USP18、ISG15表达水平与临床病理特征关系进行χ2检验;乳腺癌病人组织中USP18、ISG15蛋白表达情况及乳腺癌病人癌组织中USP18 表达水平与ISG15 相关性进行χ2检验;利用Kaplan-Meier曲线及log-rank检验分析乳腺癌组织USP18、ISG15表达水平与乳腺癌病人预后的关系;Cox回归分析法分析乳腺癌病人预后的影响因素。P<0.05表示差异有统计学意义。
2 结果
2.1 Ualcan 数据库中乳腺癌组织和正常乳腺组织USP18、ISG15 mRNA 表达水平比较Ualcan 数据库中,乳腺癌组织USP18 为18.40±4.17、ISG15 mRNA 表达水平为168.56±43.95,均高于正常乳腺组织(10.00±3.14、30.76±8.23,P<0.001)。
2.2 乳腺癌、癌旁正常组织中USP18、ISG15 mRNA 及其蛋白表达水平比较与癌旁正常组织相比,乳腺癌组织USP18、ISG15 mRNA 表达水平显著升高,分别为癌旁正常组织的1.62、1.88 倍(P<0.05)。免疫组化结果显示,USP、ISG15 均主要定位于细胞质,如图1 所示。乳腺癌组织USP18、ISG15阳性表达率均高于癌旁正常组织,分别为癌旁正常组织的3.38、2.11倍。见表2。
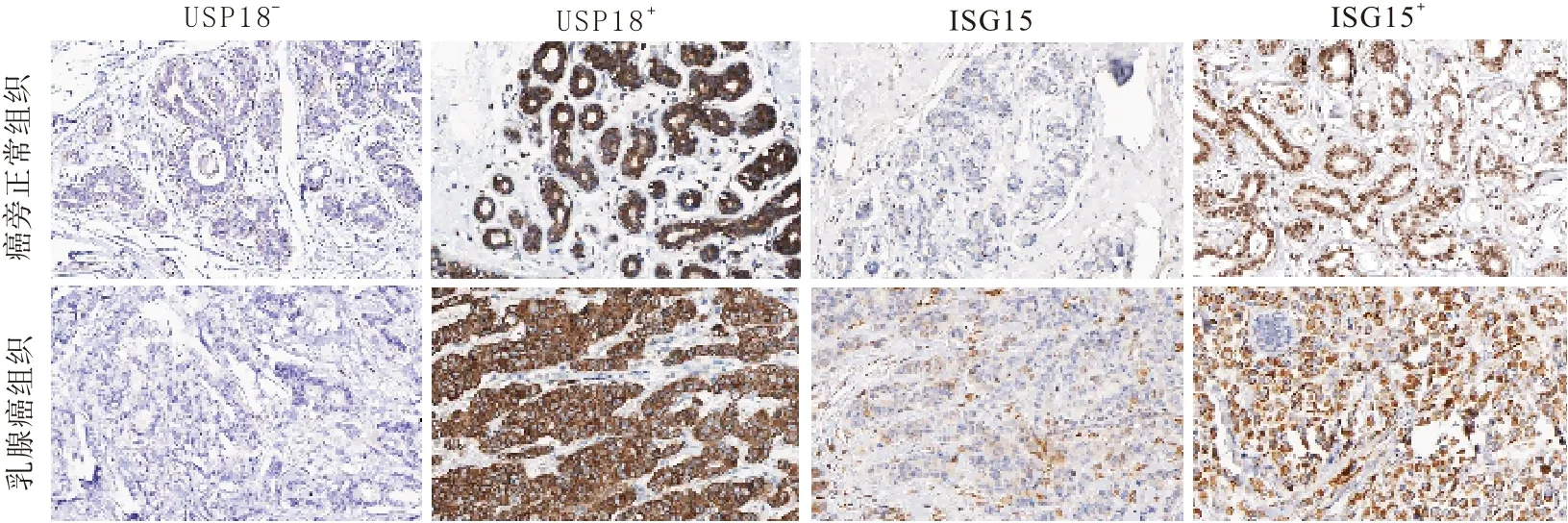
图1 USP18、ISG15蛋白在乳腺癌组织及癌旁正常组织中的典型表达病理示例(链霉亲合素-生物素复合物法×200)
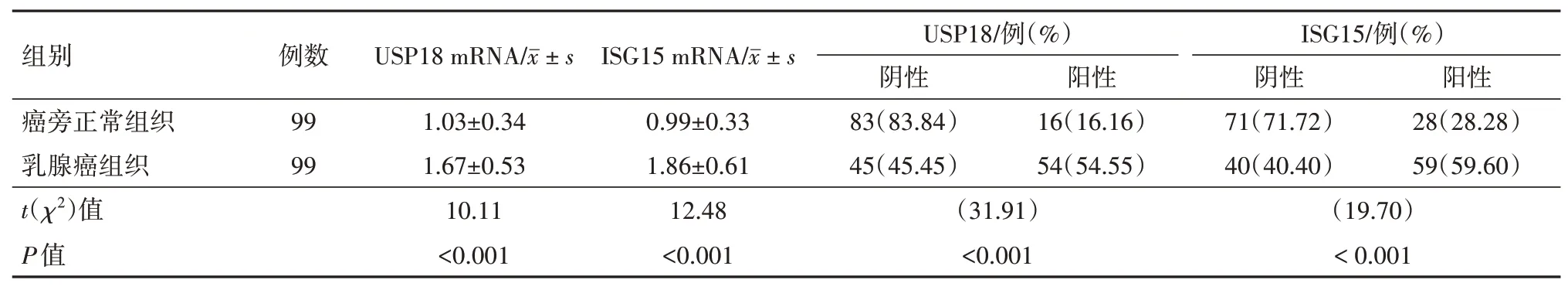
表2 乳腺癌病人99例乳腺癌组织、癌旁正常组织USP18、ISG15 mRNA及其蛋白表达水平比较
2.3 乳腺癌组织USP18、ISG15 表达水平与临床病理特征关系乳腺癌组织USP18、ISG15 表达水平均与淋巴结转移、乳腺癌分子亚型、肿瘤分化程度、TNM 分期相关(P<0.05),而与年龄、肿瘤长径、是否绝经无关(P>0.05)。见表3。
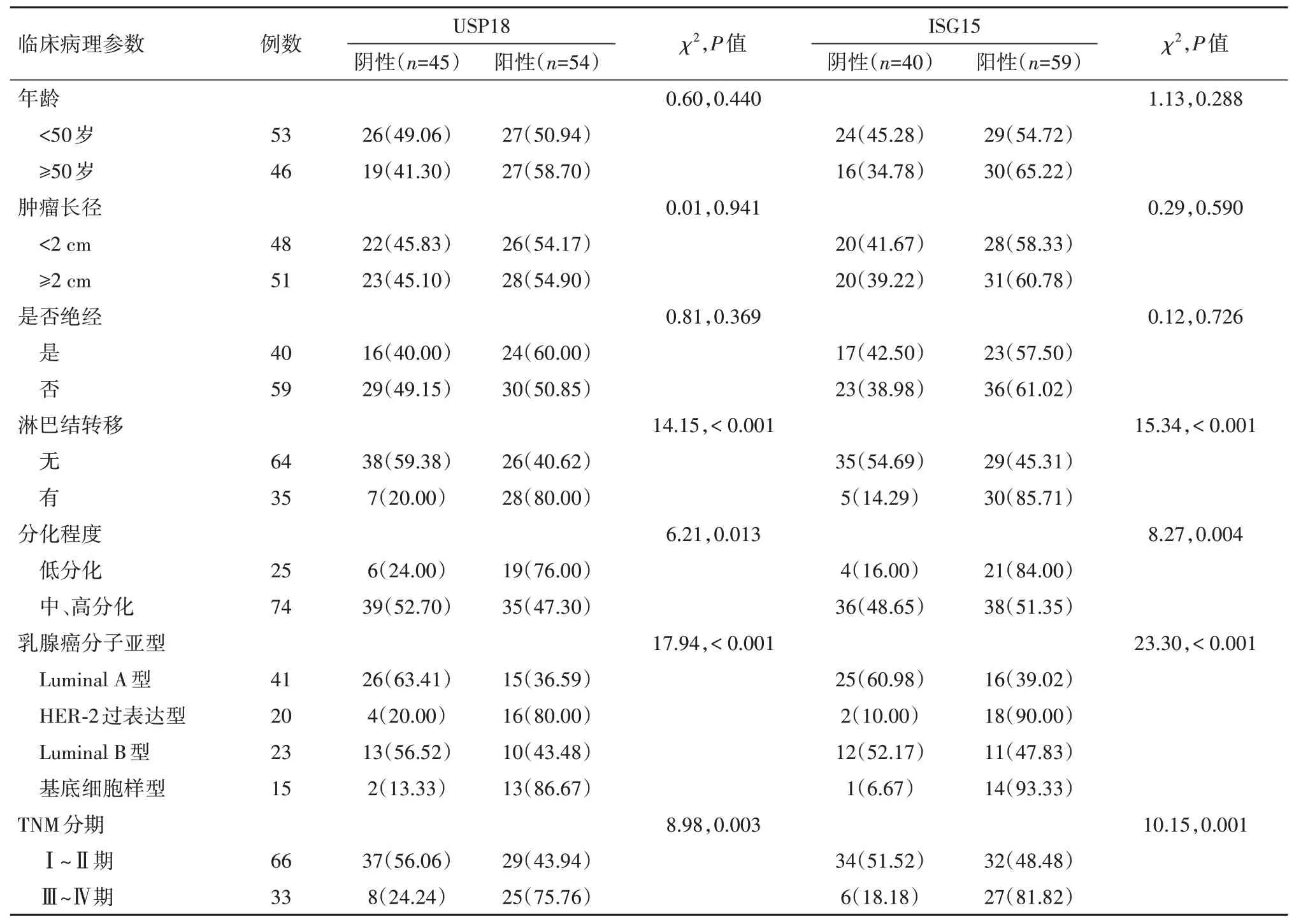
表3 乳腺癌组织USP18、ISG15表达水平与临床病理特征关系/例(%)
2.4 乳腺癌病人癌组织USP18 表达水平与ISG15的相关性配对χ2检验显示,乳腺癌病人癌组织中USP18 表达水平与ISG15 呈正相关(P<0.05)。见表4。

表4 乳腺癌病人癌组织中USP18表达水平与ISG15相关性/例
2.5 Ualcan 数据库中癌组织USP18、ISG15 表达水平与乳腺癌病人预后的关系Ualcan 数据库分析显示,癌组织USP18、ISG1 高低表达组累积生存率[21.89%(58/265)比36.89%(301/816)、22.10%(59/267)比36.98%(301/814)]差异无统计学意义(P>0.05)。
2.6 癌组织USP18、ISG15 表达水平与乳腺癌病人预后的关系跟踪随访99 例乳腺癌病人9~60 个月,死亡23 例,总生存率为76.77%。Kaplan-Meier生存分析显示,USP18 阳性组乳腺癌病人平均生存时间为50.61 个月,95%CI:(46.57,54.66),短于USP18 阴性组平均生存时间为57.56 个月,95%CI:(35.05,60.06),log-rank 检验比较USP18 阳性组与USP18 阴性组生存率,差异有统计学意义(χ2=9.24,P=0.002);ISG15 阳性组平均生存时间为50.92 个月,95%CI:(47.12,54.71),短于ISG15 阴性组平均生存时间为57.98 个月,95%CI:(55.44,60.51),经Log-Rank 检验结果显示,ISG15 阳性组、阴性组生存率差异有统计学意义(χ2=8.97,P=0.003)。
2.7 Cox 回归分析乳腺癌病人预后的影响因素单因素Cox分析显示,淋巴结转移、乳腺癌分子亚型(哑变量赋值:Luminal A 型、Luminal B 型、HER-2 过表达型、基底细胞样型分别赋值为0、1、2、3)中HER-2过表达型、基底细胞样型、TNM 分期、USP18、ISG15 是影响乳腺癌病人不良预后的危险因素(P<0.05),分化程度是影响乳腺癌病人预后的保护因素(P<0.05);多因素Cox 分析结果显示,淋巴结转移、TNM 分期、USP18、ISG15 均是影响乳腺癌病人不良预后的独立危险因素(P<0.05)。见表5。
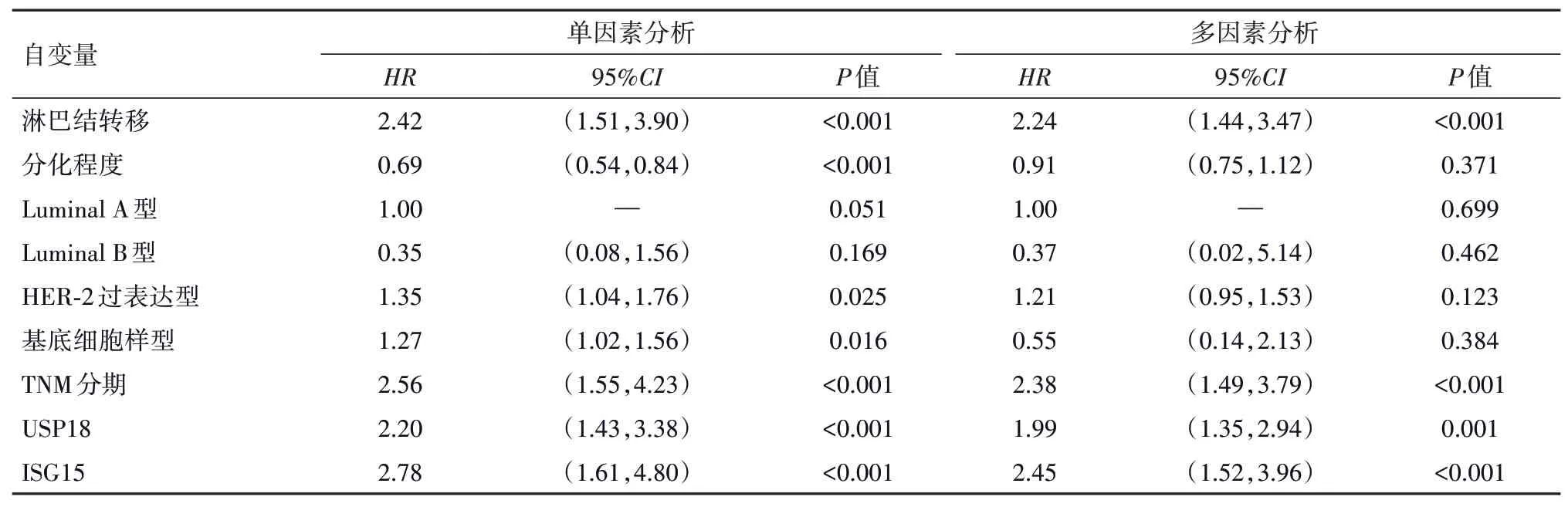
表5 影响乳腺癌病人预后因素的Cox回归分析
3 讨论
乳腺癌是多发于女性乳房腺上皮组织的妇科肿瘤,发病率较高,直接威胁女性生存情况[8]。因此,寻找与乳腺癌发病及预后有关的指标,给予合适干预,对改善女性病人生存状况有一定积极意义。
USP18 是泛素系统成员之一,其可介导蛋白泛素化,调控多种信号途径,影响细胞增殖、凋亡等生物学过程[9-10]。研究发现,USP18在结直肠癌中呈高表达,其可能通过泛素化途径调控Snail1蛋白表达,进而促进结直肠癌细胞增殖、侵袭、迁移,从而在结直肠癌病理发展中起促进作用[11]。此外,Tan 等[12]通过基因富集分析、生物信息学分析发现USP18 可能与乳腺癌病人癌细胞凋亡呈负相关、与乳腺癌病人不良预后关系密切,USP18 可能通过激活有关途径,并上调表皮生长因子受体进而在乳腺癌发展中发挥重要作用。本研究显示,乳腺癌病人癌组织中USP18 蛋白阳性表达率、USP18 mRNA 表达水平较高,与Tan 等[12]研究结果及Ualcan 数据库检索结果相符,且乳腺癌组织USP18 表达水平与淋巴结转移、乳腺癌分子亚型、肿瘤分化程度、TNM 分期相关,提示USP18 表达异常可能与乳腺癌分子亚型、病变进程有关,USP18 可能是治疗乳腺癌的潜在靶标,测定癌组织USP18 表达情况有助于临床制定较为精准的个体治疗方案,推测高表达USP18 可能通过泛素化途径调节多种蛋白异常表达,促进乳腺癌细胞异常增殖、转移,影响其凋亡,从而促进乳腺癌病情进展[13]。
ISG15 是一种类泛素蛋白,其能通过酶级联反应修饰靶蛋白,调节蛋白活性,参与转录调控、染色体修复、应激反应、RNA 剪接、蛋白质翻译等过程[14-16]。研究发现,ISG15在乳腺癌细胞中表达水平显著升高,其可能参与乳腺癌发展进程,ISG15 可能是乳腺癌发生转移的关键标志物[17];另外,王军武等[18]发现ISG15在乳腺癌病人中呈高表达,ISG15可作为评估乳腺癌病人病情的潜在指标。本研究中,乳腺癌病人癌组织中ISG15 蛋白阳性表达率、ISG15 mRNA 表达水平较高,与Ualcan 数据库检索结果一致,ISG15阳性表达率随淋巴结转移、TNM 分期升高/分化程度降低而呈升高趋势,且与乳腺癌分子亚型有关,提示ISG15 可能与乳腺癌病变进展及不同分子亚型乳腺癌显著相关,检测癌组织ISG15表达水平有利于判定乳腺癌分子亚型,制定有效的干预方案,究其原因,高水平ISG15可能通过修饰靶蛋白,影响有关信号通路,调节相关蛋白表达,从而影响乳腺癌病变过程[19]。此外,本研究显示,乳腺癌病人癌组织中USP18 表达水平与ISG15 呈正相关,提示USP18 可能与ISG15 共同影响乳腺癌发生发展,可能原因,USP18 可影响ISG15 水平,进而影响乳腺癌进程。进一步研究显示,USP18 阳性组、ISG15 阳性组乳腺癌病人术后60 个月生存率低于USP18 阴性组、ISG15 阴性组,提示癌组织USP18、ISG15 表达水平均与乳腺癌病人不良预后关系密切,USP18、ISG15表达水平越高,乳腺癌病人预后可能越差,USP18、ISG15 可辅助评估乳腺癌病人预后情况,但本研究与Ualcan 数据库检索结果并不一致,这可能与个体差异、分组情况、随访年限有关,后期将扩大样本、延长随访年限,确定本研究的准确性。Cox分析结果显示,淋巴结发生转移、TNM 分期越高、USP18、ISG15 表达水平升高均可能提高乳腺癌病人发生不良预后风险,及时检测乳腺癌组织USP18、ISG15表达情况可能有利于及早评估乳腺癌病人预后状况。
综上,USP18、ISG15 在乳腺癌病人癌组织均表达上调,两者均与乳腺癌病人预后有关,测定癌组织USP18、ISG15 水平有利于临床判断乳腺癌病人病情、评估乳腺癌病人预后。本研究创新点在于:利用Ualcan数据库分析了USP18、ISG15在乳腺癌中的表达情况,并从mRNA 水平(qRT-PCR)和蛋白水平(免疫组化)验证了USP18、ISG15 在乳腺癌中的表达情况,初步分析了USP18、ISG15间的相关性,及二者与乳腺癌临床病理特征及预后的关系,为临床评估乳腺癌病人病情及预后提供参考,但存在一定局限性,后期将进一步扩大样本量分析不同分子分型中ISG15、USP18与临床特征及预后的关系。

