身体质量指数对卵巢储备下降病人行新鲜胚胎移植临床结局的影响分析
孙晶雪,刘伟,郑娟,郭岩文,任建枝
随着生活水平提高,因生活方式和饮食结构改变导致中国女性发生超重的概率大幅度增加[1]。国内外关于身体质量指数(BMI)对体外受精-胚胎移植(in vitro fertilization -embryo transfer,IVF-ET)/单精子卵胞浆内显微注射(intracytoplasmic sperm in‑jection,ICSI)临床结局及分子机制的研究报道日益增多,但多着重于多囊卵巢综合征病人人群,且与超重/肥胖病人相关[2],而对于BMI 是否影响卵巢储备下降(diminished ovarian reserve,DOR)病人临床结局缺乏相关报道。目前各大生殖中心面临的DOR 病人群体比例逐渐增多,这类病人由于卵子数目少、卵子质量差及部分合并高龄等特点,为避免卵巢功能进一步下降而尽快助孕这一措施变得至关重要。低BMI 及单纯性超重DOR 病人临床结局如何,病人是否应将BMI 改善至正常范围内后再行IVF-ET,这些都是临床亟待解决的问题。改良长方案已在临床广泛应用,多篇研究报道该方案对于卵巢储备下降病人亦可得到较满意的临床结局[3-5]。本研究回顾性分析1 752例行改良长方案的DOR 病人的超促排卵、实验室及临床结局,以期了解不同年龄以及不同BMI对DOR行IVF-ET的影响作用。
1 资料与方法
1.1 一般资料选取2013 年1 月至2021 年12 月于陆军第七十三集团军医院采用改良长方案行IVF/ICSI的DOR病人1 752例。
纳入标准:(1)符合IVF/ICSI指征;(2)新鲜周期移植;(3)根据2011 年卵巢低反应博洛尼亚共识[5]:DOR 为抗苗勒管激素(AMH)<0.5~1.1 个或AFC<5~7 个,本研究采用月经第2 天B 超示双侧窦卵泡数(AFC)总数<7 个标准入组;(4)胰岛素释放试验、糖耐量试验、肝肾功能、血脂均处于正常范围内;(5)BMI<28 kg/m2;(6)月经规律,有自然排卵。
排除标准:(1)可能影响胚胎着床的因素:如子宫内膜异位症、子宫腺肌症、子宫畸形、宫腔粘连等。(2)合并甲状腺功能亢进、甲状腺功能减退。(3)既往复发性流产史、不良孕产史。
分组标准:根据年龄分为A 组(<35 岁)及B 组(≥35 岁);根据BMI 不同,参照中华人民共和国卫生行业标(WS/T428-2013)成人BMI判定[7]标准分为第1 组即低BMI 组(BMI<18.5)、第2 组即正常BMI 组(18.5≤BMI<24)、第3 组即单纯性超重组(24≤BMI<28)。
病人或其近亲属知情同意,本研究经陆军第七十三集团军医院伦理委员会批准同意(批号73JYY202274675)。
1.2 研究方法
1.2.1改良长方案IVF 月经期1~2 d 肌内注射长效促性腺素释放激素激动剂即醋酸曲普瑞林3.75 mg 降调节(达菲林,法国博福-益普生公司),4 周后行激素及B 超确认雌二醇<50 ng/L,黄体生成素(LH)及卵泡刺激素(FSH)<5 mIU/mL,双卵巢无直径>10 mm 卵泡,子宫内膜厚度<5 mm,确认双侧卵巢至少1 个卵泡直径>0.4 mm 开始促性腺激素(Gn)启动,如未达到条件则推迟Gn时间。根据病人不同情况给予人绝经后促性腺激素(HMG)(丽珠公司)或联合应用重组FSH(r-FSH,果纳芬,德国默克雪兰诺)150~300 IU 启动,根据卵巢反应不同调整Gn 用量。当有1个优势卵泡直径≥18 mm或超过2个卵泡直径≥17 mm 时,停用Gn 并应用重组人绒促性素250 µg(rhcG,艾泽,德国默克雪兰诺)或尿促绒毛膜性腺激素(uhcG)6 000 IU扳机。
1.2.2取卵移植 扳机36~38 h 后行取卵术,术后予常规黄体支持,取卵后第3 天移植卵裂期胚胎或第5天移植囊胚。
1.2.3随访 移植后2周如血清人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)5 U/L,即确认为妊娠。移植后4周如超声观察到一个或多个孕囊即确诊为临床妊娠。着床率为孕囊数/总移植胚胎数×100%。孕12 周内自然流产(生化妊娠除外)确认为早期流产。
1.3 统计学方法所有数据均采用SPSS 22.0 软件进行统计学分析。正态分布的计量资料以±s表示,组间采用单因素方差分析进行比较。非正态分布的计量资料采用中位数(第25、75 百分位数),即M(P25,P75)表示,组间采用Kruskal-WallisH检验。计数资料以百分比或率表示,组间采用Pearsonχ2检验或Fisher 确切概率法进行比较。logistic 回归分析各因素与临床妊娠率的关系,单因素回归变量筛选采用enter法,多因素回归变量筛选采用逐步回归法。P<0.05为差异有统计学意义。
2 结果
2.1 DOR病人各组临床基本特征比较A1组年龄显著低于A2 组,B1 组年龄显著低于B2 组,B1 组基础雌二醇显著高于B2 及B3 组,余指标均差异无统计学意义。详见表1。

表1 卵巢储备下降(DOR)病人各组临床基本特征比较
2.2 DOR 病人各组临床处理及结局的组间比较(1)超促排卵情况:A1组Gn启动量及Gn总量显著低于A2及A3组,A1组Gn启动时间显著多于A2组,A3组HCG日雌二醇水平显著低于A1及A2组,B3组Gn总量显著高于B2组,A1组及A2组HCG 日雌二醇水平显著高于A3组,余指标均差异无统计学意义。(2)实验室情况:A2组成熟卵数、可利用胚胎数及优质胚胎数显著高于A1 组,B1 组可利用胚胎数显著少于B2组及B3组,余指标均差异无统计学意义。(3)临床妊娠: A组各亚组间临床妊娠率差异无统计学意义。B1组临床妊娠率显著低于B3组。见表2。
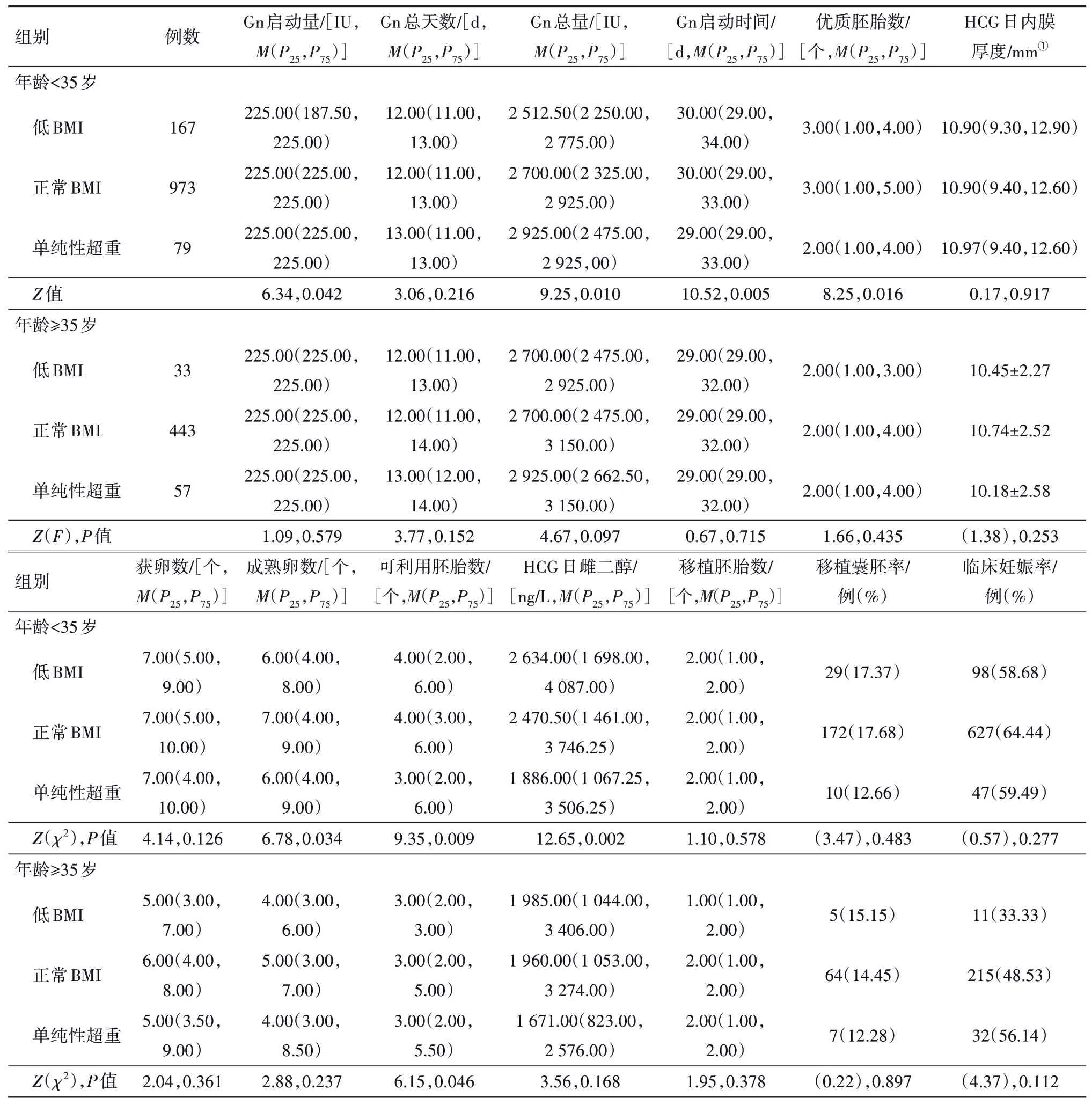
表2 卵巢储备下降(DOR)病人各组临床处理及结局的组间比较
2.3 logistic 回归分析将可能影响DOR 病人临床妊娠率的各因素——年龄、BMI、AFC、基础雌二醇、基础FSH、基础LH、睾酮、AFC、Gn总量、Gn天数、Gn启动剂量、Gn 启动时间、HCG 日内膜厚度、获卵数、成熟卵数、可利用胚胎数、优质胚胎数、移植胚胎数、移植囊胚率纳入回归模型,进行logistic 单因素回归分析。以P<0.10 为标准将各因素纳入回归模型,进行logistic 多因素回归分析。校正混杂因素后,BMI 对<35 岁DOR 病人临床妊娠率的影响差异无统计学意义(P>0.05),对≥35 岁DOR 病人临床妊娠率的影响差异有统计学意义(P<0.05)。≥35 岁DOR 病人单纯超重组的临床妊娠率显著高于低BMI组,OR 95%CI:1.13(1.04,1.24)。见表3,4。
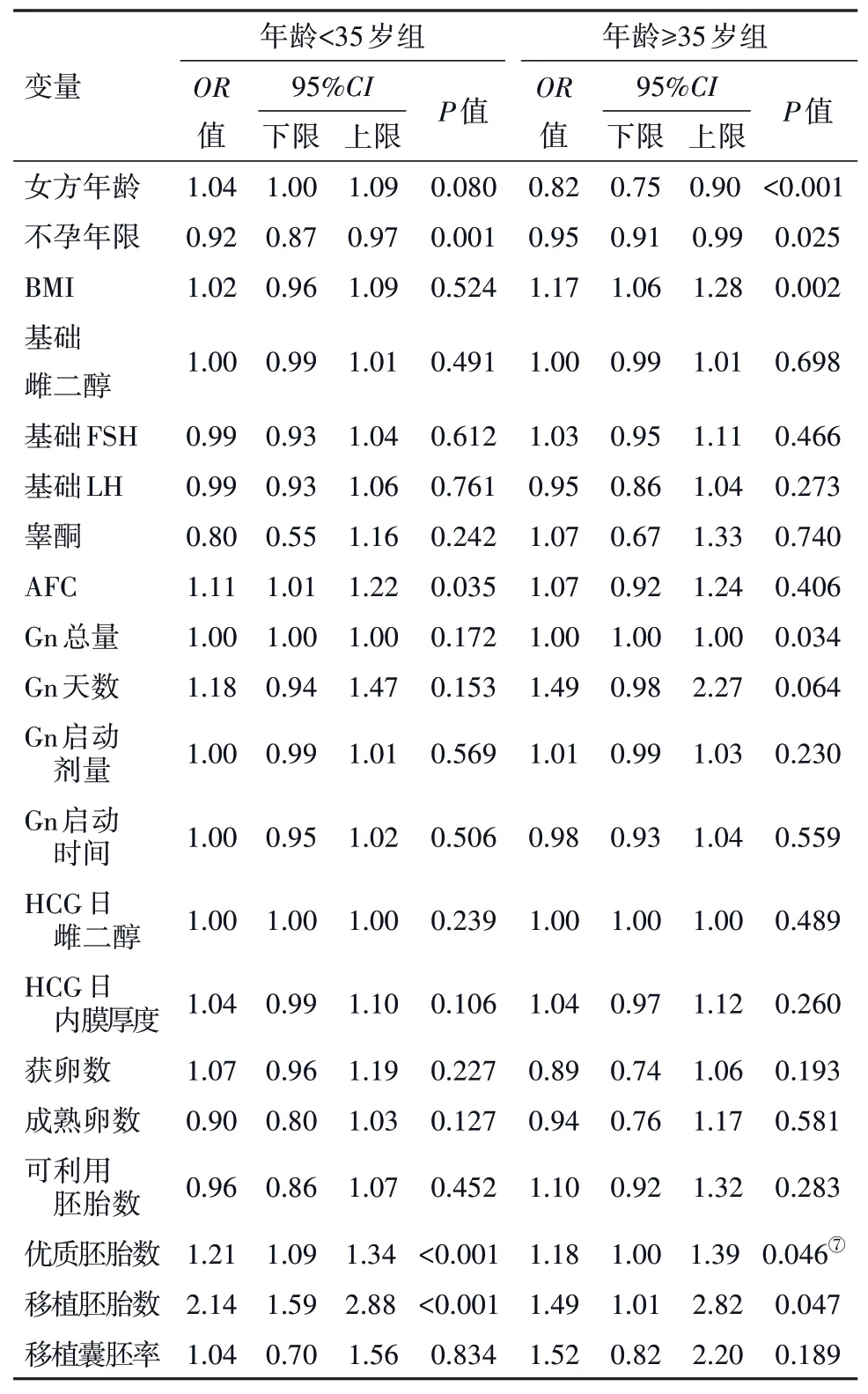
表3 卵巢储备下降(DOR)病人1 752例临床妊娠率相关影响因素的logistic单因素回归分析
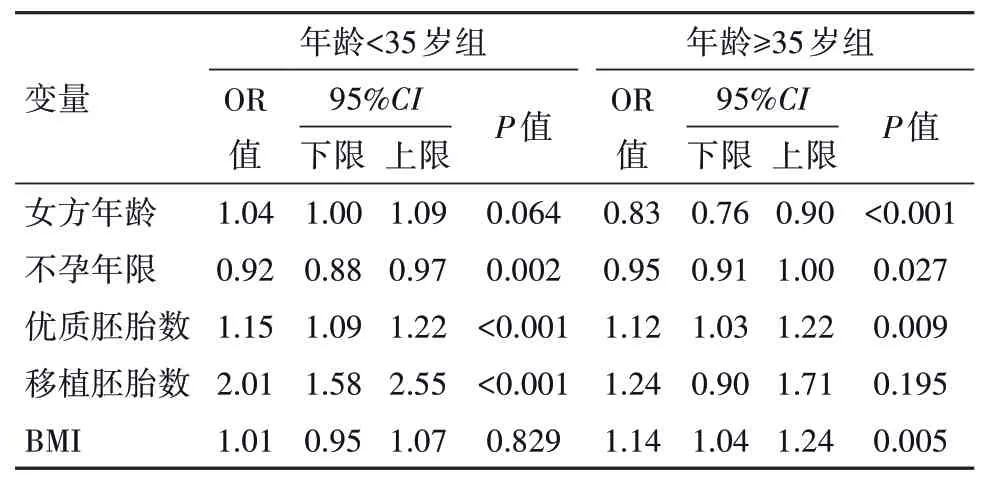
表4 卵巢储备下降(DOR)病人1 752例临床妊娠率相关影响因素的logistic多因素回归分析
3 讨论
卵巢储备反映了卵巢内卵泡的总数,包括非生长卵泡及窦卵泡。流行病学调查显示,DOR 的发病率约为10%~26%[8]。随着年龄的增长,卵巢储备呈下降趋势,35 岁后更是急剧下滑[9]。DOR 病人的特点在于卵泡数目减少,卵子质量下降,且高龄病人居多。因此,相对于卵巢高储备及正常储备病人,DOR 病人更需要尽快实施辅助生殖技术。这意味着生殖医生需在卵巢功能每况愈下前尽快“抢收”,才可能获得更多优质卵子。
目前国内外亦逐渐重视BMI 对辅助生殖技术的影响,对于超重/肥胖是否影响IVF-ET 妊娠结局尚存在争议。多项研究中显示高BMI 可能导致不良的IVF/ICSI 结局[10-11]。Orvieto 等[12]认为,BMI>25会影响植入率,接受IVF 治疗的超重和肥胖妇女可获得的卵母细胞较少,相对于相同获卵数的正常BMI 妇女,植入失败和流产的风险更高。另外一些学者则认为,高BMI 并不影响IVF/ICSI 结局。Schliep 等[13]对721 对夫妻行IVF 的研究结果支持了BMI状况并不影响正在接受不孕症治疗的夫妇生育力的观点。但以上研究未对病人人群进行细致划分,未排除年龄、是否合并内分泌代谢疾病及卵巢储备等因素对妊娠结局的影响。对于单纯性超重DOR人群,与正常BMI 人群的妊娠结局相比是否有差异缺乏相关性报道,如需花费较长时间控制BMI,是否会因卵巢储备进一步下降反而无法获得理想的妊娠结局,这些都是临床所面对的棘手问题。
本研究限定人群为DOR 病人,且进行年龄分层,尽量排除混杂因素对结果的影响。在对于单纯性超重组的研究中发现,在DOR 病人中,单纯性超重病人的获卵数、成熟卵数、胚胎质量及临床妊娠率均与正常BMI 病人差异无统计学意义(P>0.05),这表明单纯性超重DOR 病人可获得与正常BMI 的DOR 病人相似的临床结局。尤其在年轻病人中,BMI 对临床结局无明显影响,这一点也在logistic 回归分析的结果中得到了证实,BMI 并不是影响年轻(<35 岁)单纯性超重病人临床妊娠率的独立因素。这可能与本研究排除了合并有内分泌代谢问题及排卵障碍的超重人群,且控制BMI<28 kg/m2,避免了内分泌紊乱对子宫内膜容受性、卵子质量及受精结果的影响有关[14-15]。但相对于正常BMI 的DOR 病人,全年龄段单纯性超重DOR病人Gn总量均显著增多,HCG日雌二醇水平却显著降低,这与一项对1 344例非多囊卵巢综合征病人的研究[16]结果一致。HCG日雌二醇水平往往反映的是卵巢对超促排卵药物的反应,这说明高BMI 的DOR 病人卵巢对Gn 的反应性差,需更大剂量Gn刺激。究其原因可能与超重人群体表面积较大,脂肪细胞比例高,进而影响Gn 进入体内的吸收途径及代谢速度有关[17]。故而,单纯性超重的DOR 病人仍需控制BMI,从而减少Gn 使用量,增加卵巢对Gn刺激敏感性,节省费用,并且能够减少妊娠期高血压、糖尿病等并发症的发生风险,但减重处理与助孕时机应根据不同年龄制定个体化方案。《中国超重/肥胖不孕不育病人体质量管理路径与流程专家共识》指出,年龄<35岁合并DOR的单纯性超重/肥胖病人,建议减重5%~10%;伴有以肥胖为基础的合并症,应纠正代谢指标至正常后助孕。年龄≥35 岁超重DOR 病人的获卵数、胚胎质量、着床率及临床妊娠率均显著低于年轻病人,助孕的干预手段应尽快实施。所以,年龄≥35 岁合并DOR 的单纯性超重/肥胖病人减重的同时进行助孕治疗;伴有以肥胖为基础的合并症,应纠正代谢指标至正常,减重的同时进行助孕治疗[18]。
超重/肥胖人群对IVF/ICSI 妊娠结局的影响已被广泛重视,但对于低BMI 病人的临床结局存在争议。马龙对于行单个鲜胚移植的1 784 例病人进行分析得出结论,低BMI 组获卵率显著高于正常BMI及超重肥胖组,而流产率及活产率差异无统计学意义[19]。而另一项回顾性分析首次进行垂体降调节长方案促排的IVF/ICSI 治疗的503 例周期不孕病人的研究中发现低BMI 不孕女性可对IVF-ET 治疗的临床妊娠率、活产率、流产率等妊娠结局造成负面影响[20]。但对于DOR 病人的临床结局如何仍鲜有报道,无法为临床决断提供理论依据。
一项包含了116 671 例女性的前瞻性对照研究显示BMI 与不孕发生风险之间呈U 型关联,BMI 过低或过高均与不孕相关[21]。本研究中亦发现,高龄低BMI 组DOR 病人的可利用胚胎数及优质胚胎数显著低于正常BMI 组,这与许月明等[22]对8 171 例病人行IVF/ICSI新鲜周期移植的回顾性分析结果基本一致。这可能与维持正常生殖系统运作的能量平衡有关,低BMI 女性往往摄入能量不足,导致能量失衡,影响卵子质量及胚胎质量[23]。另外,低BMI组年轻DOR 病人的Gn 启动时机较正常BMI 组更晚,可能是由于低BMI 人群体表面积小,药物浓度水平相对高,导致降调节后垂体抑制程度更深,从侧面提示该类人群了行改良长方案发生卵巢低反应的风险更高。在妊娠结局方面,研究显示低BMI组高龄DOR 病人的临床妊娠率显著低于单纯性超重组病人,差异有统计学意义(P<0.05)。低BMI 年轻DOR 病人妊娠率较正常BMI 组降低5.76%,但差异无统计学意义(P>0.05),与单纯性超重组妊娠率相似。排除混杂因素后,logistic 结果显示BMI 为影响高龄单纯性超重DOR 病人临床妊娠率的独立因素。≥35岁DOR病人单纯性超重组的临床妊娠率显著高于低BMI 组。一项针对4 798 例中国女性的回顾性分析亦指出,低BMI 与体外受精新鲜周期的负面预后相关,特别是对于高龄女性[24]。究其原因,可能与一种称作瘦素的脂肪激素相关,其已被证明可以控制能量稳态和食物摄入。动物和人类试验表明,瘦素将营养状况传递给中枢神经系统,并通过直接作用于卵巢和间接作用于中枢神经系统参与生殖功能的控制。BMI与年龄是影响瘦素分泌的独立因素,瘦素与BMI 呈正相关,与年龄呈负相关。因此,瘦素水平降低可能是导致高龄低BMI 病人临床结局不佳的因素[25]。故而在DOR 病人行IVF/IC‑SI 之前,亦应重视低BMI 人群,尤其是高龄病人,应制定合理化饮食,增加能量摄入,改善临床结局。
总之,单纯性超重DOR 病人不影响IVF/ICSI 临床结局,但Gn 用量大,费用增高。年轻病人应减重5%~10%后再行助孕,高龄病人建议减重同时助孕。低BMI 的DOR 病人尤其是高龄病人对IVF/ICSI 临床结局有负面作用,建议调整饮食结构,适当增重后再行助孕。

