高通量测序技术联合瞬态诱发性耳声发射技术在新生儿遗传性聋筛查中的应用价值研究
刘咏梅,冯会颖,殷美乐,李文,桑艳峰
耳聋是常见的单基因遗传病,也是常见的出生缺陷之一,我国新生儿耳聋的发生率约为1‰~3‰,高危新生儿听力障碍发生率则高达2%~4%,且高危新生儿发生迟发性听力损失的风险更高,每年约有3万重度听障新生儿出生[1-2]。因此尽早对新生儿开展听力筛查非常有必要。高通量测序(NGS)技术是近些年发展起来的新型DNA 测序技术,目前广泛应用于新生儿遗传性疾病的筛查中,但部分新生儿虽存在耳聋基因异常,但现阶段对声音反应较好,与筛查结果不符[3]。瞬态诱发性耳声发射(TEO‑AE)技术是目前国内外筛查新生儿耳聋的常用方法之一,具有测试简便、灵敏度高等优势,但单独采用TEOAE 对高危新生儿进行听力筛查时,仍然会丢失部分病儿有听力障碍的检查信息,造成漏诊[4-5]。基于此,本研究尝试探讨NGS技术联合TEOAE技术在新生儿遗传性聋筛查中的应用价值,报告如下。
1 资料与方法
1.1 一般资料采用整群随机抽样方法,根据纳入排除标准选取2018年1月至2020年10月承德市中心医院625例新生儿作为研究对象,男419例,女206例;分娩孕周(38.26±1.62)周,范围为35~42周;出生体质量(3.86±0.65)kg,范围为2.3~5.2 kg;剖宫产218例,顺产407例;新生儿轻度窒息52例,新生儿重度窒息18例,无新生儿窒息555例;有家族耳聋史20例。本研究获承德市中心医院伦理委员会批准[批号院科伦审(2017)伦审第(1162)号],所有新生儿近亲属均知晓本研究,已签署知情同意书。排除不愿参与筛查者。
1.2 方法所有新生儿均于出生后3~7 d 内采用NGS技术和TEOAE技术行新生儿耳聋筛查,并于出生后1个月、2个月采用TEOAE技术进行第1、2次复筛。
NGS 技术筛查方法:采集新生儿足跟血制成≥8 mm 的干血斑,于4 ℃保存,采用Mag Pure Blood DNA LQ Kit 提取干血斑中的模板基因组DNA,并利用Qubit 荧光计(赛默飞世尔科技)进行定量分析。采用引物-特异性标签序列进行多重PCR 技术构建DNA 文库并定量,利用OneTouch2 自动化乳液PCR仪扩增测序模板并使用ES磁珠纯化仪进行富集,采用BioelectronSeq 4000高通量测序仪(北京博奥生物有限公司)测序,共检测18个常见耳聋基因的共100个位点。采用Ion PI Hi-Q Sequencing 200Kit 试剂盒,检测操作严格按照说明书进行。
TEOAE技术筛查方法:先行外耳道检查,将新生儿外耳道分泌物、胎脂等清除,待新生儿睡着后进行检查,要求检查环境噪声<40 dB(A),采用Accu-Screen便携式耳声发射仪(丹麦MADSEN公司生产),参数设置:疏波短声刺激,脉宽80 µs,非线性给声测试频率1.5~4.5 KHZ,刺激强度70~84 dB最小声压级。将大小合适的耳塞置入外耳道,并与筛查仪探头连接,耳塞尖端小孔正对鼓膜,必要时放置于外耳道外1/3处,开始测试,筛查仪自动显示结果(PASS为通过,REFER为未通过),并分别于出生后1、2个月进行复筛。
听力诊断:NGS技术筛查和TEOAE技术复筛中有一种未通过者,需要在出生后3~6个月转诊至省级卫生行政部门指定的听力障碍诊治机构接受进一步诊断,新生儿重症监护病房婴儿出院前行自动听性脑干反应(AABR)筛查,未通过者直接转诊至听力障碍诊治机构。诊断流程:(1)病史采集;(2)耳鼻喉科检查;(3)听力测试,包括电生理、行为听力测试,主要为声导抗(含1 000 Hz探测音)、耳声发射(OAE)、听性脑干反应(ABR)及行为测听等疾病测试;(4)辅助检查,必要时进行相关影像学和实验室辅助检查。仪器分别为:诊断型听觉诱发电位仪(美国智听听觉诱发电位仪SmartEP M010000),诊断型耳声发射仪(美国智听耳声发射仪SmartOAE),诊断型声导抗仪(日本理音声导抗仪RS-H1),诊断型听力计(麦力声听力计AD104)。AABR 恒定强度35 dB 小样本听力级,测听标准:测听方法按照GB/T16403-1996 国家标准;测听设备校准按照JJG388-2001 国家标准;校准听力计标准零级按照GB4854-84 国家标准;测听环境按照GB/T16403、GB/T16296国家标准。明确诊断为永久性听力损失的病儿,须在6个月内开展科学干预和康复训练。
1.3 观察指标(1)统计NGS技术筛查结果。(2)新生儿≥2 个耳聋基因位点异常结果。(3)TEOAE 技术筛查、复筛结果。(4)听力诊断及NGS技术联合TEO‑AE技术筛查结果,两种筛查结果均为阳性判定为联合筛查阳性。(5)分析NGS 技术联合TEOAE 技术筛查新生儿遗传性聋的价值。
1.4 统计学方法数据处理采用SPSS 22.0 软件,计数资料以例数描述,筛查价值分析采用受试者操作特征(ROC)曲线,P<0.05为差异有统计学意义。
2 结果
2.1 NGS 技术筛查结果本组共纳入625 例新生儿,NGS 技术筛查检出38 例耳聋基因异常(未通过),耳聋基因异常率为6.08%(38/625),其中GJB2基因异常15 例(2.40%),SLC26A4 基因异常17 例(2.72%),GJB3 基因异常3 例(0.48%),MT-RNR1 基因异常1 例(0.16%),MT-CO1 基因异常1 例(0.16%),MT-TL1基因异常1例(0.16%);587例新生儿NGS技术筛查通过。见表1。
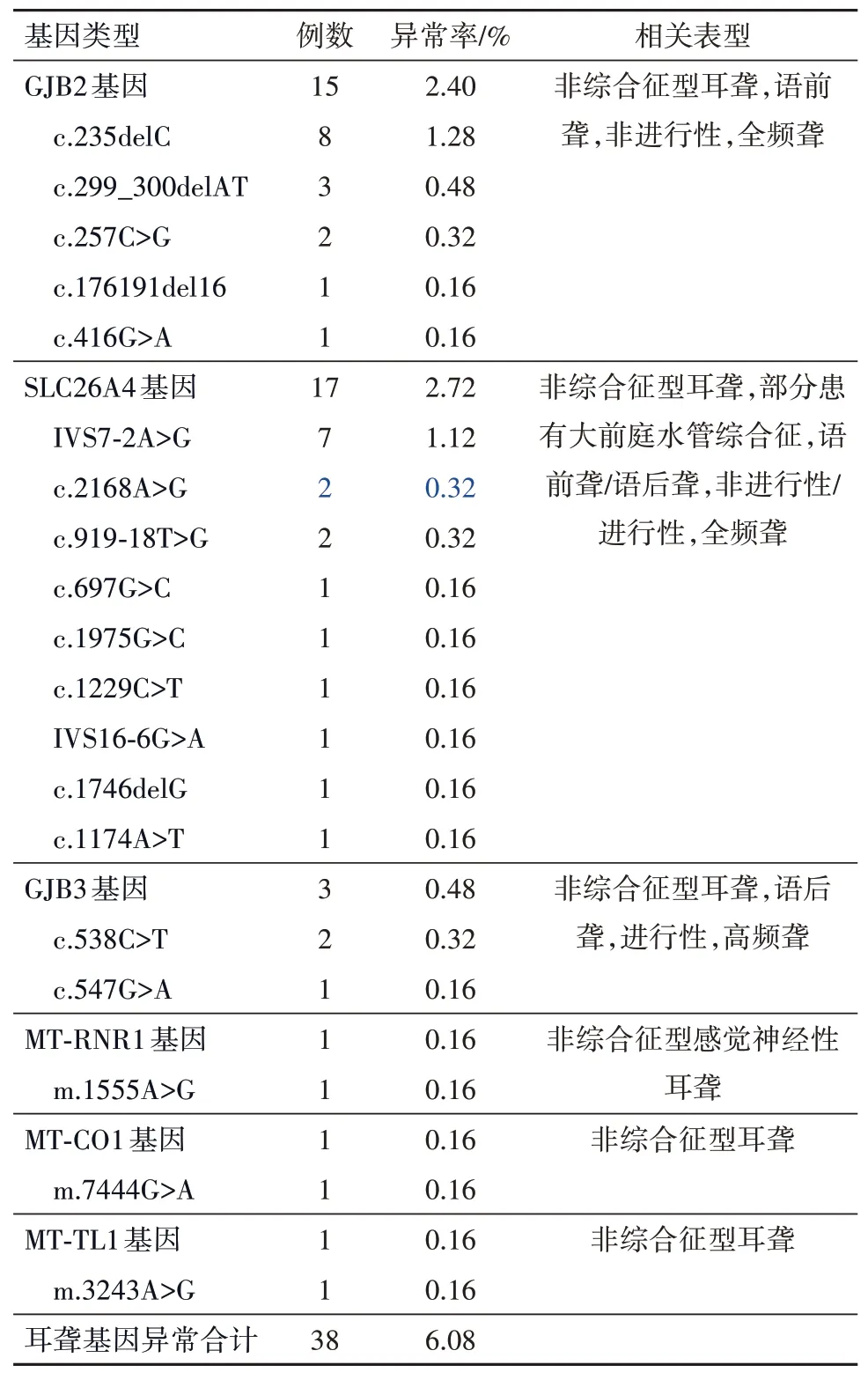
表1 新生儿NGS技术筛查结果(n=625)
2.2 新生儿≥2 个耳聋基因位点异常结果NGS技术筛查检出的38 例耳聋基因异常新生儿中,共有5 例存在≥2 个耳聋基因位点异常,占比0.80%(5/625)。见表2。
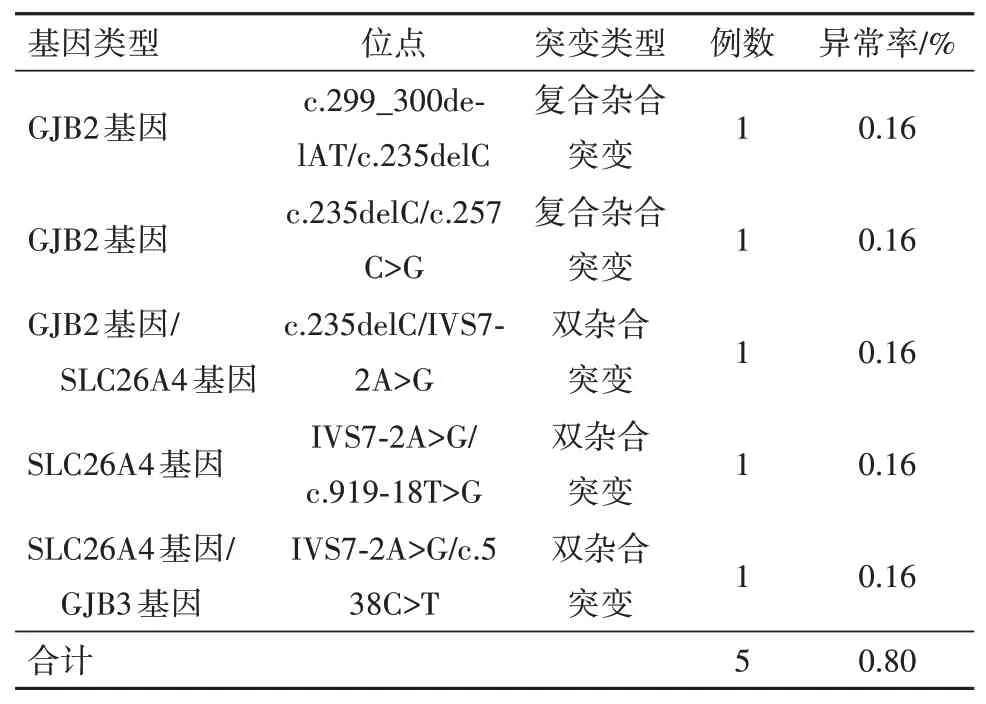
表2 新生儿≥2个耳聋基因位点异常结果(n=625)
2.3 TEOAE 技术筛查结果本组共纳入625 例新生儿,TEOAE 技术初筛有53 例未通过,占比8.48%(53/625),第1 次复筛有40 例未通过,占比6.40%(40/625),第2 次复筛有32 例未通过,占比5.12%(32/625);TEOAE 技术第2 次复筛未通过的32 例新生儿中,18例未通过双耳检测,8例未通过单侧左耳检测,6例未通过单侧右耳检测。见表3。
2.4 听力诊断及NGS 技术联合TEOAE 技术筛查结果NGS 技术筛查38 例未通过,587 例通过;TEOAE 技术复筛32 例未通过,593 例通过;联合筛查25 例未通过,600 例通过;最终经听力诊断有23例确诊为遗传性聋,602例听力诊断。见表4。
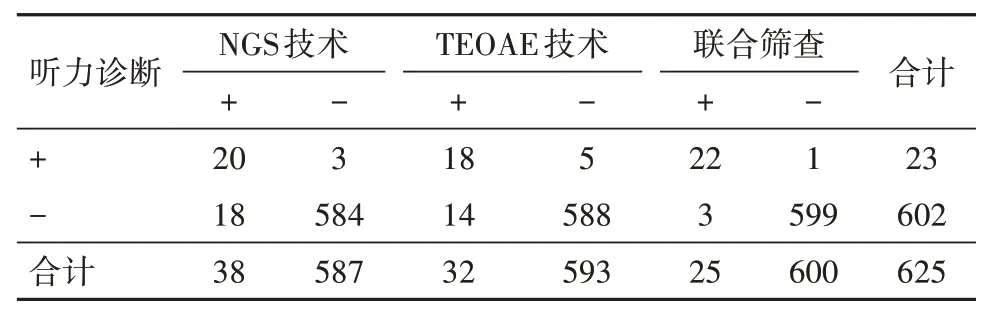
表4 听力诊断及NGS技术联合TEOAE技术筛查结果/例
2.5 NGS 技术联合TEOAE 技术筛查新生儿遗传性聋的价值以听力诊断确诊的23 例遗传性聋新生儿为阳性样本,602 例听力正常的新生儿为阴性样本,绘制ROC 曲线,结果显示,NGS 技术、TEOAE技术筛查新生儿遗传性聋的曲线下面积(AUC)分别为0.92、0.88,二者联合筛查的AUC为0.98。见表5。
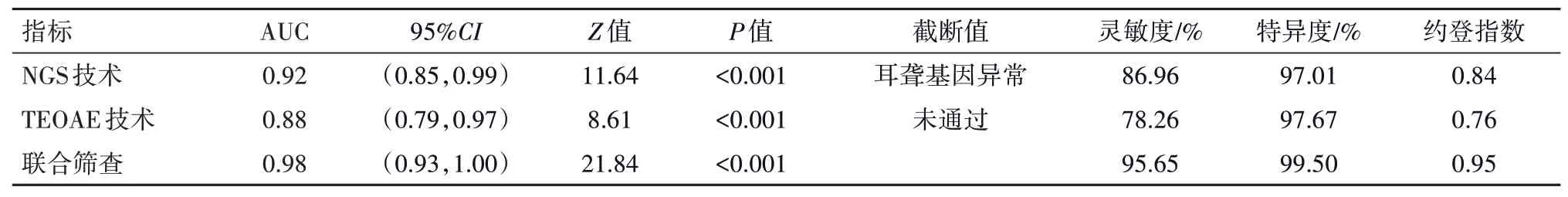
表5 NGS技术联合TEOAE技术筛查新生儿遗传性聋的价值
3 讨论
新生儿耳聋是导致儿童残障的重要原因之一,不仅严重影响新生儿的生长和发育,还会给家庭和社会带来沉重负担[6-7]。早期发现新生儿耳聋,尽早开展相关治疗和干预,对促进病儿健康成长发育具有重要作用[8]。
新生儿耳聋的发病与多种因素密切相关,包括遗传因素和环境因素,其中约60%的耳聋是由遗传因素造成[9]。国际上已鉴定出97 个非综合征型耳聋基因,共152 个相关位点,而临床研究常见耳聋基因以GJB2、SLC26A4、GJB3 等为主[10-11]。近年来,随着NGS 技术的发展应用,其能一次并行对几十万到几百万条DNA 分子进行序列测定,因此越来越多的研究者开始利用NGS 技术增加基因检测种类,以期尽早发现耳聋基因异常[12-13]。本研究通过NGS 技术对新生儿开展遗传性聋筛查,结果发现625 例新生儿中6.08%存在耳聋基因异常,与王雪超等[14]报道的6.67%相近,略高于阳彦等[15]报道的4.05%,造成此差异的原因可能与各地遗传背景、检测基因位点多等存在差异有关。耳聋基因异常新生儿中,2.40%为GJB2 基因异常,2.72%为SLC26A4 基因异常,GJB3 基因、MT-RNR1 基因等异常率相对较低,且少部分新生儿存在≥2 个耳聋基因位点异常,与国内多项研究[16-17]结果相近,提示国内新生儿耳聋基因异常情况存在一定相似性。而本研究中SLC26A4 基因(2.72%)异常率最高,这种差别可能与地域性差异、二代测序技术有关。但部分经NGS 技术筛查未通过的新生儿经听力诊断发现无明显听力损伤,后期随访对声音反应较好,这可能与随访时间较短有关,部分病儿哭可能发生了迟发性听力损失,短期随访并不能发现听力损伤,仍需延长随访进一步验证。也可能与NGS 技术筛查也存在一定假阳性率有关,如在新生儿重症监护室中,部分早产儿会因为器官系统不成熟,导致NGS 出现假阳性结果,随着早产儿器官系统逐渐成熟,随访复查时听力系统可表现为正常。由此可见,因此单独采用NGS 技术筛查仍存在一定误诊率。
TEOAE 技术也是耳聋筛查中广泛应用的方法,该技术以机械振动的形式起源于耳蜗,耳蜗受到外界短暂脉冲声(一般为短声或短音,时程在数毫秒以内)刺激后经听骨链及鼓膜传导释放入外耳道的音频能量,通过对其进行定量分析以发现听力损伤情况[18]。本研究中,TEOAE 技术初筛8.48%的新生儿未通过,而第1、2 次复筛未通过率分别为6.40%、5.12%,均有不同程度降低,表明仅采用TEOAE技术进行初筛并不能满足筛查需求,其原因可能在于TEOAE 技术初筛易受多种因素的影响,如新生儿哭闹、耳道内残留羊水、外耳道中残留胎脂或存在环境噪声,均会影响筛查结果,因此单次使用TEOAE筛选容易出现错误信息,进行复筛非常有必要[19]。此外,TEOAE 技术筛查法仅对耳蜗外毛细胞功能状态进行测定,若新生儿的听力损伤源于耳蜗后,其筛查结果则显示正常,导致漏诊[20]。表明单独采用TEOAE 技术对新生儿遗传性聋进行筛查也存在一定局限性。
本研究通过ROC 曲线分析发现NGS 技术联合TEOAE 技术在新生儿遗传性聋筛查方面具有一定价值,两种技术联合筛查的AUC 达到0.976,灵敏度、特异度分别为95.65%、99.50%,由此可见,NGS技术联合TEOAE 技术能有效提高新生儿遗传性聋筛查效能,有助于减少误诊漏诊,其原因在于联合筛查能够对单一筛查法进行有效补充,利于提高听力筛查结果的可靠性及准确性。
综上可知,新生儿遗传性聋筛查采用NGS 技术、TEOAE 技术,均能获得良好筛查结果,而二者联合能有效提高筛查效能,减少误诊漏诊,具有较高推广应用价值。但需要注意的是,对NGS 技术、TEOAE 技术筛查有一项未通过的新生儿仍有可能发展为耳聋,仍需定期随访和复查,两项均通过的新生儿仍有可能发生迟发性听力损失,仍需每3 年至少随访1次,但本研究随访时间较短,这是本研究的不足,未来工作中仍需进一步完善。

