灵芝总三萜低温提取工艺优化及其降血糖活性研究
何荣军,孙江亭,贺 丹,孙培龙
(浙江工业大学 食品科学与工程学院,浙江 杭州 310014)
灵芝(Ganodermalucidum),又称瑞草、林中灵、琼珍,是多孔菌科真菌灵芝的子实体[1]。《本草纲目》等书籍对灵芝有“补气、止咳”等功能的记载[2]。多糖类和三萜类化合物是灵芝中重要的活性成分,《中国药典》中以灵芝多糖的质量分数作为评价灵芝质量的标准,而在日本则以三萜酸的质量分数评价灵芝质量[3]。灵芝三萜类结构的复杂性和种类的多样性决定了其药理活性和生物活性的多样性,具有抗肿瘤活性[1]、抗炎活性[4-5]、抗氧化活性[6-7]、降血糖活性[8]和保肝活性[9-10]等特点。灵芝三萜的传统提取方法是乙醇热回流法[11],近年来兴起的超声辅助提取[12-13]和超临界CO2萃取[14-15]等工艺很大程度上解决了传统提取时间过长等问题,但仍在较高温度下进行提取,不利于三萜的活性保持。相较于其他提取方法,低温高速剪切提取能够在较低温度下实现对活性成分的提取,既有利于活性的保持,又降低了能源的消耗,在节能减排方面具有重大意义。笔者基于单因素实验响应面优化灵芝三萜的低温高速剪切提取工艺,并比较了体外降血糖活性的差异,为低温高速剪切技术在活性成分提取领域的应用提供依据。
1 材料与方法
1.1 原 料
赤芝子实体颗粒,浙江科达生物科技有限公司赠送。
1.2 试剂与仪器
香草醛(AR,99.0%)、α-葡萄糖苷酶(BR,50 U/mg)、对硝基苯基-α-D-吡喃葡萄糖苷(BR,99%),麦克林生物科技有限公司;无水乙醇(AR),上海凌峰化学试剂有限公司;熊果酸标准品(AR,>98.0%)、阿卡波糖(BR,95%),上海源叶生物科技有限公司;高氯酸(AR)、石油醚(AR,60~90 ℃)、三氯甲烷(AR),国药集团化学试剂有限公司;碳酸氢钠(AR,≥99.8%)、冰乙酸(AR,99.5%)、磷酸二氢钠(AR,99.0%),罗恩化学有限公司;磷酸氢二钠(AR,98.0%),上海毕得医药科技股份有限公司;盐酸(AR),上海泰坦科技股份有限公司。
T18Digtal高速剪切机,德国仪器有限公司;752N紫外分光光度计,INESA有限公司;CR21N台式离心机,日本日立株式会社;R-1001VN旋转蒸发仪,郑州长城科工贸有限公司;ALpHA2-4LD冷冻干燥机,德国Christ公司;DG5033A酶联免疫测定仪,华东电子医疗装备有限公司。
1.3 实验方法
1.3.1 低温高速剪切提取灵芝总三萜工艺流程
称取5.0 g经中药粉碎机粉碎的灵芝粉末,过80目筛,按一定的料液比加入乙醇搅拌均匀,用高速剪切机以12 000 r/min的转速剪切,结束后将溶液转移至离心瓶以4 510×g的转速离心15 min,将上清液进行抽滤,残渣按上述步骤继续剪切提取,重复提取3次,合并提取液,于37 ℃下旋转蒸发浓缩后冷冻干燥即得灵芝总三萜粗提物。提取灵芝总三萜的工艺流程如图1所示。

图1 低温高速剪切提取灵芝总三萜工艺流程
1.3.2 灵芝总三萜得率的测定
参考江绍琳等[16]的方法并稍作修改,采用熊果酸作为标准品,用无水乙醇准确配制质量浓度为0.20 mg/mL的熊果酸标准品溶液,精确量取此标准品溶液0.00,0.10,0.15,0.20,0.25,0.30,0.35,0.40 mL分别置于10 mL试管中,用无水乙醇分别补充至1.00 mL,随后于100 ℃水浴上加热蒸干。每管中分别加入0.40 mL 5%的香草醛-冰乙酸溶液和1.00 mL高氯酸溶液后,于60 ℃水浴中加热15 min,冷却后再加入5.00 mL冰乙酸,摇匀后室温静置15 min,用紫外-可见分光光度计在550 nm波长下测定其吸光度,建立标准曲线以测定灵芝总三萜质量分数。按照图1得到的灵芝总三萜提取液用乙醇稀释到一定质量浓度后,按上述方法测定总三萜得率。计算式为

(1)
式中:D为根据标准曲线计算所得总三萜的质量浓度,μg/mL;N为稀释倍数;V为提取液体积,mL;M为灵芝质量,g。
1.3.3 单因素实验
基于前期预实验结果,提取时间、料液比和乙醇体积分数是最重要的影响因素,因此重点对这3个因素进行优化。精确称取过80目筛的灵芝子实体粉末5.0 g,按照料液比1∶25 g/mL与体积分数为95%的乙醇均匀混合,利用高速剪切技术提取2,4,6,8,10 min,主要考察提取时间对灵芝总三萜得率的影响。灵芝子实体粉末与体积分数为95%的乙醇按一定料液比均匀混合后提取6 min,主要考察料液比1∶20,1∶25,1∶30,1∶35,1∶40 g/mL对灵芝总三萜得率的影响。灵芝子实体粉末按照料液比1∶35 g/mL与体积分数为70%,75%,80%,85%,90%的乙醇分别混合后提取6 min,主要考察乙醇体积分数对灵芝总三萜得率的影响。
1.3.4 响应面设计实验
利用Box-Behnken原理设计实验,实验设计中的水平及编码如表1所示。采用Design-Expert V 10.0软件分析所得实验数据,优化低温高速剪切提取灵芝总三萜的工艺参数。

表1 响应面分析实验因素水平表
1.3.5 灵芝三萜降血糖活性分析
参考郝瑞霞[17]的方法采用碱溶酸沉法将GLEC分成酸性三萜(CA)和中性三萜(CN),按照南婷婷[11]优化后的乙醇热回流法提取灵芝总三萜(GLEH),同样将GLEH分成酸性三萜(HA)和中性三萜(HN),评价并比较以上样品的α-葡萄糖苷酶活性的抑制率。参考Pinto等[18]的方法并稍作修改。用纯水配制0.1 moL/L pH 6.9的PBS溶液、5 mmoL/L对硝基苯基-α-D-吡喃葡萄糖苷(pNPG)溶液和0.67 moL/L碳酸钠终止溶液,再用PBS溶液配制0.5 U/mL的α-葡萄糖苷酶溶液。用PBS溶液配制相应的样品溶液,以阿卡波糖为阳性对照。具体的测定体系组分和顺序如表2所示。
按照表2的顺序于96孔板中添加试剂并操作。加入终止液后于405 nm处测定吸光度A。计算式为
α-葡萄糖苷酶抑制率(%)=

(2)
式中:下标为组名,样品组包括阳性对照组。进而计算每个样品的IC50值。
2 结果与分析
2.1 灵芝总三萜质量分数标准曲线
以样品质量浓度X为横坐标,以测定的吸光度Y为纵坐标绘制总三萜标准曲线,具体如图2所示。所得标准品线性回归方程为Y=0.009 8X-0.067 9(R2=0.997 9)。
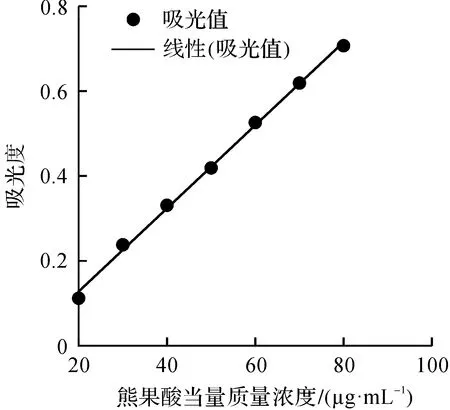
图2 总三萜标准曲线
2.2 单因素实验结果
2.2.1 提取时间对灵芝总三萜得率的影响
在料液比为1∶25 g/mL,乙醇体积分数为95%的实验条件下,考察提取时间2,4,6,8,10 min对灵芝总三萜得率的影响规律,结果如图3所示。随着提取时间增加,灵芝总三萜得率呈先上升后下降的趋势,提取时间为2~6 min,灵芝总三萜溶出量逐渐增加,在提取时间为6 min时得率达到最大值,此后再增加提取时间,灵芝总三萜的得率略有下降后趋于稳定,得率略有下降,其原因可能是随着提取时间的增加,溶液逐渐达到饱和状态,进而有一定程度析出,因此提取时间选择为6 min。
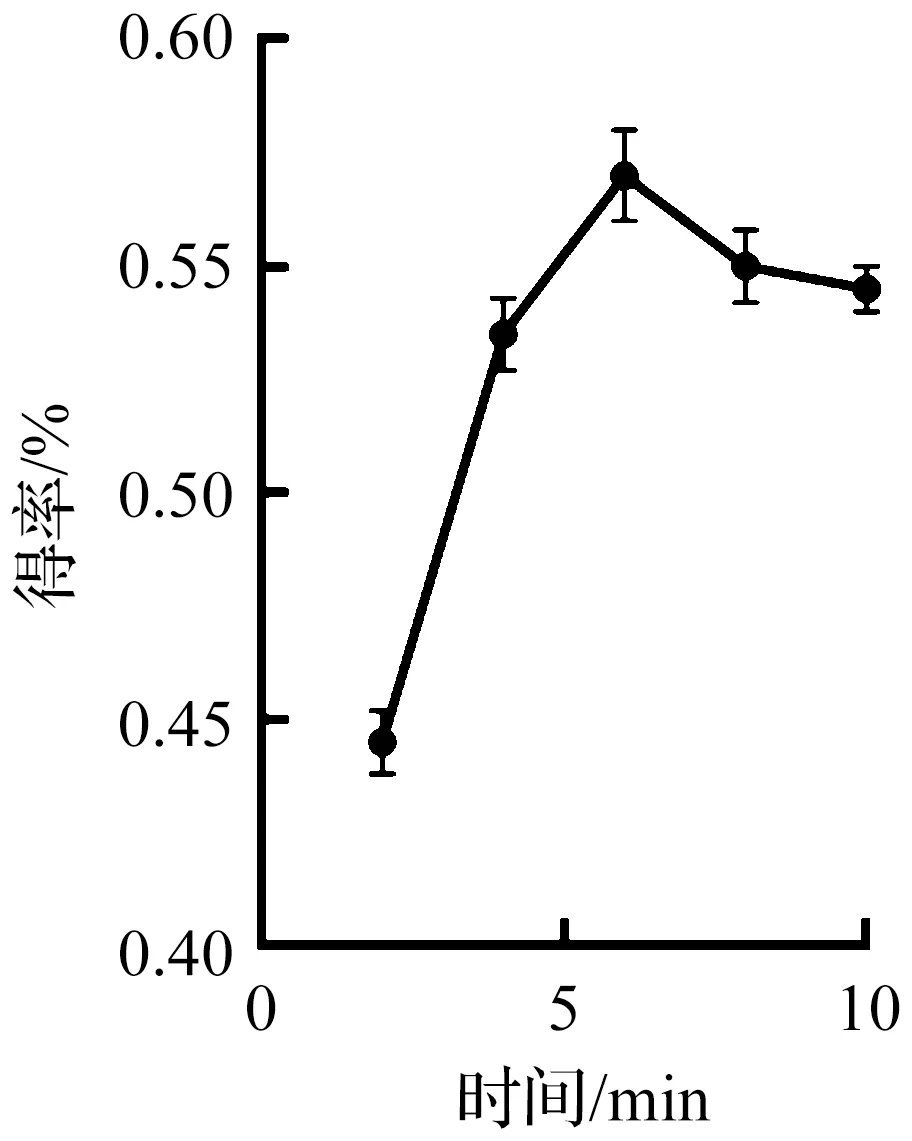
图3 提取时间对灵芝总三萜得率的影响
2.2.2 料液比对灵芝总三萜得率的影响
当提取时间为6 min,乙醇体积分数为95%时,考察不同料液比1∶20,1∶25,1∶30,1∶35,1∶40 g/mL对灵芝总三萜得率的影响规律,结果如图4所示。随着料液比从1∶20 g/mL到1∶35 g/mL,灵芝总三萜的得率出现逐渐上升的趋势,而且在料液比为1∶35 g/mL时得率呈现最大值,主要是由于提取溶剂用量的增加提高了原料与溶剂间的浓度差,有利于灵芝三萜向溶剂中扩散[19]。当料液比超过1∶35 g/mL时,大部分灵芝三萜已经渗出,灵芝总三萜的得率便不再增加,因此料液比选择为1∶35 g/mL。
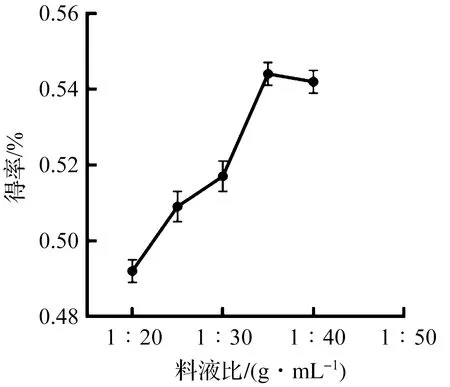
图4 料液比对灵芝总三萜得率的影响
2.2.3 乙醇体积分数对灵芝总三萜得率的影响
在提取时间为6 min,料液比为1∶35 g/mL的实验条件下,考察不同乙醇体积分数70%,75%,80%,85%,90%对灵芝总三萜得率的影响规律,结果如图5所示。随着乙醇体积分数的提高,灵芝总三萜的得率先上升后趋于稳定,乙醇体积分数从70%增加到85%,提取溶剂体积分数的提高使原料与溶剂充分接触,有利于灵芝三萜在溶剂中的溶解,因此灵芝总三萜得率逐渐升高,而且在乙醇体积分数为85%时得率呈现最大值,但乙醇体积分数超过85%后,溶剂的极性降低,一些醇溶性成分和极性较小的成分溶出,阻碍目标成分的溶出[19],灵芝总三萜得率趋于稳定,因此乙醇体积分数选择为85%。
2.3 响应面实验结果
2.3.1 Box-Behnken实验设计结果
以灵芝总三萜得率Y为响应值,共计进行17组实验研究,其中5组中心重复性实验,响应面实验方案设计方案及实验结果如表3所示。响应面设计回归方程各项残差分析结果如表4所示。由表4可知:回归模型显著性达到显著性水平,失拟不显著(P=0.252 9>0.05),说明该模型拟合度良好。复相关系数R2=0.965 4,说明所选因素能够反映响应值96.54%的变化。回归模型一次项A,B,C以及二次项A2,C2均有显著统计学差异,二次项B2有极显著统计学差异。所得方程:Y=0.56+0.027A+0.033B+0.031C-4.000E-0.003AB+0.014AC-0.018BC-0.039A2-0.074B2-0.043C2
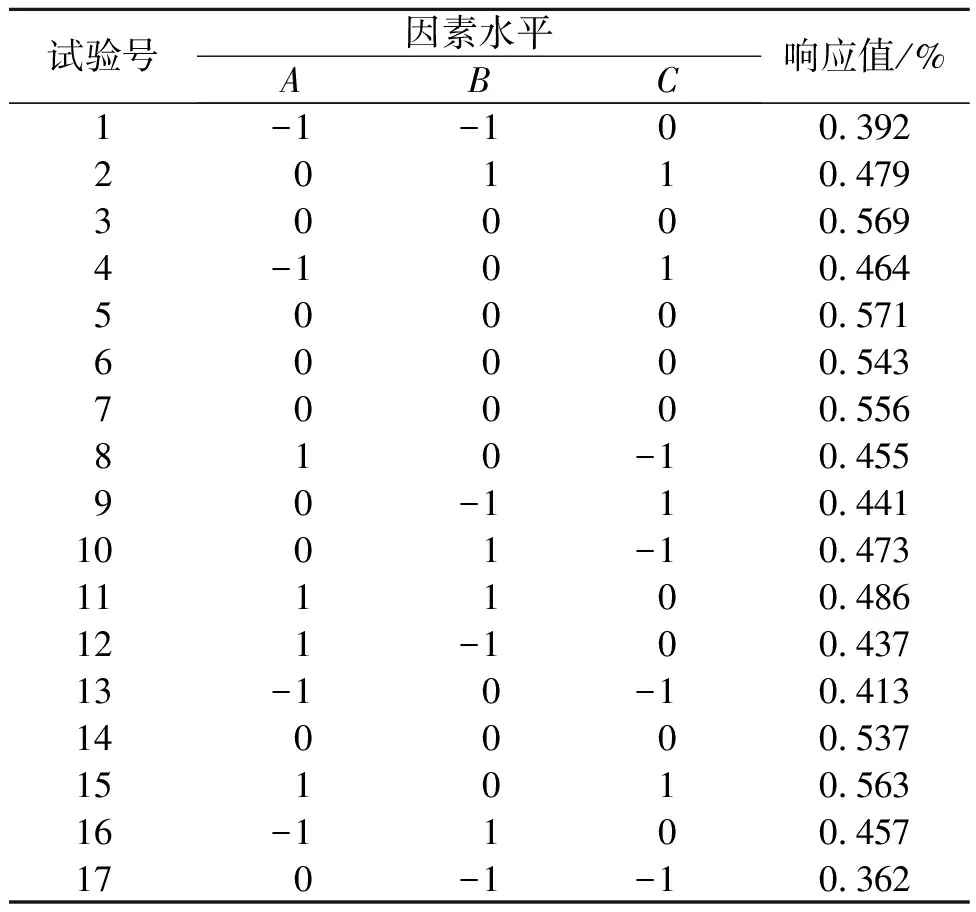
表3 响应面设计方案及实验结果
2.3.2 响应面分析
根据Design-expert V 10.0回归分析结果,分别得到低温剪切提取灵芝总三萜各因素间交互作用的响应面曲线图,如图6所示。3D曲面图上的倾斜率越大,表示两个因素相互作用越显著,平面图上颜色跨度越大,说明响应值变化越快。随着提取时间A、料液比B及乙醇体积分数C的增加,响应曲面图上的倾斜率均较大,表明总三萜得率有明显变化,说明这3个因素的交互作用对总三萜得率的影响较大。响应面上等高线的中心在-1~1时,表示提取灵芝总三萜的最佳工艺条件在设计因子水平范围内。运用Design-expert V 10.0对回归模型进行进一步解优化分析,得到灵芝总三萜最高得率的最佳工艺参数:提取时间4.824 min,料液比1∶28.726 g/mL,乙醇体积分数80.420%,灵芝总三萜得率达到0.569%。

图6 响应面试验的相互作用图
2.3.3 验证实验
工艺参数修正为提取时间6 min,料液比1∶30 g/mL,乙醇体积分数80%,做3组平行实验,所得总三萜得率的平均值为(0.54±0.05)%,与回归方程所得的总三萜得率0.569%相符,这说明回归方程能够真实地反映各因素的交互作用对灵芝总三萜得率的影响,因此用响应面法优化灵芝总三萜得率的回归模型可靠。
2.4 降血糖活性比较
灵芝酸性三萜,中性三萜以及总三萜的α-葡萄糖苷酶抑制活性如图7所示。
图7中:*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。由图7可知:随着剂量质量浓度的增加,样品对α-葡萄糖苷酶活性的抑制能力逐渐增加,因此,低温高速剪切提取法和传统乙醇热回流法提取的灵芝总三萜、中性三萜以及酸性三萜均显著抑制α-葡萄糖苷酶活性。在相同样品浓度下,只有CA对α-葡萄糖苷酶活性的抑制能力显著高于HA(P<0.05),这说明低温高速剪切技术能够保护酸性三萜中具有降血糖活性的组分不受破坏,显著提高酸性三萜的降血糖活性。
灵芝酸性三萜,中性三萜以及总三萜的半抑制浓度(IC50)如表5所示。由表5可知:降血糖能力由大到小排序为中性三萜>总三萜>酸性三萜>阿卡波糖(Acarbose),表明天然产物灵芝三萜的降血糖活性显著高于现行降血糖药物阿卡波糖(P<0.000 1)。

表5 灵芝酸性三萜,中性三萜以及总三萜的半抑制浓度(IC50)
3 结 论
以灵芝子实体为原料,以总三萜得率为评价指标,在单因素实验的基础上,通过响应面实验优化低温高速剪切法提取灵芝总三萜的最佳工艺参数:提取时间6 min、料液比1∶30 g/mL、乙醇体积分数80%,在此条件下总三萜得率为(0.54±0.05)%,与乙醇热回流法提取灵芝总三萜得率0.63%接近[11]。将GLEC,CA,CN与GLEH,HA,HN进行α-葡萄糖苷酶活性抑制能力的比较,实验结果表明:相较于乙醇热回流法,低温高速剪切法能显著提高酸性三萜的α-葡萄糖苷酶活性抑制率。因此,低温高速剪切技术能快速提取灵芝总三萜,显著提高酸性三萜的降血糖活性,灵芝总三萜得率接近传统提取法,为低温高速剪切技术在食品加工提取领域的应用提供参考。

