HPLC-MS/MS测定川金丝猴粪便中8种激素含量
张雪 孙悦 张超 娄熙源 罗怀英 文贵东 本智仁 陈双龙


摘要: 野生动物粪便中激素含量可以间接反映其营养状态,激素的检测已广泛应用于探究动物的生理机能以及繁殖状况。超高效液相色谱-串联质谱(HPLC-MS/MS)常用于类固醇激素的检测,是近年来野生动物激素检测的重要手段之一,该方法样品用量少,灵敏度高。2022 年6~7月在贵州省森林野生动物园,运用超高效液相色谱-串联质谱法测定了8只不同个体川金丝猴粪便中8种激素,比较了粪便中雌性以及雄性川金丝猴雌激素的差异。结果表明,甲状腺素 T3、睾酮激素在8只个体中均未检出。甲状腺素 T4、氢化可的松均部分检出。雌激素在8只个体中均检测出。8只个体粪便雌二醇浓度平均值为 109.24 ng/ml,雌三醇浓度平均值为63.192 ng/ml,雌酮浓度平均值为87.77 ng/ml。 雌激素浓度在雌性和雄性个体间不存在显著差异。研究工作可为后续川金丝猴的健康状况及选育提供参考。
关键词: 川金丝猴; 超高效液相色谱-串联质谱; 雌二醇
中图分类号: S 86; Q95 文献标识码: A 文章编号:1001 - 9499(2023)03 - 0045 - 05
川金丝猴(Rhinopithecus roxellana)属于灵长目 (Primates)猴科 (Cercopithecidae)疣猴亚科 (Colobinae) 仰鼻猴属(Rhinopithecus),是亚洲特有种,目前已被世界自然保护联盟(IUCN) 列入濒危物种红色名录濒危等级(EN), 在我国被列入国家一级重点保护野生动物名录[ 1 ]。是主产于我国的珍稀灵长类物种,因其稀有性以及重要的生态、科研、文化和观赏价值,列为国家级重点保护野生动物和公约附录物种。川金丝猴是典型的树栖动物,是我国华中和西南地区亚热带山地森林生态系统中最具代表性的物种之一[ 2 ]。对于川金丝猴生理状况的探究有助于推动川金丝猴的生态学、行为学、保护生物学以及驯养、繁殖、疾病和管理等方面的研究[ 3 - 6 ]。
皮质类激素、生殖类激素、甲状腺激素等内分泌激素作为评价指标回答有机体与生存和繁殖相关的问题[ 7 ]。雌激素主要包括雌二醇、雌三醇和雌酮化合物[ 8 , 9 ]。在雌性动物体内,雌激素与孕激素协同作用,共同维持着雌性动物生殖内分泌的平衡,在促进卵泡成熟、维持受精卵着床等发面发挥着重要作用[ 10 ]。非损伤性取样方法(Noninvasive Sampling)是指在不捕捉、低干扰动物正常活动,甚至见不到动物个体的情况下收集动物脱落的毛发、粪便、尿液,含口腔脱落细胞的食物残渣、鳞片以及卵壳等样品进行生物学研究的方法[ 11 , 12 ]。野生动物数量稀少,具有隐蔽性强、分布区偏僻、警觉性高等特点[ 13 - 15 ]。再者,对动物的麻醉、捕捉、绑定等过程对动物本身是一种剧烈的外界刺激,會使动物产生强烈的应激[ 16 ]。因此,在近年的动物保护生物学研究中,非损伤性方法得到了广泛的使用。通过采集尿液和粪便监测动物类固醇激素是目前最常用的非损伤采样方法[ 17 , 18 ]。同时,研究表明粪便类固醇激素与血液的研究结果存在一致性和直接对应关系[ 19 ]。
超高效液相色谱-串联质谱(HPLC-MS/MS)法具有灵敏度高、选择性强等优势,用于复杂样品分析检测,可省去分离纯化代谢物样品的繁琐步骤[ 20 ]。圈养川金丝猴生活的空间和环境受限制,且常与人类近距离接触,长期处于慢性应激状态。本研究运用HPLC-MS/MS对雌雄川金丝猴粪便8种激素水平测定,探究雌雄川金丝猴粪便中8种激素含量及川金丝猴雌性和雄性个体雌激素含量的差异性。结合生理指标更全面的评价川金丝猴的生存、健康以及繁殖状况等,旨在为圈养川金丝猴生理健康状况提供理论和实践依据。
1 研究方法
1. 1 研究地点与对象
研究地点为贵州省森林野生动物园,位于贵州省修文县扎佐镇林场冷水沟分场内,总占地面积约5 000余亩。野生动物园依托园区内缓坡、山坳、宽谷、石林等多种喀斯特地貌,按照不同动物的生态要求,因地制宜、合理布局。本研究的观察地点为灵长类展区川金丝猴笼舍。笼舍均由内、外两个笼舍组成,四面都是玻璃幕墙,顶部用铁网固定,以便透气通风。研究对象为8 只成年及幼年川金丝猴,包括2只雄性(Male,n=2)和6只雌性(Female,n=6)个体。
1. 2 粪便样品的采集与
2022 年6~7月在贵州省森林野生动物园内对川金丝猴进行观察,采集被观察个体的新鲜粪便。观察到其排便后立即由饲养员用一次性PE手套采集粪便样本。为了最大限度地减少环境污染,只收集粪便的内部部分作为样本。将所有新鲜粪便样本收集到40 ml无菌RNA管中。随后将样品储存在-80℃冰箱里,直到测试分析。
1. 3 超高效液相色谱-串联质谱(HPLC-MS/MS)测定粪便激素
1. 3. 1 试剂、耗材、标准品与实验仪器
准备实验试剂甲状腺素 T3、甲状腺素 T4、黄体酮(孕酮)、氢化可的松(糖皮质素)、睾酮、雌酮、雌二醇、雌三醇标准品(购自源叶生物)、色谱级甲醇、乙腈(购自德国默克)。主要实验仪器为TG-16G 台式高速离心机(湖南凯达科学仪器有限公司)、FA1204 电子天平(上海衡际科学仪器有限公司)、AGLIENT1260 高效液相色谱仪串联 6420A 质谱仪(安捷伦公司)。
1. 3. 2 样品提取方法
(1)取粪便样品 0.4 g,加入色谱级甲醇 5 ml,漩涡震荡 1 min;
(2)4 ℃,水浴超声 5 min,4 ℃,10 000 g 离心 1 min,取上清;
(3)沉淀再加入色谱级乙酸乙酯 ml,重新提取一次;
(4)4 ℃,10 000 g 离心 1 min,取上清液,合并两次上清;
(5)氮气吹干甲醇,以 0.2 ml PBS-BSA 重悬;
(6)过 0.22 μm 滤膜,进液质检测。
1. 3. 3 液质条件
色谱柱:Agilent ZORBAXSB-C18 反相色谱柱(2.1×150,3.5 μm);柱温:35℃;流动相:A:0.1%甲酸水;B:甲醇。流速:0.3 ml/min。进样体积:5 μl。动物激素的离子、解簇电压、碰撞能量等参数如表 1 所示,反应监测条件如表2 所示。
仪器所测得浓度为最终提取液的浓度,经计算获得原样品中激素浓度,计算方法如下: 样品中激素浓度(ng/g)=检测浓度(ng/ml)×稀释体积(ml)/称取质量(g)。其中稀释体积为样品最终溶解进样时所用的溶液体积,称取质量为提取时的取样质量。检测浓度由待测物质峰面积代入标准方程,由仪器自动求得。
1. 4 统计分析
运用 SPSS v.22.0(IBM corp., Armonk, NY, USA)统计软件分析数据,对于雌性和雄性的川金丝猴粪便激素浓度进行差异显著性比较,比较之前都通过单一样本 K-S 检验(one-sample Kolmogorov-Smirnov test)进行正态分布检验。对不同样品中测得的川金丝猴粪便激素浓度进行两个变量的Pearson 相关分析。
2 结果与分析
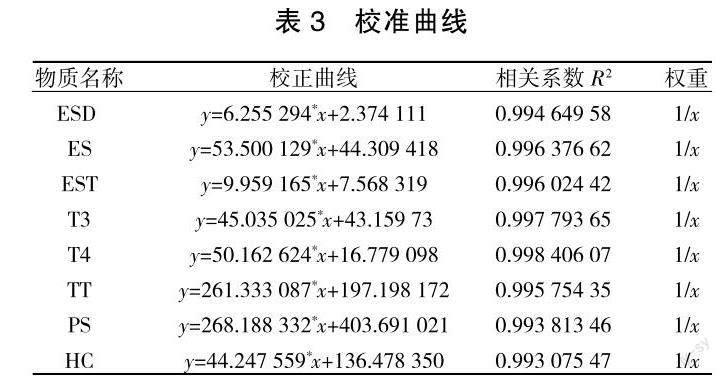
2. 1 线性范围
8种川金丝猴粪便激素的回归方程及相关系数如表3所示。检测浓度由待测物质峰面积代入标准方程。
2. 2 川金丝猴粪便激素水平
不同川金丝猴8个体粪便检测出的激素结果有差异(表4)。甲状腺素 T3、睾酮激素在8只个体中均未检出;甲状腺素 T4、氢化可的松均部分检出;三种雌激素在8只个体中均检测出。8只个体粪便雌二醇浓度平均值为 109.24(ng/ml),雌三醇浓度平均值为63.192(ng/ml),雌酮浓度平均值为87.77(ng/ml)。雌激素中以雌二醇的生物活性最高,选取雌二醇、雌三醇、雌酮浓度运用Spss16.0统计软件分析数据,对于雌性和雄性川金丝猴的雌酮、雌二醇、雌三醇激素浓度进行差异显著性比较,显著性水平设置为α=0.05。在t检验之前对数据进行方差齐性检验,差值95%置信区间。结果显示:雌酮、雌二醇、雌三醇激素浓度均满足方差齐性检验(P>0.05)。结果(表5)表明,雌酮浓度、雌二醇浓度、雌三醇浓度在雌性和雄性个体间不存在显著差异(P>0.05)。
3 讨 论
本研究结果与其他灵长类动物雌激素之间相关性研究结果相似,在短尾猴(Macaca thibetana)的研究中也显示雌性和雄性雌激素无显著差异[ 21 ]。研究发现甲状腺素、睾酮、氢化可的松在粪便中未检出,这可能是由于激素保存具有时效性,收集到的新鮮粪便如果不能及时提取处理或低温保存,常温下粪样内及外界的微生物会在短时间内分解其中的各种类固醇激素,导致测定结果的偏差[ 22 ]。在本次研究中由于贵州省野生动物园内川金丝猴个体数量有限,且采样季节较为单一,样品的连续性不高,无法确定雌二醇浓度峰值出现时期,在几个月内川金丝猴激素水平的变化趋势是未知的。由于川金丝猴排泄时间波动较大,川金丝猴种群受到食物供给、游客影响以及疾病和人为干扰等方面影响,可能给本研究结果的可信性带来一定的影响。圈养川金丝猴受到游客的影响导致其长期处于应激状态,在圈养保护时应尽量减少人为接触,多进行安抚[ 23 ]。粪便在川金丝猴体内停留时间较长[ 24 , 25 ],激素受肠道微生物和细菌的干扰,其浓度容易受到影响[ 26 ]。粪便中激素的浓度与动物的行为并不完全一致[ 27 ],因此有必要验证动物粪便和尿液中激素水平的相关性[ 28 , 29 ]。例如吼猴(Alouatta pigra)粪便通过肠道的时间一般为23~30 h,最长时间可以达到72 h[ 30 ],所以应用粪便类激素探讨动物行为等方面研究需要进一步研究。雌激素与繁殖期行为的相关性以及川金丝猴在生活史不同时期,如妊娠期、哺乳期等时期的性激素水平等还有待进一步的分析研究。
本研究及结果说明非损伤技术手段可以很好的应用到川金丝猴的生理状况研究中。利用非损伤的研究技术和HPLC-MS/MS测定技术应用于生理、免疫以及能量代谢等方面的影响更加具有保护生物学意义。本研究为川金丝猴体内激素在粪便,尿液或血液中的相互关系提供基础。粪便或者尿液中激素的检测分析,将为灵长类对环境的生理适应机制提供平台,对珍稀濒危灵长类保护具有重要的意义。利用非损伤研究方法实现了对野生动物生理激素水平的监测,一定意义上加速了内分泌学的发展。
致谢:感谢贵州森林野生动物园工作人员在采样期间对本研究的支持和帮助。感谢贵州省特色微生物资源开发应用平台对本研究的支持,特此致谢。
参考文献
[1] 王伟, 程铭昊, 赵思棋, 等. 不同环境条件下川金丝猴的皮质醇和Klotho激素水平变化[J]. 野生动物学报, 2023, 44(1): 179 - 184.
[2] Cai Y S, Yu H Y, Liu H, et al. Genome-wide screening of microsatellites in golden snub-nosed monkey(Rhinopithecus roxellana), for the development of a standardized genetic marker system[J]. Scientific Reports, 2020, 10(1): 10614.
[3] 王晓娟, 谌利民, 钟义, 等. 唐家河国家级自然保护区川金丝猴的种间关联和保护[J]. 野生动物学报.
[4] 阎彩娥, 蒋志刚, 李春旺, 等. 雌性川金丝猴的邀配行为与尿液雌二醇水平的关 系[J]. 动物学报,2003,49( 6 ): 736 - 741.
[5] 高云芳, 陈超, 李保国, 等. 川金丝猴尿液中睾酮水平的季节性变化[J]. 动物学报, 2003,49(3): 393 - 398.
[6] 高云芳, 高更更, 白绪祥, 等. 雌性川金丝猴尿液中雌二醇与孕酮水平的季节性变化[J]. 西北大学学报: 自然科学版,2005,35(5): 592 - 596.
[7] 傅文源. 虎粪便类固醇激素检测及影响因素的评估[J]. 野生动物学报, 2018, 39(2): 271 - 276.
[8] 王毅花, 陈丽霞, 马天, 等. 笼养黑颈鹤粪便性激素水平的时间动态[J]. 动物学杂志,2020, 55(3): 8.
[9] Whitten PL,Broekman DK,Stavisky RC.Reeent advances in nonin-
vasive techniques to monitor hormone-behavior interactions[J].American Journal of Physieal Anthropology, 1998, 41: 1 - 23.
[10] 陈玉燕, 张希贤, 赵明杰, 等. 圈养食蟹之行为模式与繁殖生理研究[J]. 台北动物园学报, 1996(8): 1 - 16.
[11] Taberlet P, Waits L P, Luikart G. Noninvasive genetic sampling: look before you leap[J], Trends in Ecology & Evolution, 1999, 14 (8): 323 - 327.
[12] 陳璐, 岳曦. 非损伤性取样研究进展[J]. 四川动物, 2007, 26(1): 224 - 226.
[13] 张树苗, 李夷平, 陈颀, 等. 北京南海子麋鹿苑春季麋鹿粪样皮质醇激素变化及其指示作用[J]. 野生动物学报, 2021, 42(2): 522 - 527.
[14] 卫泽珍, 崔媛媛. 内分泌学分析法在圈养野生动物研究中的应用简[J]. 野生动物学报, 2017, 38(3): 524 - 528.
[15] 周璨林, 宁礼群. 野生动物粪便研究进展[J]. 野生动物学报, 2015, 36(2): 232 - 239.
[16] SCHWARZENBERGER F. The many uses of non-invasive faecal steroid monitoring in zoo and wildlife species[J].Int Zoo Yearb,2007,41: 52 -74
[17] BONNEY R C, WOOD D J, KLEIMAN D G. Endocrine correlates of behavioural oestrus in the female giant panda (Ailuropoda melanoleuca) and associated hormonal changes in the male[J]. J Reprod Fertil, 1982, 64(1):209-215.
[18] LANE G A, FRASER K, CAO M, et al. Urinary biomarkers of forage feeding from ESI-MS/MS fingerprinting: exploratory studies [J]. New Zealand Society of Animal Production, 2006, 66:230-235.
[19] WASSER S K, RISLER L, STEINER R A. Exereted steroids in Primate feces over the menstrual cycle and Pregnancy[J]. Biology of ReProduction, 1988, 39(4): 862 - 872.
[20] ZHAO Y G, ZHOU L X, PAN S D, et al. Fast determination of 22 sulfonamides from chicken breast muscle using core-shell nanoring amino-functionalized superparamagnetic molecularly imprinted polymer followed by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2014,1345(1): 17 - 28.
[21] 李静宇.雌性短尾猴粪便性激素测定方法评估及其在生理周期研究中的应用[D]. 合肥: 安徽大学, 2020.
[22] 林若兰, 唐耀, 郑腾, 等. 不同保存温度对华南虎粪样生殖激素检测结果的影响[J]. 野生动物学报, 2014, 35(3): 5.
[23] 王炎, 王娟娟, 杨静, 等. 圈养与野生川金丝猴应激水平的比较研究[J]. 野生动物学报, 2023, 43(3): 623 - 628.
[24] 王英树, 田秀华, 张冬冬,等. 笼养丹顶鹤繁殖行为和粪样中性激素水平变化的关系[J]. 野生动物学报, 2014, 35(1): 69 - 74.
[25] PALME R, RETTENBACHER S, TOUMA C, et al. Stress Hormones in Mammals and Birds: Comparative Aspects Regarding Metabolism, Excretion, and Noninvasive Measurement in Fecal Samples[J]. Annals of the New York Academy of Sciences, 2005, 1040(1): 162 - 171.
[26] KIYOSHI, YAMAUCHI, SHIN-ICHIRO, et al. Application of Enzyme Immunoassay to Fecal Steroid Analysis in Sika Deer (Cervus nippon)[J]. Journal of Reproduction and Development, 1999, 45(6): 429 - 434.
[27] 楊梅, 刘永张. 生殖激素检测应用于国内动物园繁殖监测实践的可行性分析[J]. 野生动物学报, 2019, 40(1): 8.
[28] FUJITA S, MITSUNAGA F, SUGIURA H, et al. Measurement of urinary and fecal steroid metabolites during the ovarian cycle in captive and wild Japanese macaques, Macaca fuscata[J]. American Journal of Primatology, 2010, 53(4): 167 - 176.
[29] 沈洁娜, 李根新, 张强, 等. 秦岭大熊猫繁殖期尿液中生殖激素变化规律的研究[J]. 野生动物学报, 2020, 41(4): 5.
[30] 陈浩春, 范鹏来, 姚辉, 等. 川金丝猴尿液类固醇激素的保存时效性[J]. 兽类学报, 2015, 35(3): 7.

