血清ACTN4对宫颈癌诊断及预后评价的价值
应菲菲
盐城市妇幼保健院检验科,江苏盐城 224000
据世界卫生组织关于全球恶性肿瘤的流行病学调查显示,宫颈癌的发病率居女性恶性肿瘤第二位,死亡率居第四位[1]。近年来,年轻女性尤其是35岁以下女性宫颈癌的发病率呈现明显的上升趋势,给患者的身心健康和家庭带来了沉重的负担[2]。尽管早期手术和辅助放化疗等多学科综合治疗方案的不断进步,但中晚期宫颈癌患者的总体生存率仍然很低[3]。如何提高患者的早期诊断率是改善患者生存预后的重要途径。血清标本是临床最易获得的第一手资料,有研究指出,恶性肿瘤组织可早期表达并释放多种靶向生物活性分子,外周血浓度往往与肿瘤组织表达量有较好的一致性[4-5]。因此,通过筛选血清灵敏度和特异度较高的生物标志物是肿瘤早期诊断的重要方法。
α-肌动蛋白(ACTN)是血影蛋白基因超家族中的重要一员,主要生物学功能是肌动蛋白的结合蛋白,通过与F板层肌动蛋白相互交联进而发挥维持细胞骨架的完整性和控制细胞运动的功能[6]。已知ACTN家族有4个成员,编号为ACTN 1~4,大量存在于人类和其他哺乳动物中。其中ACTN4由ACTN4基因编码,广泛表达于许多组织中,尤其是肾小球足细胞中[7]。前期研究发现,ACTN4异常表达参与了多种恶性肿瘤如乳腺癌、结直肠癌、肝癌、肺癌等的发生和发展[8-10]。免疫组化染色结果显示,宫颈癌患者肿瘤组织中ACTN4基因和蛋白的相对表达水平均明显升高,且与患者的生存预后有关[11]。体外细胞实验进一步证实,ACTN4高表达可以显著促进上皮细胞的凋亡,并向间质细胞转化,参与肿瘤的恶性生物学行为[12]。因此,笔者认为ACTN4可能是调控宫颈癌发生和发展的重要靶向分子。基于此,本研究进一步分析血清ACTN4在新发宫颈癌患者中的表达,以及对诊断宫颈癌和评估生存预后的应用价值。
1 资料与方法
1.1一般资料 选取2016年1月至2018年1月于本院就诊且首次病理检查确诊为宫颈癌的患者80例为宫颈癌组和宫颈上皮内瘤变(CIN)患者50例为CIN组。纳入标准:(1)年龄18~75岁;(2)符合宫颈癌和CIN的病理学诊断标准;(3)根据宫颈癌的治疗指南采取相应的手术、放化疗等方案治疗;(4)签署知情同意书,取得本院伦理委员会批准,临床和随访资料完整。排除标准:(1)既往有宫颈手术史、新辅助放化疗史;(2)其他部位原发恶性肿瘤,如乳腺癌;(3)术后不能遵医嘱完成规定疗程的放化疗,随意更改治疗方案;(4)严重肝、肾、心、肺等功能障碍。另选择同期入院进行体检的体检健康者60例为对照组。宫颈癌组年龄42~73岁,平均(53.4±8.9)岁;CIN组年龄43~72岁,平均(52.9±8.6)岁;对照组年龄40~71岁,平均(53.2±10.1)岁,各组年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1临床资料收集 收集宫颈癌患者的年龄、组织学类型(鳞状细胞癌和腺癌)、国际妇产科联盟(FIGO)分期、组织学分级(中高分化和低分化)、淋巴结转移、肿瘤最大径、宫颈浸润深度、切缘阳性和宫旁阳性等资料。宫颈癌分期采用2009年修订版FIGO分期系统进行,肿瘤最大径采用妇科医生进行盆腔检查时确定的肿瘤最大径。
1.2.2治疗方法 Ⅰa1期无淋巴管间隙浸润者可全子宫切除,Ⅰa1期有淋巴管间隙浸润者选择根治性子宫切除术+盆腔淋巴结切除术;Ⅰa2、Ⅰb1、Ⅰb2、Ⅱa1和Ⅱa2期选择根治性子宫切除术+盆腔淋巴结切除术,根据术后有无高危或者中危因素补充放化疗,≥Ⅱb期接受放疗或放化疗联合治疗。
1.2.3ACTN4检测 采用酶联免疫吸附试验(ELISA)检测受试者的外周血清ACTN4水平。宫颈癌和CIN患者于接受治疗前,对照组于清晨空腹采集肘静脉血5 mL至抗凝管中,室温下静置10 min,以1 500 r/min的速度离心15 min,然后将上清液储存在-80 ℃抗凝管中直到进一步使用。检测试剂购自中国江苏碧云天科技有限公司,所有样品的检测均严格按照制造商提供的说明书进行,并一式两份,结果取平均值。试剂批间和批内的变异度均小于15%,试剂的精确度为0.01 pg/mL。根据宫颈癌患者血清ACTN4水平的中位值(48.9 pg/mL)进行分组,分为高表达组和低表达组。
1.2.4随访预后 宫颈癌患者出院后定期接受电话或门诊随访,随访截止2021年1月,随访时间3~60个月,中位随访时间52个月。以总生存期(OS)为研究终点,定义为任何原因的死亡。如果截止2021年1月患者仍然存活,则记录OS为60个月。
2 结 果
2.1各组血清ACTN4水平比较 宫颈癌组血清ACTN4水平[(48.9±11.3)pg/mL]明显高于CIN组[(38.6±9.7)pg/mL]和对照组[(35.2±8.3)pg/mL],差异有统计学意义(P<0.001),但CIN组和对照组比较,差异无统计学意义(P>0.05)。见图1。
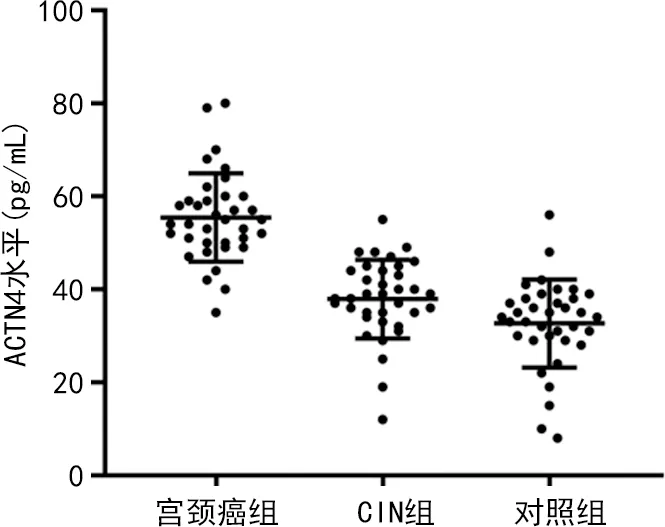
图1 各组血清ACTN4水平比较
2.2ACTN4诊断宫颈癌的效能 以血清ACTN4水平作为诊断指标,以宫颈癌为诊断结果纳入ROC曲线进行分析,结果显示,血清ACTN4诊断宫颈癌的曲线下面积(AUC)为0.856(95%CI0.798~0.902,P<0.001),灵敏度和特异度分别为85.6%和77.9%,见图2。

图2 ROC曲线分析ACTN4诊断宫颈癌的效能
2.3ACTN4表达与宫颈癌病理特征的关系 宫颈癌患者FIGO分期≥Ⅱb期比Ⅰa~<Ⅱb期、淋巴结转移阳性比阴性、宫颈浸润深度≥2/3比<2/3的ACTN4高表达率高,差异有统计学意义(P<0.05);其他临床特征之间ACTN4表达情况比较,差异无统计学意义(P>0.05)。见表1。
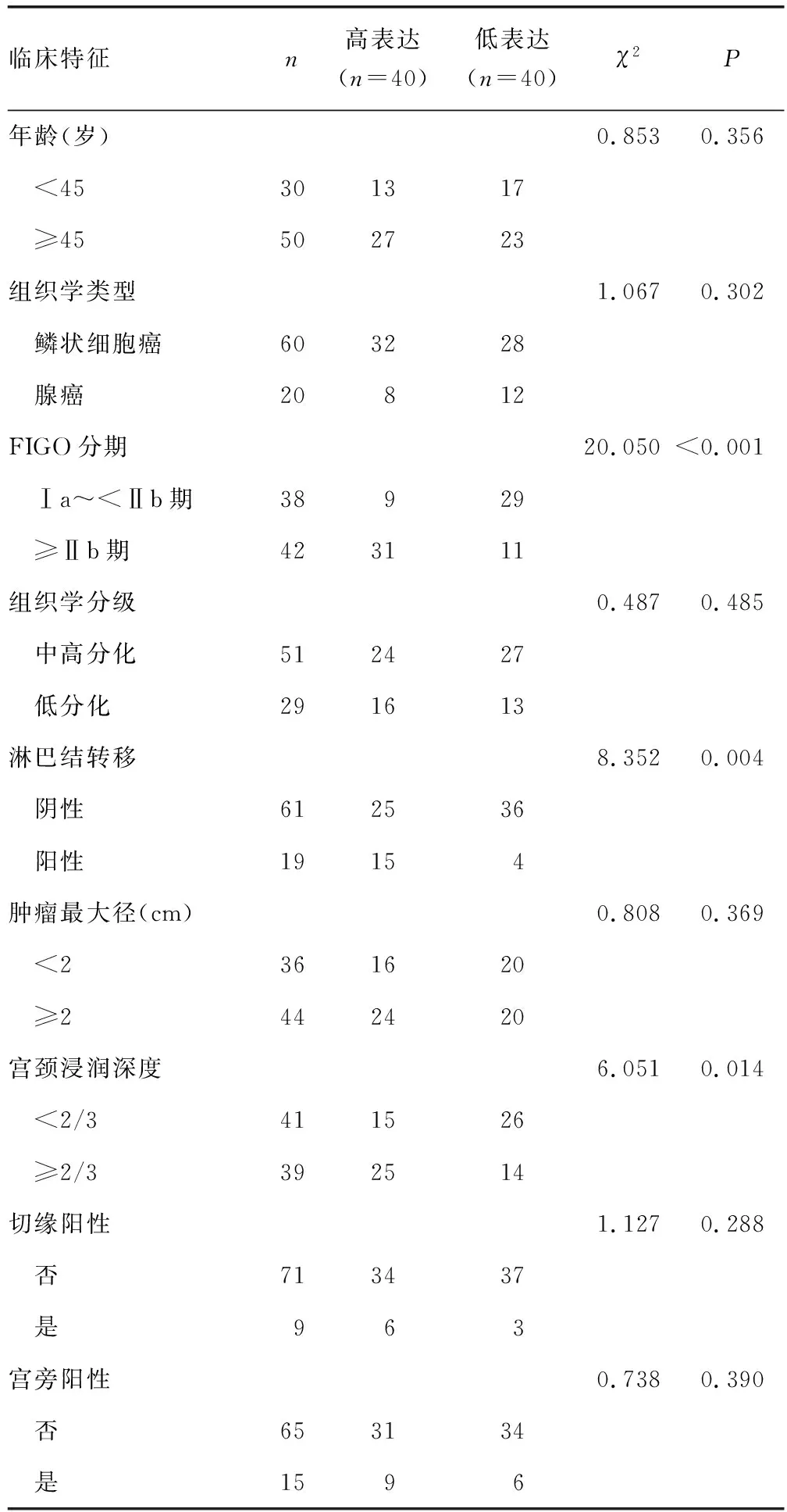
表1 ACTN4表达与宫颈癌病理特征的关系(n)
2.4ACTN4表达与累积生存率的关系 Kaplan-Meier生存曲线结果显示,ACTN4高表达患者的累积生存率明显低于ACTN4低表达患者,差异有统计学意义(42.6%vs.62.8%,χ2=8.625,P<0.001),见图3。

图3 ACTN4表达与累积生存率的关系
2.5OS的危险因素分析 将宫颈癌患者的年龄、组织学类型、FIGO分期、组织学分级、淋巴结转移、肿瘤最大径、宫颈浸润深度和ACTN4表达作为筛选指标,以OS作为结果,采用单因素Cox比例风险回归模型进行分析,差异有统计学意义的指标再采用多因素Cox比例风险回归模型进行分析。结果显示,FIGO分期≥Ⅱb期、淋巴结转移阳性、宫颈浸润深度≥2/3和ACTN4高表达均是影响OS的独立危险因素(P<0.05)。见表2、3。

表2 OS的单因素Cox比例风险回归模型分析结果

表3 OS的多因素Cox比例风险回归模型分析结果
3 讨 论
临床研究发现,宫颈癌是一种发病机制相对复杂,并且具有高度异质性的恶性肿瘤[13-14]。遗传和环境因素在宫颈癌的发展中起着重要作用。多个重要基因或蛋白的异常表达逐渐被发现和确定,其中ACTN4高表达可能与宫颈癌的发生和临床预后相关[15-16]。有研究显示,宫颈癌组血清ACTN4水平明显高于CIN组和对照组(P<0.05),CIN组和对照组比较差异不明显(P>0.05)[15-16],提示血清ACTN4异常高表达参与了宫颈癌的发生。CIN被认为是宫颈癌的癌前病变,但本研究结果显示CIN组与对照组ACTN4表达差异不明显(P>0.05),提示ACTN4可能仅在恶性宫颈组织内大量表达,侧面反映了肿瘤细胞的恶性程度,也为ACTN4作为宫颈癌早期诊断提供了重要理论依据。本研究进一步采用ROC曲线分析,结果显示血清ACTN4诊断宫颈癌的AUC为0.856(P<0.001),灵敏度和特异度分别为85.6%和77.9%;宫颈癌患者FIGO分期≥Ⅱb期比Ⅰa~<Ⅱb期、淋巴结转移阳性比阴性、宫颈浸润深度≥2/3比<2/3的ACTN4高表达率高,差异有统计学意义(P<0.05),提示ACTN4高表达与宫颈癌的多个恶性参数如FIGO分期、淋巴结转移和宫颈浸润深度有关;Kaplan-Meier生存曲线结果显示,ACTN4高表达患者的累积生存率明显低于ACTN4低表达患者(P<0.05),提示ACTN4高表达的宫颈癌患者预后较差;Cox回归分析结果显示,FIGO分期≥Ⅱb期、淋巴结转移阳性、宫颈浸润深度≥2/3和ACTN4高表达均是影响OS的独立危险因素(P<0.05),再次证实了ACTN4高表达是宫颈癌发生和发展的重要分子基础。
ACTN4的分子结构特点是N端有一个actin结合域,单体可以通过反向结合形成同型二聚体,形成哑铃状结构;功能上主要作为actin的结合蛋白,与增强细胞活力和肿瘤侵袭转移密切相关[17-18]。ACTN4高表达的癌细胞具有早期转移的潜能,因为ACTN4蛋白可以刺激肌动蛋白细胞骨架的动态重建[19-20]。研究表明,ACTN4在乳腺癌、胰腺癌、卵巢癌和肺癌中表达明显升高[21-22],与肺癌、胃癌的不良预后显著相关[23]。血清ACTN4水平已被认为是诊断多种恶性肿瘤的重要生物标志物。
综上所述,宫颈癌患者血清ACTN4高表达可能参与了疾病的发生和发展过程,有望成为疾病诊断和判断疾病预后的重要生物标志物。本研究的局限性包括:样本量较小、回顾性分析、单中心结果,下一步可以通过多中心、大样本的临床前瞻性试验进行验证;本研究仅观察了入院治疗前血清ACTN4表达与宫颈癌患者的关系,接受临床治疗后血清ACTN4表达是否发生动态变化还需要进一步检测;血清与肿瘤组织中ACTN4的表达需要建立一致性分析,进而提高血清检测的准确度。

