基于NLRP3信号通路探讨辛伐他汀抑制COPD大鼠肺组织细胞焦亡的作用研究*
张 俣,王丽萍,温春生,王海旭
新疆医科大学第五附属医院呼吸与危重症医学科, 新疆乌鲁木齐 830011
慢性阻塞性肺疾病(COPD)是一种常见的以持续气流受限为特征的肺部疾病[1]。目前COPD的常规治疗方法仅能达到控制患者症状、抑制病情进展的作用,无法彻底治愈[2]。细胞焦亡是一种新型的程序性细胞死亡,可诱发强烈的炎症反应,是COPD进展的重要因素[3-4]。辛伐他汀主要用于高胆固醇血症、冠心病的治疗,但随着临床研究的进展,有报道指出辛伐他汀可有效治疗COPD,降低炎症指标水平[5],同时也有研究发现辛伐他汀对COPD大鼠有良好的抗炎作用[6]。细胞焦亡常伴随核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)信号通路的激活,促进机体释放多种炎症因子,激活强烈的炎症反应[7];研究发现,NLRP3信号通路参与调控COPD发生发展过程中的细胞焦亡[8]。但辛伐他汀能否通过调控NLRP3信号通路调节COPD机体肺组织细胞焦亡的相关报道较少。鉴于此,本研究选取SD大鼠进行动物实验,探究辛伐他汀通过调控NLRP3信号通路调节COPD机体肺组织细胞焦亡的作用与机制。
1 材料与方法
1.1材料 40只SD大鼠,SPF级,雄性,体重(200±10)g。SD大鼠由新疆医科大学动物实验中心提供[许可证编号:SCXK(新)2020-0003],实验于新疆医科大学动物实验管理中心SPF级实验室进行。饲养条件:室温(23±3)℃,相对湿度40%~65%,光照周期12 h/12 h,自由进食、饮水。本研究经新疆医科大学动物实验管理中心伦理委员会批准(审批号:IACUC20200118-01)。
1.2仪器与试剂 脂多糖(LPS)、辛伐他汀购自美国SIGMA公司,批号L2630、S6196;NLRP3-siRNA质粒(正义链:5′-AUCUCUTGAACUAUUAUCAAC-3′;反义链:5′-CTUAUATCTCTAGGCUA-3′)、NC-siRNA质粒(正义链:5′-ATUCUAUTCGAUAGCTATATCUAC-3′;反义链:5′-CTUAUAGCUUAGAGGCUA-3′)委托深圳晶美生物工程公司合成;Lipofectamine 2000脂质体购自美国Invitrogen公司,批号PB1021;大鼠白细胞介素(IL)-1β酶联免疫吸附试验(ELISA)检测试剂盒、肿瘤坏死因子-α(TNF-α)ELISA检测试剂盒购自联科生物公司,批号EK301B、EK382;大鼠IL-18 ELISA检测试剂盒购自武汉华美公司,批号CSB-E04610r;免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司,批号SP9000;末端标记法(TUNEL)凋亡检测试剂盒购自武汉博士德公司,批号MK1020;大鼠NLRP3、半胱氨酸天冬氨酸蛋白水解酶-1(Caspase-1)、IL-1β、凋亡相关点样蛋白(ASC)、IL-18、TNF-α、β-肌动蛋白(β-actin)聚合酶链反应(PCR)引物由合肥知恩生物技术有限公司合成;兔抗大鼠NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α抗体购自美国BIOSS公司,批号bs-10021R、bs-0169R、bs-0812R、bs-6741R、bs-0529R、bs-10802R;TRIzolTM试剂盒(总RNA提取试剂盒)购自美国ABI公司,批号15596026。
PFTManeuvres型动物肺功能测量系统购自美国Buxco公司,烟熏箱购自上海玉研科学仪器有限公司,Neofuge 15R型离心机购自上海力申科学仪器有限公司,E200型光学显微镜购自尼康仪器(上海)有限公司,xMarkTM型酶标仪购自美国Bio-Rad公司,7500型PCR仪购自美国ABI公司。
1.3方法
1.3.1COPD大鼠模型建立及药物干预 将40只大鼠随机分成5组:对照组、COPD模型组、辛伐他汀药物组、NLPR3下调组和空载组,每组8只。
对照组大鼠分别于第15天和第30天通过气道灌输200 mL生理盐水,每天自由饮水摄食,不进行香烟烟熏。第1~14天、第16~29天和第31~59天于每天上午使用与药物等体积的生理盐水对大鼠灌胃(气道灌输生理盐水当天不灌胃)。
COPD模型组大鼠采用香烟烟熏方式[9]构建COPD模型,分别于第15天和第30天通过气道灌输200 mL LPS(1 mg/mL溶于生理盐水),轻轻摇摆大鼠20 s,确保注入的LPS在肺部分布均匀。第1~14天、第16~29天和第31~59天将大鼠置于烟熏箱内,暴露于均匀燃烧的12支去除滤嘴的香烟烟雾中(焦油量为12 mg,烟气烟碱量为1.1 mg,烟气CO量为14 mg),每天上、下午各1次,每次间隔约4 h,每次1 h。每天上午在烟熏前使用与药物等体积生理盐水灌胃(气道灌输LPS当天不烟熏、不灌胃)。
辛伐他汀药物组大鼠COPD模型建立方法同COPD模型组。第1~14天、第16~29天和第31~59天于每天上午烟熏前对该组大鼠使用辛伐他汀以5 mg/kg剂量灌胃(气道灌输LPS当天不烟熏、不灌胃)。
NLPR3下调组和空载组COPD模型建立方法同COPD模型组。第1~14天、第16~29天和第31~59天于每天上午烟熏前对大鼠分别经尾静脉注射NLPR3-siRNA转染重组载体、NC-siRNA转染重组载体(气道灌输LPS当天不烟熏、不注射)。
1.3.2肺功能测定 各组大鼠于第60天,运用动物肺功能测量系统检测动物肺功能,检测指标:呼吸频率(f)、吸气容积(TVb)、每分钟呼气量(MVb)、吸气峰流速(PIFb)、呼气峰流速(PEFb)、吸气时间(Ti)、呼气时间(Te)、呼气中流速(EF50)。
1.3.3标本收集 各组大鼠于第60天进行标本收集。肺泡灌洗液(BALF)标本:大鼠腹腔麻醉,固定,切开胸腹部,分离气管及肺脏,夹闭右主支气管,以3.0 mL的0.9%生理盐水缓慢灌洗左肺,抽出1.5 mL,反复灌洗3次,总共回收液体4.0~5.0 mL。收集的BALF在700×g(有效离心半径11 cm)离心10 min,上清液单独分装,-80 ℃保存。
血清标本:大鼠腹主动脉取血(尽量多抽),4 ℃,3 000 r/min(有效离心半径11 cm)离心10 min,取上清液(即血清)单独分装,-80 ℃保存。
右肺组织:大鼠麻醉处死后迅速摘取右肺中叶组织,分成2份,一部分直接固定保存于10%甲醛溶液中,另一部分直接冻存于-80 ℃冰箱。
1.3.4ELISA检测BALF上清液和血清中IL-1β、IL-18、TNF-α水平 取各组大鼠BALF上清液及血清标本,ELISA分别检测IL-1β、IL-18、TNF-α水平,检测方法按检测试剂盒说明书进行。
1.3.5苏木精-伊红(HE)染色观察大鼠肺组织病理改变 取各组大鼠固定于10%甲醛溶液的1/3右肺组织,石蜡包埋,常规切片(4 μm),脱蜡。染色过程:苏木精染色5 min后,分色2~3 s,反蓝2~3 min;伊红染色2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片后于光学显微镜下观察肺组织切片。
1.3.6TUNEL染色观察肺细胞凋亡 取各组大鼠固定于10%甲醛溶液的1/3右肺组织,石蜡包埋,常规切片(4 μm),TUNEL染色,具体操作按照检测试剂盒说明书进行。
1.3.7实时荧光定量PCR(qPCR)检测肺组织中NLRP3、ASC、Caspase-1、IL-1β、IL-18、TNF-α mRNA水平 取各组大鼠冻存的右肺组织,液氮包围研磨成粉,4 ℃,12 000 r/min(有效离心半径11 cm)离心15 min取上清液,加异丙醇-20 ℃静置1 min;4 ℃,12 000 r/min(有效离心半径11 cm)离心15 min,沉淀即为总RNA。采用核酸蛋白定量仪检测RNA浓度为1.8~2.1合格;反转录合成cDNA,反应条件为25 ℃反应10 min,85 ℃反应5 s。qPCR扩增反应:预变性95 ℃ 10 min;变性95 ℃ 15 s,40个循环;延伸60 ℃ 1 min。引物信息见表1。待测基因mRNA相对表达水平以2-ΔΔCt表示[10]。

表1 qPCR检测待测基因mRNA的引物信息表
1.3.8免疫组化检测肺组织中NLRP3、ASC、Caspase-1、IL-1β、IL-18、TNF-α蛋白水平 取各组大鼠固定于10%甲醛溶液的剩余右肺组织,石蜡包埋,常规切片(4 μm),按照免疫组化染色试剂盒操作说明检测各组大鼠右肺组织中NLRP3、ASC、Caspase-1、IL-1β、IL-18、TNF-α蛋白水平。
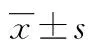
2 结 果
2.1各组大鼠肺功能比较 与对照组比较,COPD模型组、空载组大鼠f、TVb、MVb、PIFb、PEFb、EF50均升高(P<0.05),Ti、Te延长(P<0.05);与COPD模型组、空载组比较,辛伐他汀药物组、NLRP3下调组f、TVb、MVb、PIFb、PEFb、EF50均降低(P<0.05),Ti、Te缩短(P<0.05)。见表2。
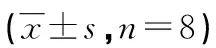
表2 各组大鼠肺功能比较
2.2各组大鼠BALF上清液和血清中IL-1β、IL-18、TNF-α水平比较 与对照组比较,COPD模型组、空载组大鼠BALF上清液和血清中IL-1β、IL-18、TNF-α水平升高(P<0.05);与COPD模型组、空载组比较,辛伐他汀药物组、NLRP3下调组大鼠BALF上清液和血清中IL-1β、IL-18、TNF-α水平降低(P<0.05)。见表3。
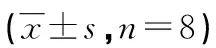
表3 各组大鼠BALF上清液和血清中IL-1β、IL-18、TNF-α水平比较
2.3HE染色观察大鼠肺组织病理改变 镜下观察,对照组大鼠肺组织大体结构正常,少部分支气管上皮细胞轻度增生,黏膜下少量慢性炎症细胞浸润;少部分肺泡壁增生、增厚,间质散在少量慢性炎症细胞浸润;少部分肺泡萎缩、变小。COPD模型组和空载组大鼠部分支气管黏膜纤毛柱状上皮增生,部分萎缩、脱落,平滑肌层及黏膜下层见大量慢性炎症细胞散在或灶状浸润,部分支气管管腔扩张;部分肺泡壁增厚,实变,间质较多慢性炎细胞浸润,部分肺泡壁萎缩,肺泡腔变小,部分肺泡壁断裂、扩张;部分支气管伴行血管扩张、充血;部分间质纤维肉芽组织增生。辛伐他汀药物组和NLRP3下调组大鼠支气管黏膜增生及破坏程度、周围炎症细胞浸润程度均稍减轻,肺泡壁增厚、萎缩及扩张程度未见明显改变。见图1。

注:A、B、C、D、E分别为对照组、COPD模型组、空载组、NLRP3下调组、辛伐他汀药物组大鼠肺组织HE染色图。图1 大鼠肺组织HE染色结果(×200)
2.4TUNEL染色观察大鼠肺组织细胞凋亡 与对照组比较,COPD模型组、空载组大鼠肺组织细胞凋亡率升高(P<0.05);与COPD模型组、空载组比较,辛伐他汀药物组和NLRP3下调组大鼠肺组织细胞凋亡率降低(P<0.05),见表4、图2。

注:A、B、C、D、E分别为对照组、COPD模型组、空载组、NLRP3下调组、辛伐他汀药物组大鼠肺组织凋亡图。图2 大鼠肺组织细胞凋亡(×200)
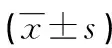
表4 各组凋亡率比较
2.5各组大鼠肺组织NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α mRNA水平比较 与对照组比较,COPD模型组、空载组NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α mRNA水平升高(P<0.05);与COPD模型组、空载组比较,辛伐他汀药物组、NLRP3下调组NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α mRNA水平降低(P<0.05)。见表5。
表5 各组大鼠肺组织NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α mRNA水平比较
2.6各组大鼠肺组织NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α蛋白免疫组化评分比较 与对照组比较,COPD模型组、空载组NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α蛋白免疫组化评分升高(P<0.05);与COPD模型组、空载组比较,辛伐他汀药物组、NLRP3下调组NLRP3、Caspase-1、ASC、IL-18、TNF-α蛋白免疫组化评分降低(P<0.05)。见表6。

表6 各组大鼠肺组织NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α蛋白免疫组化评分比较分, n=8)

续表6 各组大鼠肺组织NLRP3、Caspase-1、IL-1β、ASC、IL-18、TNF-α蛋白免疫组化评分比较分, n=8)
3 讨 论
吸烟是COPD的主要病因,烟草燃烧后释放大量有毒物质,可促进肺组织细胞焦亡,促进炎症细胞释放炎症因子,引起肺部炎症反应,造成肺组织损伤[11]。目前COPD的临床治疗主要为家庭氧疗、呼吸肌锻炼等康复型治疗和药物治疗,但只能达到缓解作用,无法根本性逆转病变,且目前临床并无特效药,因而仍需探索更加高效的药物。
本研究结果显示,COPD模型组和空载组大鼠肺组织平滑肌层及黏膜下层见大量慢性炎症细胞散在或灶状浸润,肺泡间质较多慢性炎症细胞浸润,与既往研究构建COPD模型一致[12],证实本研究模型构建成功。本研究结果表明,辛伐他汀可改善COPD大鼠肺功能,改善肺组织病理情况,抑制肺细胞凋亡,发挥抑制肺细胞焦亡的功能,且其作用与下调NLRP3表达的效果一致。细胞焦亡可诱导强炎症反应,有报道指出,辛伐他汀可抑制COPD小鼠炎症反应[13],推测辛伐他汀可能通过抑制炎症反应从而抑制肺细胞焦亡。
本研究结果表明,辛伐他汀可下调BALF上清液和血清中IL-1β、IL-18、TNF-α表达,抑制肺组织NLRP3、ASC、Caspase-1、IL-1β、IL-18、TNF-α表达,发挥抑制肺细胞焦亡的作用,与下调NLRP3表达的作用相当,推测辛伐他汀是通过抑制NLRP3从而抑制其下游分子表达、减轻炎症反应、减少肺细胞焦亡。细胞焦亡作为一种新的程序性细胞死亡,在其发生过程中常伴随NLRP3信号通路的激活,当NLRP3与COPD机体内激活炎症小体的信号分子结合后,促进NLRP3炎症小体形成,导致Caspase-1激活,活化Caspase-1促进IL-1β、IL-18、TNF-α释放,诱导细胞焦亡,引起强炎症反应[14-15]。RAO等[16]指出通过激活NLRP3信号通路,促进IL-1β、IL-18表达可促进COPD气道上皮细胞焦亡;MO等[17]指出,激活NLRP3信号通路,上调IL-1β、IL-18水平可诱导COPD气道上皮细胞焦亡;TIAN等[18]指出,通过抑制NLRP3炎症小体途径可改善香烟烟雾诱导的COPD大鼠肺炎症及细胞焦亡;李海霞[19]指出,通过抑制NLRP3信号通路,可降低COPD炎症水平,降低细胞焦亡作用。本研究结果与上述研究一致,提示辛伐他汀可能通过抑制NLRP3/Caspase-1/IL-1β信号通路,抑制ASC、IL-18、TNF-α表达,发挥抑制COPD肺组织细胞焦亡的作用。
综上所述,辛伐他汀可抑制COPD肺组织细胞焦亡,其机制可能是通过抑制NLRP3/Caspase-1/IL-1β信号通路,抑制ASC、IL-18和TNF-α表达实现的。

