恶性肿瘤患者PD-1治疗所致免疫相关不良事件的临床研究
计佩影,彭健,黄文璐,黄芳华,奚玉鸣,余自成
1.上海市杨浦区控江医院药剂科,上海 200090;
2.同济大学附属杨浦医院胃肠外科,上海 200090;
3.同济大学附属杨浦医院药学部,上海 200090
免疫检查点抑制剂(immune checkpoint inhibitors,ⅠCⅠs)以出色的抗肿瘤效果及安全性著称,是目前临床常见的恶性肿瘤免疫治疗方法[1-2]。近些年随着医疗技术的发展,程序性死亡受体1(programmed death receptor-1,PD-1)治疗的适应证范围不断扩展,研究发现其能够激活机体免疫系统攻击体内恶性肿瘤细胞,但弊端在于会对机体正常组织细胞和器官造成影响,进而导致免疫相关不良事件的发生[3-4]。PD-1治疗作用部位基本囊括全身器官,应用后会导致机体出现诸如免疫相关性心肌炎、肝炎、皮肤反应以及内分泌系统不良反应等[5-6]。若恶性肿瘤患者在PD-1治疗期间出现轻度免疫相关不良事件可经严密监测前提下继续使用PD-1 抑制剂进行治疗;但若处于中度至重度的免疫相关不良事件则有可能会对患者器官功能造成影响,严重影响患者生活质量,若未及时进行干预治疗甚至会导致生命健康受到威胁。因此患者在治疗期间若出现免疫相关不良事件需及早进行识别干预,确保患者机体安全的情况下最大程度发挥PD-1的治疗效果。本研究旨在探讨恶性肿瘤患者接受PD-1 治疗期间发生的免疫相关不良事件,并分析其与临床治疗效果及预后的关联性。
1 资料与方法
1.1 一般资料 回顾性分析2018 年6 月至2020年6 月于同济大学附属杨浦医院接受PD-1 单药或联合治疗的180 例恶性肿瘤患者的临床资料,根据其是否发生免疫相关不良事件,将其分为发生组99例和未发生组81例。纳入标准:(1)患者均确诊为恶性肿瘤,且不可行手术治疗;(2)于我院接受PD-1 单药或联合治疗;(3)完全配合随访调查,临床、随访资料完整。排除标准:(1)具有免疫治疗禁忌证;(2)具有免疫系统疾病;(3)临床、随访资料不完整;(4)出院后不配合随访调查。发生组患者中男性70 例,女性29 例;年龄32~86岁,平均(62.24±6.05)岁;肿瘤类型:呼吸道肿瘤34例、消化道肿瘤48例、泌尿系统肿瘤4例、恶性黑色素瘤2例、其他11例;治疗方案:单药治疗11例、联合治疗88例。未发生组患者中男性57 例,女性24 例;年龄32~85岁,平均(61.92±6.03)岁;肿瘤类型:呼吸道肿瘤24例、消化道肿瘤38 例、泌尿系统肿瘤2 例、恶性黑色素瘤5 例、其他12 例;治疗方案:单药治疗11 例、联合治疗70 例。两组患者的临床资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.2 治疗方法 22例患者予以PD-1单药治疗,静脉滴注信迪利单抗注射液[信达生物制药(苏州)有限公司,国药准字S20180016,10 mL:100 mg]3 mg/kg,滴注时间控制在0.5~1 h,3周为一个疗程,依据患者实际病情及免疫相关不良事件的发生情况予以调整;158 例患者予以PD-1 联合治疗,静脉滴注信迪利单抗注射液3 mg/kg,滴注时间控制在0.5~1 h,联合口服盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司,国药准字H20180004,12 mg×7粒),1粒/(次·d),3周为一个疗程,依据患者实际病情及免疫相关不良事件的发生情况予以调整。
1.3 观察指标与评价方法 (1)记录发生组患者PD-1治疗期间发生的免疫相关不良事件,依据常见不良反应事件评价标准CTCAE 5.0 版将其分为1~5 级;(2)比较两组患者的临床治疗效果,包括完全缓解(CR)、部分缓解(PR)、病情稳定(SD)及病情进展(PD),客观缓解率(ORR)=(CR+PR)/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)/总例数×100%;(3)比较两组患者的预后情况,包括无进展生存期(PFS)、总生存期(OS)及2年生存率。
1.4 统计学方法 应用SPSS19.0 统计学软件进行数据统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 发生组患者PD-1治疗期间发生的免疫相关不良事件 发生组患者PD-1治疗期间共发生138次免疫相关不良事件,其中17例患者发生20次等级≥3级的免疫相关不良事件;免疫相关不良事件发生率排前3位者分别为反应性皮肤毛细血管增生症(RCCEP)、甲状腺功能减退、皮疹/白癜风;等级≥3级的免疫相关不良事件发生率排前2位的分别为肝炎、心肌炎,见表1。
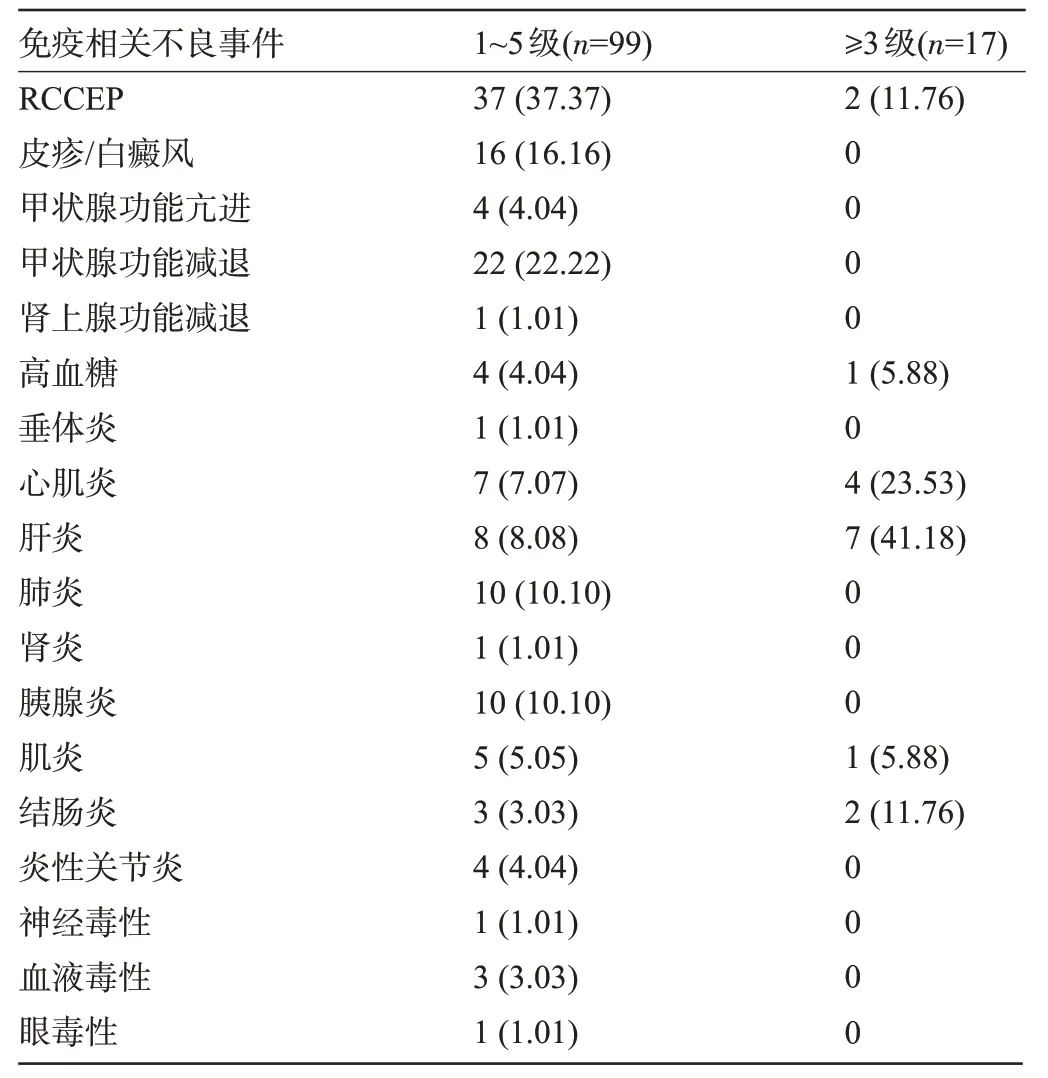
表1 发生组患者PD-1治疗期间发生的免疫相关不良事件[例(%)]Table 1 Immune-related adverse events during PD-1 treatment in patients in occurrence group[n(%)]
2.2 两组患者的临床治疗效果比较 发生组患者的ORR 及DCR 明显高于未发生组,差异均有统计学意义(P<0.05),见表2。

表2 两组患者的临床治疗效果比较[例(%)]Table 2 Comparison of clinical treatment effect between the two groups[n(%)]
2.3 两组患者的预后比较 发生组患者的PFS、OS 明显长于未发生组,2 年生存率明显高于未发生组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者的预后比较[±s,例(%)]Table 3 Comparison of prognosis between the two groups[±s,n(%)]
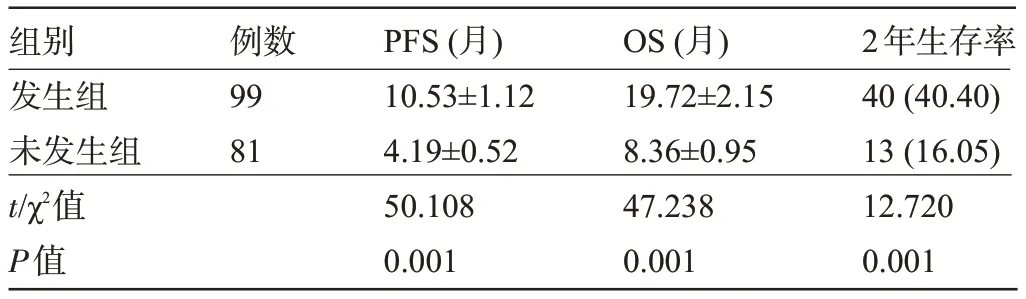
表3 两组患者的预后比较[±s,例(%)]Table 3 Comparison of prognosis between the two groups[±s,n(%)]
组别发生组未发生组t/χ2值P值例数99 81 PFS(月)10.53±1.12 4.19±0.52 50.108 0.001 OS(月)19.72±2.15 8.36±0.95 47.238 0.001 2年生存率40(40.40)13(16.05)12.720 0.001
3 讨论
近些年,随着医疗技术的发展与进步,免疫治疗在肿瘤患者治疗中的应用也越来越广泛。PD-1 抑制剂是阻断PD-1 的一种新型药物,能够激活机体免疫系统来抗击肿瘤,可用于癌症患者的治疗。在人体免疫系统或肿瘤微环境当中,应用PD-1 抑制剂能够有效阻断PD-1 与PD-L1 之间的相互关联,起到解除免疫系统抑制状态的作用,进而诱导抗肿瘤免疫反应[7]。近年来,因PD-1独特的作用机制及免疫相关不良事件受到较多关注,PD-1治疗存在一定弊端,其不仅作用于抗肿瘤,同时还会对机体正常组织产生影响,导致出现一系列免疫毒性反应,最终导致发生免疫相关不良事件[8]。与化疗相比,PD-1治疗期间免疫相关不良事件发生率更低,但因其导致的器官特异性免疫相关不良事件,如甲状腺功能减退、肺炎等发生率却明显上升。本研究显示,免疫相关不良事件发生率排前三的分别为:RCCEP、甲状腺功能减退、皮疹/白癜风;等级≥3 级的免疫相关不良事件发生率排前二者分别为肝炎、心肌炎。
经生物标志物检查显示,肿瘤患者有可能从ⅠCⅠs治疗中获益,针对预测ⅠCⅠs疗效标志物的研究多以肿瘤细胞及其微环境方面为主。目前,对于临床标志物的研究仍不够全面,考虑到应用PD-1治疗过程中所出现的免疫治疗相关毒性反应与药物抗肿瘤疗效之间的免疫学机制存在共同之处,近些年的多项回顾性及前瞻性临床研究多将免疫相关不良事件与PD-1抑制剂疗效之间的相关性作为研究重点,目前多数研究认为机体发生免疫相关不良事件可能是反映治疗效果和肿瘤患者预后的潜在标志物[9-10]。Freeman-Keller等[11]研究报道显示,恶性黑色素瘤患者在纳武利尤单抗治疗期间,发生免疫相关不良事件患者的OS 明显长于未发生免疫相关不良事件的患者。Eggermont 等[12]研究报道显示,恶性黑色素瘤患者较长的无复发生存期(RFS)与帕博利珠单抗治疗期间发生免疫相关不良事件有明确相关性。Schweizer等[13]研究报道显示,免疫相关不良事件的发生与非恶性黑色素瘤患者OS的显著改善有明确相关性,发生免疫相关不良事件患者的OS、PFS 明显长于未发生免疫相关不良事件的患者。Rogado等[14]研究报道显示,晚期泛癌种肿瘤患者在接受PD-1 治疗期间,发生免疫相关不良事件患者的ORR、PFS 明显高于和长于未发生免疫相关不良事件的患者,但OS未明显延长。针对这一情况,机体发生免疫相关不良事件是否准确反映肿瘤对免疫治疗的反应并能够转变为更佳生存结局仍需更多大样本数据研究加以证实。本研究回顾性分析于我院接受PD-1单药或联合治疗的180例恶性肿瘤患者的临床资料,结果显示相比未发生免疫相关不良事件的患者,发生免疫相关不良事件患者的ORR、DCR及2年生存率更高,PFS、OS 更长,说明PD-1 治疗期间免疫相关不良事件的发生有可能成为预测恶性肿瘤患者临床治疗效果及预后情况的标志物。机体会通过其自身反应性T 细胞、自身抗体和细胞因子的多种途径发生免疫相关不良事件,这通常被认为是活化T细胞的“旁观者效应”[15]。具体表现为患者机体经PD-1治疗时其体内细胞毒性T淋巴细胞功能的关键负向调节因子会被去除,随即针对肿瘤抗原发生特异性反应,肿瘤细胞于免疫应答效应中出现炎症反应和死亡,在这一过程中机体其他器官同样会出现相似炎症反应,表现为器官功能受损或临床指标异常[16]。
本研究结果提示,若机体发生免疫相关不良事件,则有可能是提示为更加良好的免疫治疗疗效及生存获益,患者发生轻度免疫相关不良事件应当优先考虑为患者继续进行应用PD-1 抑制剂,从而获得持久疗效,在持续治疗过程中应当严格管理治疗相关的不良事件,确保患者在治疗过程中最大程度提高治疗效果并获得更佳生存获益;若患者经治疗免疫相关不良事件≥3 级则需考虑为患者暂缓或永久停用免疫治疗药物。有报道显示,超过一半的转移性肾细胞癌患者因免疫相关不良事件而停药期间,其病情在至少6 个月时间内得到持续控制[17]。因此部分患者因免疫相关不良事件停药后一段时间内仍会取得病情有效控制,使得PFS 延长;但部分患者治疗过程中出现严重免疫相关不良事件,不仅治疗会中断或停止,其重要器官如心肝肺等受其影响可能会发生不可逆的功能损害,通常不会获得OS延长。
本次回顾性研究仍有一定局限性,可能存在临床资料上的选择、信息偏倚,没有被记录的轻度或短暂的免疫相关不良事件可能会对研究结果产生一定影响;且未深入研究患者不同肿瘤部位及治疗药物类型、剂量所导致的不同免疫相关不良事件发生率;另外对患者的跟踪随访时间有限,没有准确记录所有患者的总生存时间。
综上所述,恶性肿瘤患者接受PD-1治疗的效果及安全性较高,PD-1治疗期间发生的免疫相关不良事件与临床治疗效果及预后有一定关联性,发生免疫相关不良事件患者的治疗效果及预后情况更好,更利于预后。PD-1治疗期间免疫相关不良事件的发生有可能成为预测恶性肿瘤患者临床治疗效果及预后情况的标志物。

