FtsZ 靶向多肽抑制剂的分子对接、分子动力学分析及抗菌活性评价
刘良旺,臧彧伟,冉方芳,闵 义,王大勇,3
(1. 海南大学 药学院,海口,570228; 2. 海南大学 生命科学学院,海口 570228;3. 教育部热带生物资源重点实验室,海口 570228)
自从青霉素的发现和临床使用以来,抗生素拯救了许多人的生命,使人免于细菌感染。作为抑制细菌生长或杀死细菌的化合物,抗生素在较低浓度时就可以抑制微生物的生长或增殖[1]。20 世纪60 年代末,由于人们认为细菌感染不再构成威胁,新抗生素的开发速度放缓,因此,新抗生素的开发减少。如今,细菌耐药性问题已经成为人类健康安全重大危机,耐药型超级细菌的出现,使得抗生素效力大打折扣,且新发现的抗生素也越来越少,促使研发针对新的作用靶点、具有新作用机制的抗菌药物成为当务之急[2-3]。丝状温度敏感蛋白Z(Filament temperature-sensitive protein Z,FtsZ)是一种原核细菌分裂中不可或缺的分裂蛋白,在金黄色葡萄球菌、大肠杆菌、结核杆菌等细菌中广泛存在[4-5],且在体外和体内都能以依赖GTP 结合的方式水解GTP 为自身聚合提供能量[5-7],现已有高分辨率蛋白质X 射线结晶学提供了FtsZ 的详细结构信息[8],此外,不同的体外实验也可用于鉴定FtsZ 蛋白。在细菌细胞进行二分裂过程中,FtsZ 是第一个定位到细菌分裂层面的蛋白质,聚合成Z 环后,环体会招募下游蛋白,组装成被称为分裂蛋白复合物[9-10]的大分子复合体以完成后续分裂活动。扰乱FtsZ 的聚合作用可以抑制细菌分裂期隔膜的形成,若在细胞质分裂期间隔膜不能正确形成,则会观察到丝状或形态异常的细胞[11],进而导致细菌死亡。虽然细胞质分裂过程中调节Z 环的聚合-解聚速率的机制尚未可知,但FtsZ 蛋白N-末端的GTP 结合部位和C-末端的T7-环对Z-环的形成起重要作用,针对这2 个区域的FtsZ 抑制剂可以干扰FtsZ 蛋白的聚合或GTPase 活性,或两者兼而有之。作为微管蛋白同系物,尽管超过80%的FtsZ 序列与微管蛋白的序列不同[7]且FtsZ 和微管蛋白之间的C-末端结构域的氨基酸序列不太保守,但是从FtsZ 和微管蛋白的三维结构中可以看出,FtsZ 和微管蛋白的N 端结构域和C 端结构域非常相似,这表明FtsZ 和微管蛋白在生物体内可能发挥着相似的功能。微管蛋白已作为抗癌药物、抗原生动物药剂靶点被广泛研究[12-13],说明FtsZ 同样具有成为药物靶点的潜力,且因为FtsZ 与微管蛋白的低同源性,靶向FtsZ 的抑制剂将会对真核细胞具有良好的选择性和较低的细胞毒性,这使得FtsZ 成为一个有吸引力的新型抗菌靶点。
近年来,已有许多关于FtsZ 蛋白靶向药物的研究,它们通过干扰FtsZ 的GTPase 活性、Zring 的动力学过程或者破坏FtsZ 的结构而发挥作用,包括天然抑制剂,如姜黄素、白花丹素、桃拓酚、黄连素、香豆素类、肉桂醛、白藜芦醇、小檗碱、血根碱、白屈菜亦碱、陶塔酚、绿垂毒素、紫杉烷类等[14];合成抑制剂如3-MBA[15]、PC190-723[16]、3-苯基-异喹啉(3-phenyl-isoquinoline)[17]、三取代苯并咪唑(trisubstituted benzimidazoles)[18-19]等。传统药物筛选虽然筛选效果直观,但十分耗费人力、物力,虚拟筛选技术可以避免这些弊端,极大提高化合物的有效命中率。
本研究利用Python 语言编写ChemScript 脚本,构建二肽、三肽、四肽及五肽化合物结构数据库,通过分子对接筛选得到多种与FtsZ 结合的短肽化合物。利用分子动力学方法动态分析各短肽与FtsZ 的结合状态,解决分子对接忽视时间维度以及未直接体现水分子溶剂效应的问题。在此基础上,通过抑菌试验评价其对金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)的抑菌活性以及对FtsZ 的GTP 酶活性的影响,旨在探究靶向FtsZ 的潜在肽类抑制剂和作用机制。
1 材料与方法
1.1 实验材料1)质粒、菌株 金黄色葡萄球菌FtsZ 蛋白的表达菌:pET28a-FtsZ(BL21)由笔者所在的实验室构建、储存;金黄色葡萄球菌菌株Staphylococcus aureus 04-02981、Bacillus subtilis 168 由笔者所在的实验室储存。2)试剂 Phosphate Assay Kit(Abnova,中国台湾)、GTP(上海生工)、多肽TE101、PE101、PE102、PE103、PE104(上海生工)。3) 仪器 酶标仪MR-96A(迈瑞)。
1.2 分子对接从蛋白质结构数据库(Protein Data Bank,PDB)下载金黄色葡萄球菌FtsZ 蛋白的晶体结构(PDB#4DXD)[20]。利用MOE 分子对接软件,选用Amber99 力场,修正蛋白质结构数据中包含的错误后,利用构建好的5 个数据库分别进行对接。对接模式为诱导契合法,利用GBVI/WSA ΔG 方法对它们之间的结合自由能做最终评价[21]。GBVI/WSA ΔG 的计算公式如下,当 ΔG 数值越负,表明配体与受体之间的引力越强。
式中:ΔECoul、ΔEsol、ΔEvdW分别是静电、溶剂及范德华作用,ΔSA是溶剂暴露面积。
1.3 分子动力学分析对接完成后,挑选打分靠前的配体,保存其与蛋白质结合的PDB 结构,利用安装在Ubuntu Linux(18.06)操作系统上的GROMACS(2020.03)探究蛋白质与配体之间的相互作用随时间的动态变化,分析过程简述如下。首先生成FtsZ 与配体复合物的GROMACS 格式的空间结构文件及拓扑文件。选用针对蛋白质从头计算加以优化的AMBER99SB 全原子力场,以及TIP3P显式水分子模型。创建具有周期性边界的正十二面体计算单元,将蛋白质复合物放置在单元盒中央,蛋白质复合物与单元盒边界的距离为1.0 nm。以水分子填充单元盒,以Na+和Cl-随机取代水分子使系统呈电中性,NaCl 的终浓度为0.1 mol·L-1。利用最大斜率下降法使系统能量最小化,终止阈值为1 000 kJ·(mol·nm)-1。能量最小化后,系统在等温-等容条件下使用速度重新标度法,通过调整标准Berendsen 恒温器以获得正确的动能分布。然后利用Parrinello-Rahman 压力耦合算法使系统达到等温-等压状态。系统平衡后,进行50 000 000步分子动力学综合运算(Production)。在每个步骤中,利用兰纳-琼斯势能以及库伦势能方程计算系统中所有原子之间的作用力及运动状态;其中,远距离静电相互作用采用平滑粒子-网格Ewald 总和法计算。利用基数样条插值法将电荷分配给网格,然后进行三维快速傅里叶变换。静电力由傅里叶空间中的相互作用力反推得到。
RMSD(Root Mean Square Deviation)值计算公式为:
式中:ri是原子i在t时间的位置,而M是原子质量(m)的总和。
相互作用能(Interaction energy)为兰纳-琼斯势能(3)与库伦势能(4)之和。
式中:r是位置矢量长度,q是基电荷等于1.602 176 565×10-19C,f是电转换因子,等于1/4πε0或138.935 458 kJ·mol-1·nm e-2。
用LB 液体培养基稀释法测定化合物的抑菌活性,首先将适量的LB 液体培养基在高压水蒸气灭菌锅灭菌后,放入超净台紫外灭菌备用,向无菌96 孔板内加入LB 培养基,将目标化合物溶液(0.01 mol·L-1)和对照组溶液,分别加入96 孔板各列的第一个孔内,其次用二倍稀释法稀释到第10 孔,最后接种配置好的菌液(最后一列除外)。在37 ℃恒温培养箱培养24 h 后,用酶标仪测定各孔的OD600值,所得各孔的数据由公式(5)处理可得到各化合物的抑菌活性。为了观察化合物在细菌生长阶段的不同影响,本研究还使用酶标仪的动力学程序,振板培养化合物处理的细菌,并以1 h为时间间隔连续测量其OD600值,绘制其生长曲线,每个实验重复3 次。
1.4 抑菌活性评价用LB 液体培养基稀释法测定化合物的抑菌活性,首先将适量的LB 液体培养基在高压水蒸气灭菌锅灭菌后,放入超净台紫外灭菌备用,向无菌96 孔板内加入LB 培养基,将目标化合物溶液(0.01 mol·L-1)和对照组溶液,分别加入96 孔板各列的第一个孔内,其次用二倍稀释法稀释到第10 孔,最后接种配置好的菌液(最后一列除外)。在37℃恒温培养箱培养24 h 后,用酶标仪测定各孔的OD600值,所得各孔的数据由公式(5)处理可得到各化合物的抑菌活性。为了观察化合物在细菌生长阶段的不同影响,本研究还使用酶标仪的动力学程序,振板培养化合物处理的细菌,并以1 h 为时间间隔连续测量其OD600值,绘制其生长曲线,每个实验重复3 次。
1.5GTPase活性测定GTP 酶活性的测定使用Phosphate Assay Kit(Abnova,Taiwan China)进行测定,该试剂盒测量GTP 在水解释放的无机磷浓度,该测定方法基于孔雀石绿钼酸盐与游离正磷酸盐在酸性条件下形成络合物。在620~640 nm 处测得的绿色磷钼酸络合物的形成与游离有机磷的浓度直接相关,该测定的应用包括定量蛋白质磷酸酶底物的磷酸化和磷酸盐释放[22-23]。
将纯化得到的重组金黄色葡萄球菌FtsZ(6 μmol·L-1)与系列稀释的化合物在室温下与50 mmol·L-1MOPS 缓冲液(pH 6.5)中于96 孔板中孵育10 min,对照样品中含有1%的DMSO,然后向混合物中加入200 mmol·L-1氯化钾和5 mmol·L-1氯化镁,最后加入500 mmol·L-1GTP,在37℃孵育30 min。孵育结束后,向各孔中加入5 μL MG Acidic Solution 试剂在室温下反应10 min,最后再向各孔中加入15 μL MG Blue Solution 试剂,室温下孵育20 min 后用酶标仪测得各孔在620 nm 处的吸收光强度值,根据磷酸根浓度吸光度标准曲线,计算得到混合物中的磷酸根浓度,用以表征酶活性,并通过与空白组相对比,计算得到多肽对于FtsZ 酶活的抑制情况,每个实验重复3 次。
2 结果与分析
2.1 分子对接筛选多肽函数(公式1)综合考虑了平动/转动熵、静电效应、溶剂效应、范德华效应、溶剂暴露面积等要素,计算结果相对准确,常用于药物虚拟筛选和构效关系探究。根据MOE的初步虚拟筛选,所有对接多肽库的结果根据评分进行从高到低排序,同时综合考虑它们与蛋白的成键数目后,命中了系列多肽化合物,其对接细节见表1。从表1 可知:PE101 具有最低的打分值,为-11.933 9,其E-refine 值也最低,为-58.525 7,说明根据分子对接结果来看,PE101 具有最好的结合稳定性。类似的,其他PE 多肽的打分值也很低,但E-refine 值的大小却不尽相同。相较于PE 多肽而言,TE102 也具有较低的打分值,但TE101 具有更低的E-refine,为进一步验证短肽配体与蛋白质的结合稳定性,笔者进行了分子动力学模拟计算。
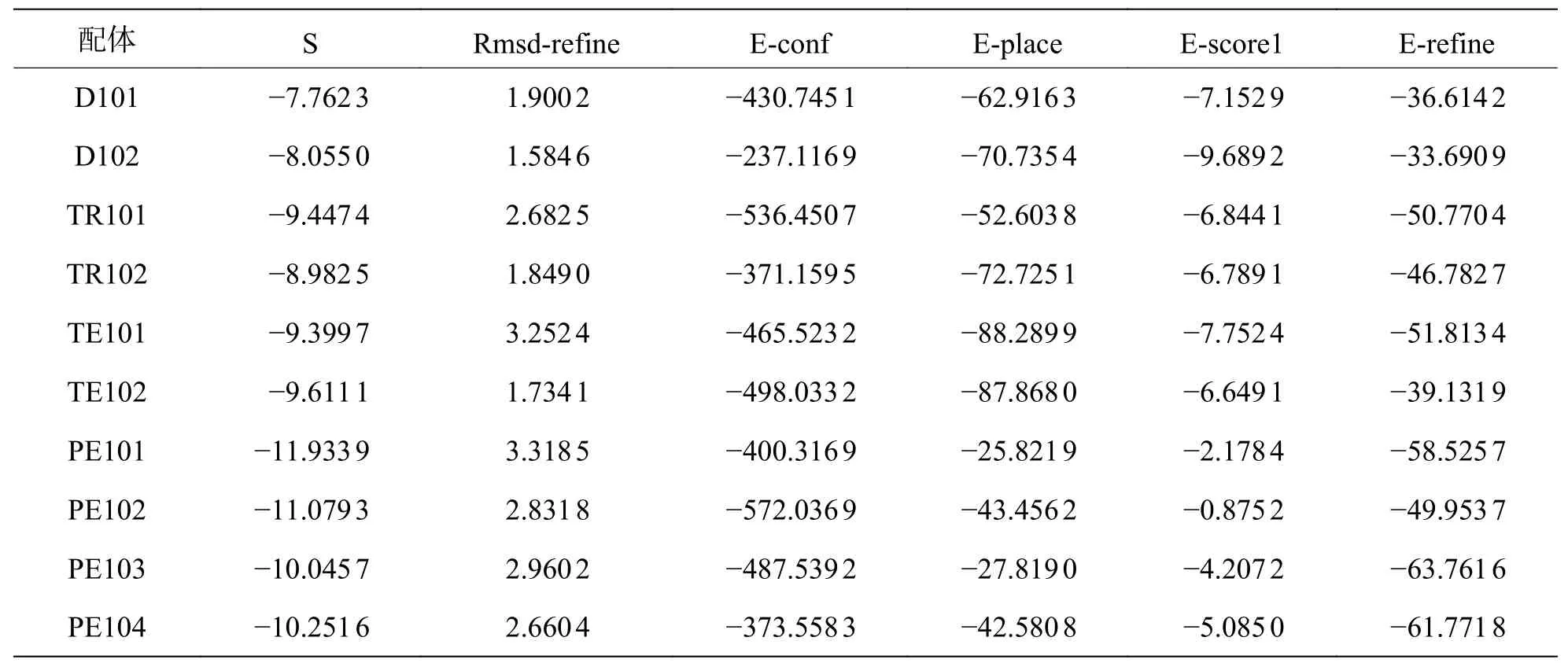
表1 对接结果数据
为了更清楚地阐述蛋白质与小分子配体的相互作用方式,图1 展示了上述配体与FtsZ 蛋白受体的对接空间位置结构示意图,并对不同配体与蛋白产生相互作用的氨基酸及作用形式进行汇总(表2),根据表2 可知,所有的短肽大都倾向于和FtsZ 蛋白的ASP199、LEU200、LEU209 产生相互作用,且其形成的氢键的原子距离稳定在3 Å左右,表明形成的氢键稳定且可靠。
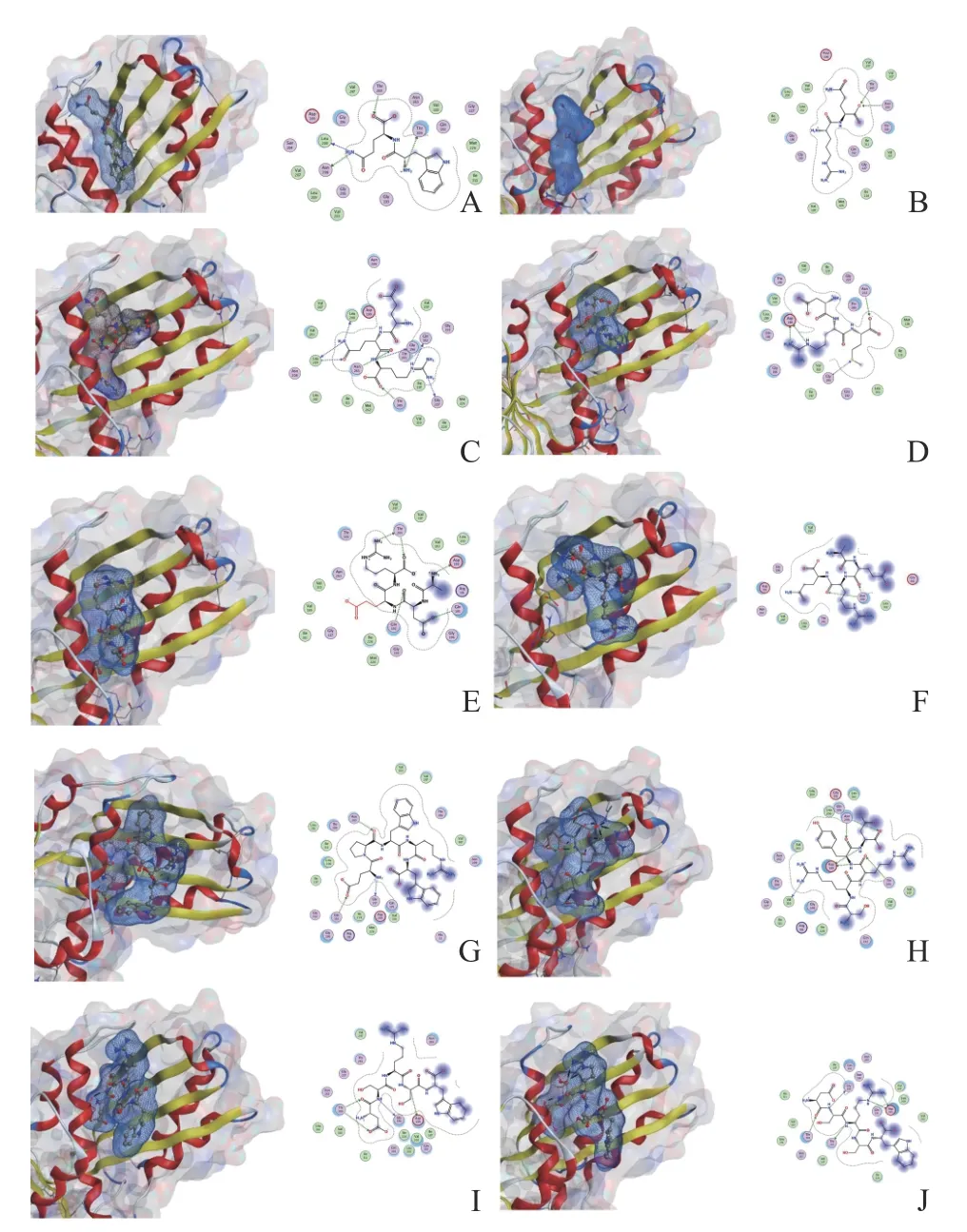
图1 小分子配体与蛋白质的对接二维图
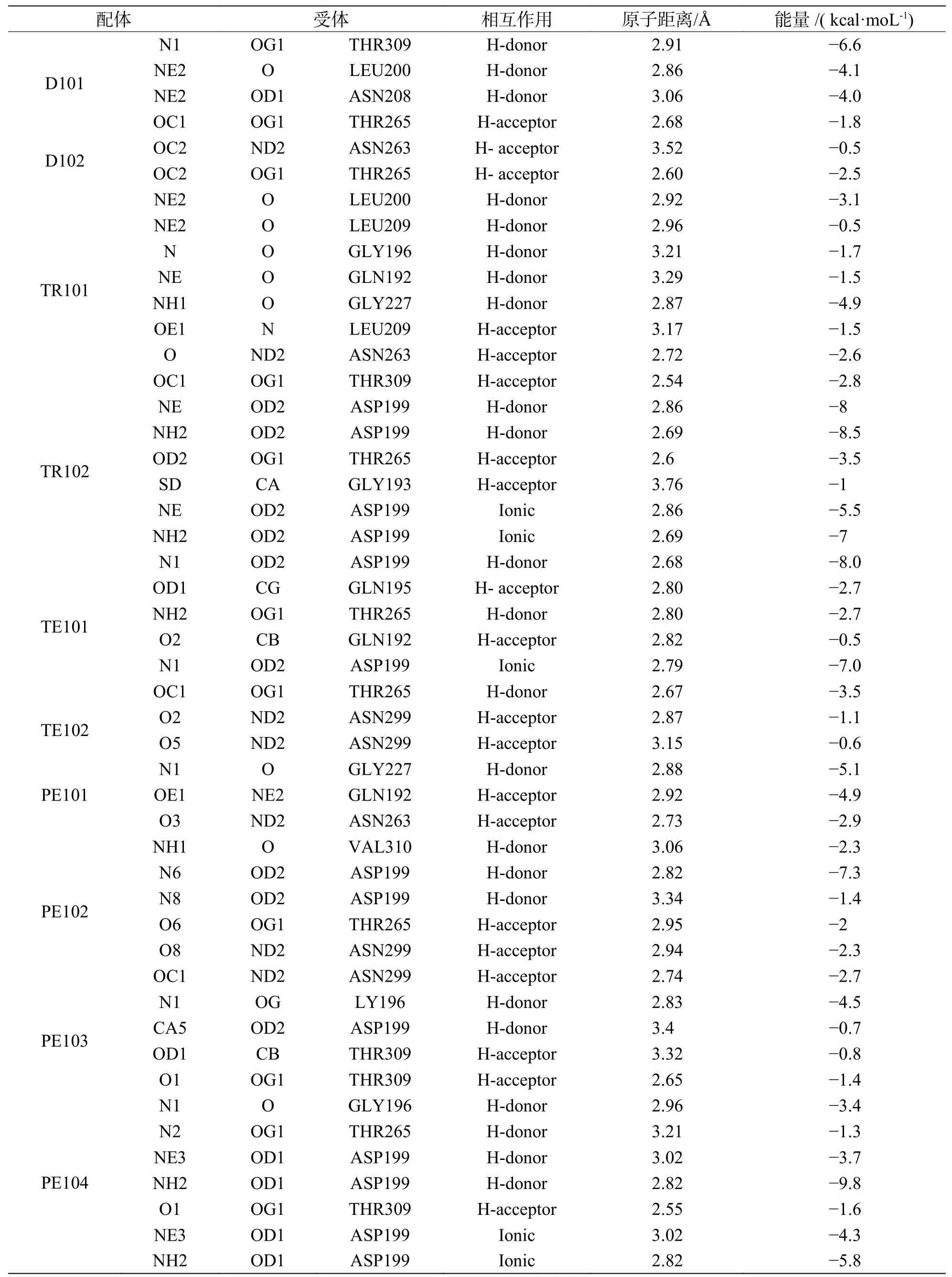
表2 小分子和蛋白的氢键相互作用
2.2 复合物的分子动力学分析由于分子对接为静态分析,缺少对时间维度上原子运动以及水分子直接作用的分析,所以,本研究应用分子动力学方法动态分析在水溶液系统中所有原子之间的相互作用以及运动状态,从而验证小分子配体与FtsZ 的相互作用强弱和结合稳定性。
D101、D102 与FtsZ 分子动力学模拟过程中的RMSD 值计算结果如图2-A 所示,两个二肽均可以在FtsZ 的PC 口袋中稳定存在,二者存在周期性的RMSD 值跳跃,其缘由可能是二肽体积较小,不能很好的在空间结构上契合蛋白口袋,这也是导致二态打分值较低的原因;三肽TR102 也存在与二肽相同的情况,但其空间位置变化较为无序,与前者周期性重复不同,可能是因为结合亲和力较低,相反的,TR101 能稳定地与FtsZ 口袋结合,且RMSD 值稳定在0.1 以下(图2-B);四肽TE101 无法在PC 口袋中稳定存在,RMSD 值随时间增加而持续增加,且在5 000 ps 附近也不见稳定趋势,AERQ 虽能在空间上大体保持位置不移动,但由图2-C 能看出其稳定性也较差,波动范围较大;从图2-D 可知,PE101、PE102 五肽在口袋中的结合稳定性要优于PE103、PE104,其中PE104 波动最为剧烈,但RMSD 值始终稳定在0.1~0.2之间。
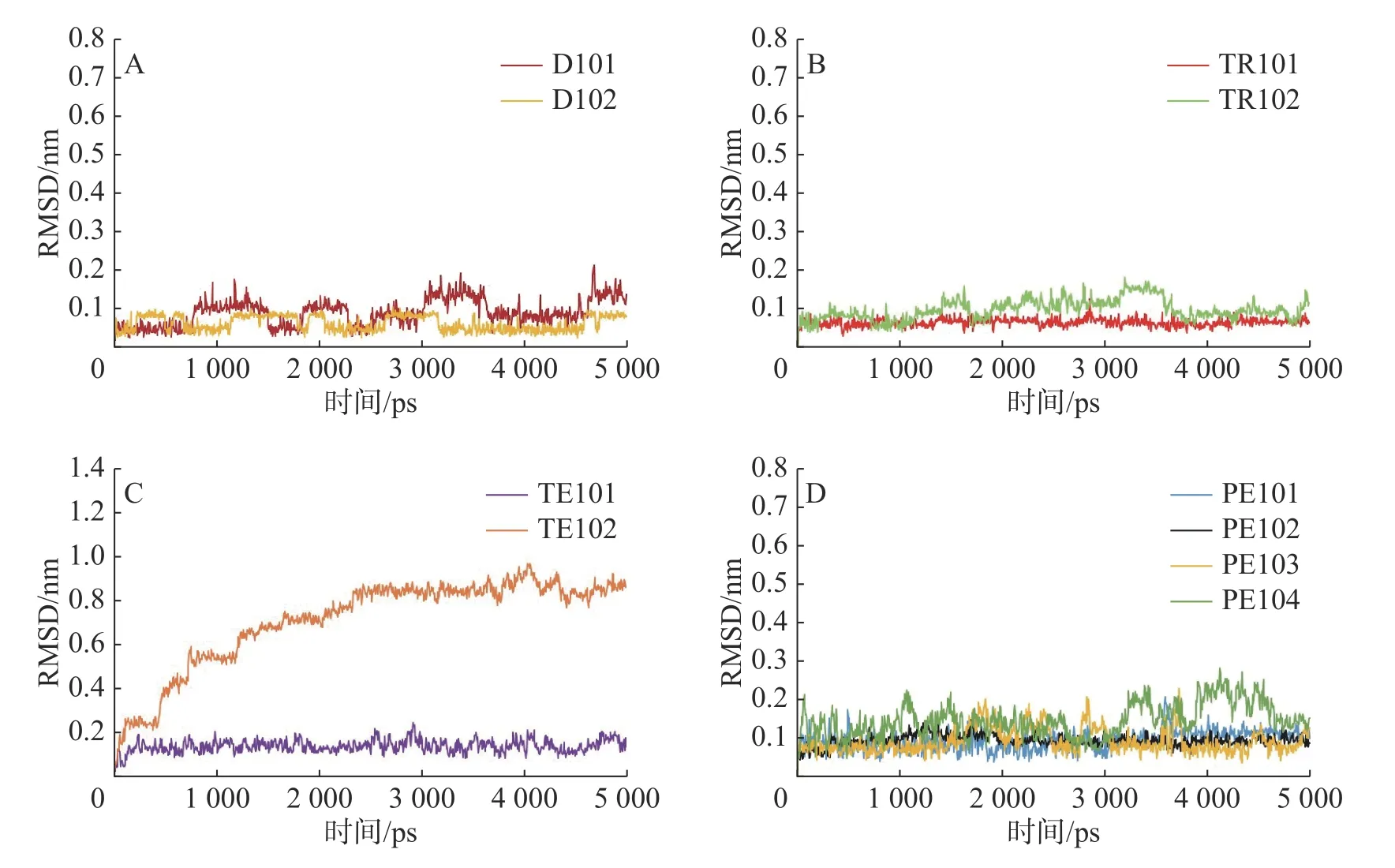
图2 二元络合物中配体重原子的均方根偏差随时间的变化
在蛋白质-配体相互作用的动力学分析中[24-25],相互作用能可用于表征2 组相互作用分子之间的能量变化,由库仑势能和LJ 势能组成,库仑势能表征分子之间的静电相互作用,LJ 势能是2 种物质在近距离内以相互排斥为主,而在长距离上则以相互吸引为主,表征了分子间范德华力的相互作用,相互作用能值越低,表明系统更稳定。相互作用能分析结果(图3)显示,PE101、PE102、PE103、PE104、TE101 具有更低的相互作用能,说明其结合更为稳定。
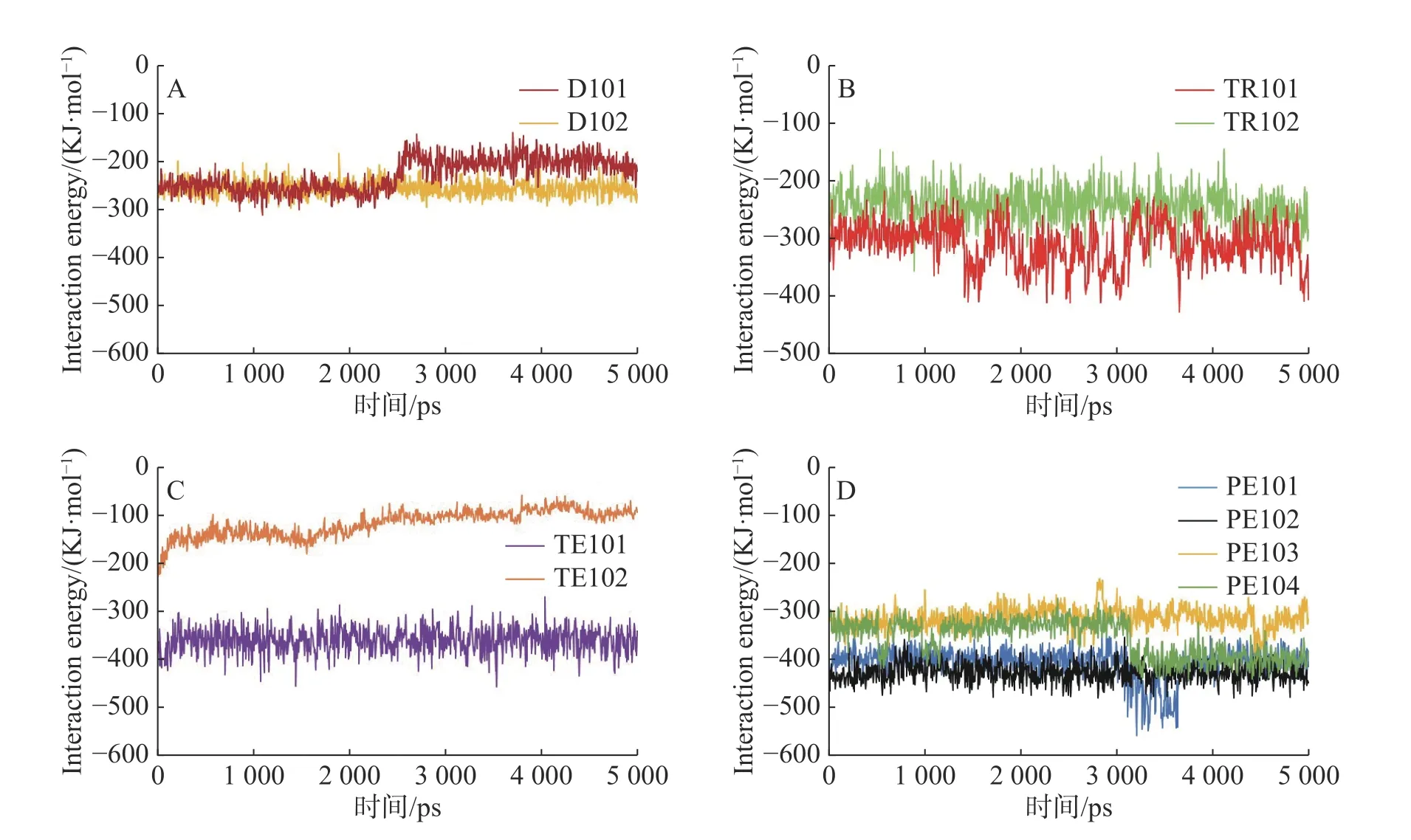
图3 二元络合物的相互作用势能随时间的变化
2.3 抑菌活性评价根据分子对接及分子动力学分析结果,选择PE101、PE102、PE103、PE104、TE101 这5 个多肽进行抑菌活性测定。本实验采用肉汤微量稀释法进行多肽对金黄色葡萄球菌及枯草芽孢杆菌的抑菌活性测试,实验根据CLSI(Clinical and Laboratory Standards Institute)标准,所得结果显示(图4),多肽在500 μmol·L-1的浓度下对金黄色葡萄球菌的抑制活性差距较大,PE103 在其中效果最好,抑制率为25%左右,剩余多肽抑制率均在10%左右;各多肽对于枯草芽孢杆菌的作用略强于金黄色葡萄球菌,作用最强的TE101 抑制率为25%,其他的五肽抑制率也达到了20%左右。另外本研究中测定了各浓度化合物处理后的细菌生长曲线,观察药物在各阶段对金黄色葡萄球菌生长的影响(图5),不难看出PE103(图5-D)能使细菌的对数生长期生长速率变缓,这可能是由于细菌细胞分裂受阻所导致。
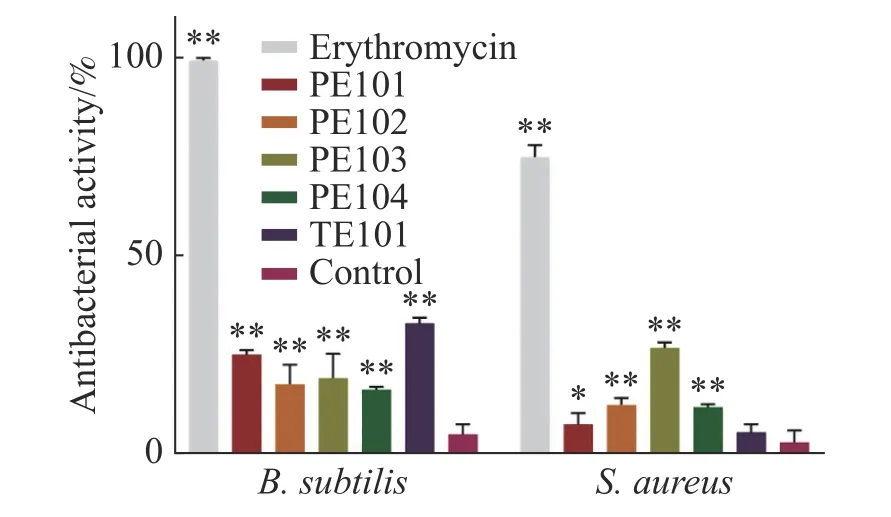
图4 多肽对金黄色葡萄球菌和枯草芽孢杆菌的抑制活性
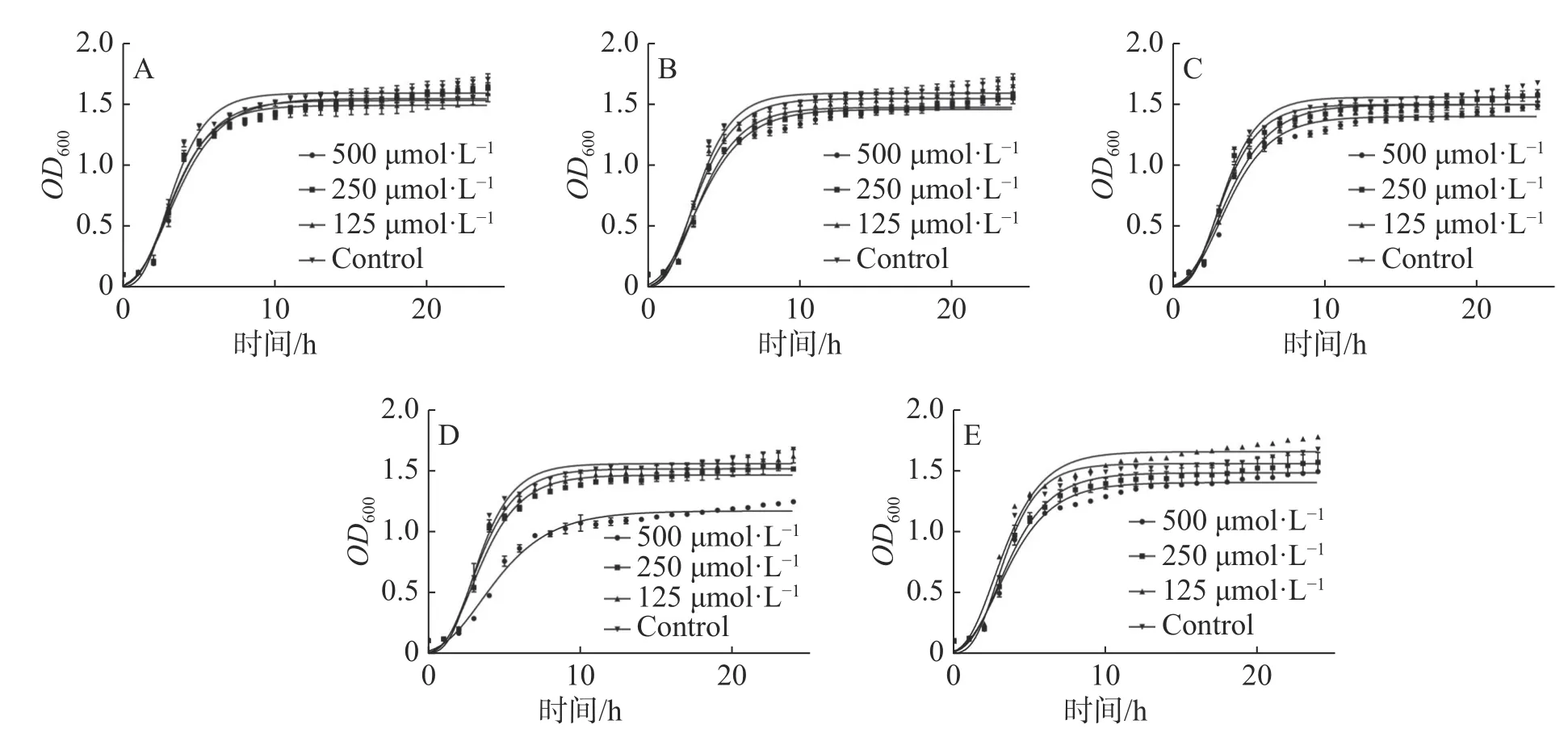
图5 各多肽的梯度浓度处理下金黄色葡萄球菌的生长曲线
2.4 多肽对FtsZ蛋白的GTPase影响本研究通过测定多肽对于FtsZ 的酶活性影响,对多肽的作用机制进行了初步探究,结果如图6 所示,根据实验结果可知,多肽化合物对FtsZ 的GTPase 活性并没有影响。
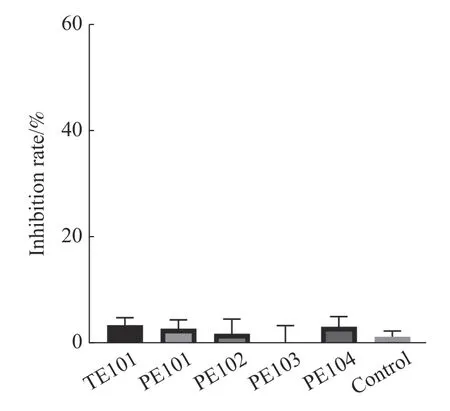
图6 多肽对GTPase 活性的影响各组处理浓度为500 μmol·L-1。
3 讨 论
在本研究中,针对金黄色葡萄球菌FtsZ 蛋白的晶体结构(PDB Code:4DXD),优化处理后,以其PC 口袋为结合位点,构建二肽、三肽、四肽、五肽库作为配体库,对数十万个多肽进行了虚拟筛选,根据对接打分表排序选择了分值靠前的10 个多肽(二肽D101、D102,三肽TR101、TR102,四肽为TE101、TE102,五肽为PE101、PE102、PE103、PE104),在此基础上,进一步利用GROMAC程序进行分子动力学研究验证其对接结合可靠性和稳定性,通过计算比较它们在分子动力学过程中的配体RMSD 值变化、配体-蛋白相互作用能的高低,进一步筛选出结合能力更好的多肽。RMSD 结果表明,二肽、三肽不能很好的在PC 口袋中稳定存在,相较而言,在模拟过程中四肽TE101 及4 个五肽PE101、PE102、PE103、PE104,RMSD 值稳定在0.2 以下,说明其结合稳定性更佳;相互作用能的计算结果显示,以上结合稳定的5 个多肽具有更低的相互作用能。综合RMSD、Interaction energy 的分析结果,本研究初步命中了TE101、PE101、PE102、PE103、PE104 进行研究,抑菌活性结果显示,命中多肽对金黄色葡萄球菌及枯草芽孢杆菌的生长确实存在抑制。
另外,实验证明分子对接筛选的FtsZ 抑制剂并不影响FtsZ 的GTPase,这与之前研究报道的苯甲酰胺类衍生物的作用机制类似[26],已报道的多肽类抑制剂中,MciZ 通过靶向枯草芽孢杆菌FtsZ 蛋白抑制其组装过程发挥抑菌作用[27-29];ADEPs 降解FtsZ 蛋白来阻碍Z 环的形成进而发挥抑菌作用[30-31];Kil 通过抑制FtsZ 蛋白的GTPase 活性进而影响Z 环的形成对大肠杆菌产生抑制作用[32-33],所以笔者推测,命中多肽的作用机制可能是由于其较大的分子体积占据了狭缝,导致FtsZ 蛋白二级结构无法在R 态和T 态之间转换[34],完成FtsZ单体与Z 环的动态交换过程,导致细菌分裂过程异常,且分子对接结果也显示,几乎所有的短肽配体都能与FtsZ 狭缝中的氨基酸形成大量氢键、离子键,这可能也是稳定其蛋白结构的因素之一。
新靶点抗菌药物的开发需要庞大的先导化合物库,本研究以短肽作为配体进行分子对接筛选,并对结果进行分子动力学分析,对先导化合物库的丰富具有积极作用。

