骨形态发生蛋白9在成骨分化中的作用与信号通路研究进展
沈思远,梁锋,张云鹏,肖守允,丁惠民
南京医科大学附属明基医院骨科,江苏 南京 210019
长久以来,各种因素造成的骨缺损是临床常见问题之一。较为复杂的骨缺损会增加不愈合或延迟愈合的风险,从而影响患者活动,降低生活质量,增加患者负担。因此如何促进骨形成具有重要临床意义和社会效益。
随着细胞信号通路研究的不断深入,利用生物活性分子和生物相容性材料的骨再生及骨组织工程逐步向前发展。生长因子在骨再生中发挥重要作用。骨形态发生蛋白(bone morphogenetic protein,BMP)来自转化生长因子(transforming growth factor,TGF)-β超家族,在间充质干细胞(mesenchymal stem cell,MSC)成骨分化中起关键作用。BMP 最早被发现可以诱导肌肉组织中的骨形成[1]。
BMP-9是BMP家族的一员,其与目前研究较多的BMP-2、BMP-4、BMP-7 相似,具有介导MSC 成骨分化的能力。近几年研究表明,相比其他BMP 蛋白,BMP-9 具有更强的成骨分化潜能。既往研究表明,BMP-9 主要通过SMAD 依赖信号通路来介导干细胞成骨分化,但同时与其他信号通路之间也存在调控关系。由BMP 触发的SMAD 细胞信号通路通常被Noggin(诺金)抑制。然而,BMP-9 所介导的SMAD 通路不受Noggin 抑制[2],因此BMP-9 可以更好地促进骨祖细胞向前成骨细胞和成骨细胞分化。本文主要对BMP-9 配体、信号通路及成骨、成软骨分化能力进行综述。
1 BMP-9介导成骨分化的配体及信号通路
BMP-9 在调控间充质干细胞成骨分化的过程中,与BMPⅠ型受体(type Ⅰbone morphogenetic protein receptor,BMPRⅠ)和BMPⅡ型受体(typeⅡbone morphogenetic protein receptor,BMPRⅡ)相结合,进而激活下游的信号通路,引发级联反应。BMP-9可以与BMPRI 中的间变性淋巴瘤激酶1(anaplastic lymphoma kinase 1,ALK1)和间变性淋巴瘤激酶2(anaplastic lymphoma kinase 2,ALK2)相结合,其中与ALK1有较高的亲和性,与ALK2亲和性较弱[3-4]。对于BMPRⅡ,BMP-9 可以与它的多个亚型结合[4-6]。这些受体多数为跨膜蛋白受体,包含细胞膜外面富含半胱氨酸的胞外结合区域、跨膜区域蛋白和胞浆内富含丝氨酸与苏氨酸的胞内区域[5-7]。
BMP-9 的信号转导过程通常是由BMP-9 形成的同源二聚体特异性地结合到BMPRⅠ、BMPRⅡ异源二聚体复合物上,进而形成异源四聚体聚合物,从而引起富含甘氨酸-丝氨酸基序列的BMPRⅡ胞内区域的磷酸化,从而激活BMPRⅠ及其下游信号通路[7]。相关研究表明,BMP-9 可以通过作用于多条信号通路从而调控不同组织来源的MSC 的成骨分化过程(图1)。
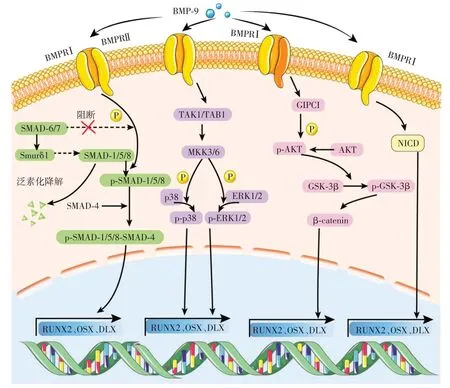
图1 BMP-9信号通路Figure 1 BMP-9 signaling pathway
1.1 BMP-9-SMAD信号通路
BMP-9-SMAD 途径,是BMP-9 调控干细胞成骨分化的经典信号通路。细胞内SMAD的激活是该信号通路级联反应的关键靶点。其主要机制为BMP-9与BMP受体结合形成异源四聚体复合物,并招募细胞内信号激酶SMAD-1/5/8,随后启动磷酸化过程。磷酸化的SMAD-1/5/8 复合物结合SMAD-4,形成SMAD-1/5/8-SMAD-4复合物,其随后易位到细胞核,从而调控下游成骨相关基因组的表达[8]。
除SMAD-1/5/8-SMAD-4复合物外,SMAD-6/7同样参与了BMP-9-SMAD 信号通路。SMAD-6/7 又被称作抑制性SMAD(inhibitory SMAD,I-SMAD),在BMP-9-SMAD信号通路中,过表达的SMAD-6/7可以抑制BMP-9 对干细胞成骨分化的影响。当BMP-9刺激时,过表达的SMAD-6/7从细胞核进入细胞质。SMAD-6/7竞争性结合Ⅰ型受体,抑制SMAD-1/5/8的磷酸化过程,同时抑制SMAD-1/5/8 和SMAD-4 复合物的形成和活性。SMAD-6/7 还可以调控泛素连接酶Smurf 1 的表达水平,使其与Ⅰ型受体结合,促进SMAD-1/5/8泛素化,从而抑制BMP-9-SMAD信号的转导[9]。
1.2 BMP-9-丝裂原活化蛋白激酶(BMP-9-mitogenactivated protein kinase,BMP-9-MAPK)信号通路
BMP-9-MAPK信号通路是BMP-9信号通路的重要组成部分之一,MAPK 成员包括细胞外信号相关激酶1/2(extracellular regulated protein kinases,ERK1/2)和ERK5、c-Jun 氨基(N)末端激酶1/2(JNK1)以及p38 亚型(p38α、p38β、p38γ和p38δ)。当BMP-9 与BMPR 相结合后,BMPRⅡ受体会激活转化生长因子β 激活激酶-1(transforming growth factor-β-activated kinase-1,TAK-1)/转化生长因子激活激酶1 结合蛋白(transforming growth factor-activated kinase binding protein,TAB-1)复合物,从而激活丝裂原活化蛋白激酶激酶-3/6(mitogen-activated proteinkinase kinase-3/6,MKK-3/6),进而激活下游的p38或ERK-1/2 并使其磷酸化,最终启动下游信号转导[10]。p38选择性抑制剂可以明显抑制BMP-9 介导的C3H10T1/2 细胞成骨分化过程。BMP-9 介导的C3H10T1/2 细胞成骨分化过程中,磷酸化的p38 表达上调。使用SB203580(p38抑制剂)后,C3H10T1/2细胞的成骨分化能力下调,提示p38 在BMP-9 介导的成骨分化过程中可能发挥重要作用[11]。
1.3 BMP-9-Wnt/β-catenin信号通路
Wnt/β-catenin 信号通路具有调节骨组织代谢、介导成骨分化及促进软骨发育的作用[12]。Wnt配体首先与Frizzled 和LRP-5/6受体相结合,随后磷酸化Dvl 蛋白,进而募集糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)、Axin、APC、CK1,从而形成GSK3β/Dvl/Axin/APC/CK1复合物,未被抑制的β-catenin 进入细胞核内结合到TCF/LEF 转录因子上,启动下游成骨分化相关基因的转录[7,12]。BMP-9可以介导β-catenin 表达和调控其磷酸化过程,进而增强磷酸化的GSK3β水平,从而促进高磷酸盐状态下血管平滑肌细胞中成骨标志物Runt 相关转录因子2(Runt-related transcription factor 2,RUNX2)、骨桥蛋白(osteopontin,OPN)、骨钙蛋白(osteocalcin,OCN)的表达,增加矿化作用[13]。有研究表明,BMP-9可以通过Wnt/β-catenin 信号通路来介导牙胚来源的间充质干细胞(tooth germ mesenchymal cell,TGMC)成骨分化,当敲低β-catenin时,BMP-9 组的碱性磷酸酶(alkaline phosphatase,ALP)活性和OCN表达水平下降[14]。
1.4 BMP-9与Notch信号通路
Notch 信号被认为是骨形成的重要调节分子,涉及胚胎发育、细胞增殖分化和细胞稳态等多个生物学过程。Notch 信号通路主要由5 种配体(JAG1、JAG2、DLL1、DLL3 和DLL5)和4 种受体(Notch1~4)构成[15]。在骨相关病症中,Notch 受体或配体通常发生表达异常;以往研究也表明,在成骨、成软骨和破骨分化过程中Notch 信号广泛表达[15]。Notch 信号由Notch受体结合的配体激活,随后Notch被金属蛋白酶肿瘤坏死因子转化酶(TNF-α converting enzyme,TACE)裂解,然后被早老素1(presenilin 1)和早老素2(presenilin 2)的γ-分泌酶复合物进一步裂解,成为Notch 细胞内结构域(intracellular domain,NICD)。NICD 易位进入细胞核并与DNA 结合蛋白CSL(CBF1/Suppressor of hairless/LAG-1)相互作用并调节下游基因,从而介导细胞内的信号转导过程[16]。
2 BMP-9的成骨分化能力
BMP-9具有促进成骨细胞分化及诱导体内外成骨的作用。Fujioka-Kobayashi等[17]使用抗鼠核因子-κB 配体受体激活剂(monoclonal anti-murine receptor activator of nuclear factor kappa B ligand,RANKL)的单克隆抗体(monoclonal antibody,mAb)在小鼠体内建立抗体介导的抗再吸收(antibody-mediated antiresorptive therapy,AMART)模型。在第3天和第14天时,与对照组比较,rhBMP-9 治疗组的成骨标志物RUNX2、ALP、OSX(osterix)和OCN 的mRNA 表达水平显著升高。随后,将rhBMP-9 与胶原蛋白膜填充至小鼠颅骨缺损处,辅以mAb 治疗。28 d时,显微CT 和组织学分析显示,相比对照组,rhBMP-9+mAb组新骨形成更多。Lu等[18]发现BMP-9 可以诱导小鼠胚胎骨髓间充质干细胞(C3H10T1/2细胞)成骨分化,且与沉默交配型信息调节器2 同源物-1(silent mating type information regulator 2 homolog-1,SIRT1)的激活剂SRT2104 联合应用,BMP-9 的成骨能力明显增强。之后用BMP-9与GFP分别处理C3H10T1/2细胞,发现与对照组相比,BMP-9 组的成骨标志物OCN、α1-Ⅰ型胶原蛋白(collagen type Ⅰalpha 1,COL1A1)及RUNX2 表达水平更高。此外,Lu等[18]用BMP-9+SRT2104处理C3H10T1/2细胞,在处理5、7 d 时发现与单纯使用BMP-9 相比,BMP-9+SRT2104 组的OCN、COL1A1 及RUNX2 表达水平明显增强,同时PCR检测结果也证实了这一结论。
BMP-9 可以促进间充质干细胞成骨分化,因此在骨组织工程、颅骨修复、骨缺损愈合中发挥重要作用。Freitas等[19]利用簇状规则间隔短回文重复序列相关核酸酶Cas-9(clustered regularly interspaced short palindromic repeats/associated nulease Cas-9,CRISPR-Cas9)技术对MSC进行基因编辑,使其过表达BMP-9,同时构建了大鼠颅骨缺损模型,结果显示,BMP-9 组的RUNX2、OSX、ALP 等成骨标志物基因表达水平较对照组更高,同时注射后第21天时观察到更强的细胞外基质矿化作用。显微CT 结果显示,与对照组相比,BMP-9处理组的颅骨缺损处新骨形成更多。Wang等[20]发现在体内,相比对照组,负载BMP-9 和P-15 肽水凝胶的聚乳酸-乙醇酸(polylactic acid glycolic acid,PLGA)支架处理的MSC表达更高水平的ALP、RUNX2、OCN。这提示BMP-9 能更好地促进MSC的成骨分化。同时,该研究还观察到在兔骨缺损模型中,BMP-9+P-15 肽水凝胶+PLGA 组的新骨形成更多。Shi等[21]研究报道,联合应用生物活性玻璃(Bioglass)+BMP-9能够更好地促进成骨分化。观察到在体内,相比单独使用Bioglass,BMP-9+Bioglass 组ALP活性更高,且在BMP-9存在的情况下,RUNX2、OSX 表达水平也显著上调。同时,在大鼠牙齿缺损模型中,也可以观测到BMP-9+Bioglass组新骨形成更多。
3 BMP-9的成软骨作用
BMP-9 具有介导软骨祖细胞(chondroprogenitor,CPC)、MSC 等成软骨分化的潜能。Kawin等[22]研究了BMP-9 在CPC 成软骨分化中的作用。该研究分别用1-34 甲状旁腺激素(parathyroid hormone,PTH)和BMP-9处理CPC,结果表明BMP-9组的成软骨标志物SRY 相关的高迁移率族框-9(SRY-type high-mobility-group box-9,SOX-9)、蛋白聚糖(aggrecan,ACAN)、α1-Ⅱ型胶原(collagen type Ⅰalpha 1,COL2A1)的mRNA表达水平,相比1-34PTH组升高,其中以COL2A1最为明显。随后,通过阿尔新蓝、藏红O 染色和甲苯胺蓝染色测定糖胺聚糖沉积,研究显示BMP-9 组对糖胺聚糖表现出更大的摄取量。同样,免疫组化分析也表明BMP-9 组的COL2A1 沉积也更显著。Morgan等[23]从未成熟牛软骨中筛选出关节软骨源性祖细胞,分别用TGF 和BMP-9 诱导,发现BMP-9 处理的祖细胞的ACAN 和COL2A1基因表达分别比对照组高11倍和5倍,培养14 d后的基因表达定量分析也证实了这一点。由此可见,BMP-9 可以促进成软骨分化,但其诱导软骨形成的机制目前尚不明确。
4 BMP-9的特性
与其他BMP家族成员相比,BMP-9的成骨分化能力最强。Bipin等[24]研究发现,在大鼠颅骨缺损模型中,使用甲基纤维素(MC)和海藻酸钙(Alg)的可注射给药系统联合搭载不同剂量(0.5、1.5 μg)的rhBMP-2 或rhBMP-9 的凝胶系统,相同剂量下,rhBMP-9组相比rhBMP-2组表现出更好的骨缺损修复效果,同时还观察到0.5 μg rhBMP-9 组骨缺损修复效果弱于1.5 μg rhBMP-9 组。Fujioka-Kobayashi等[25]构建新西兰兔颅骨缺损模型,在该模型中通过脱蛋白牛骨骨粉搭载不同质量(5、20 μg)的rhBMP-2或rhBMP-9,结果表明,5 μg rhBMP-9组表现出最佳的修复骨结构。相较于5 μg rhBMP-9组,20 μg rhBMP-2组与20 μg rhBMP-9 组的骨修复效果较差,而5 μg rhBMP-2组则不能完全修复骨缺损。
此外,不同于其他BMP(如BMP-2、BMP-4、BMP-7),BMP-9不能被经典的BMP受体拮抗剂Noggin所抑制。据报道,Noggin抑制BMP信号通路的机制是通过与BMPRⅠ和BMPRⅡ中的配体结构域结合,从而阻碍BMP 与其受体上的结合位点相结合。既往相关研究表明,Noggin 对BMP-9 诱导的干细胞成骨分化过程无明显影响[26]。研究发现,在Noggin存在的情况中,用BMP-2和BMP-9刺激肌肉前体细胞系C2C12细胞,免疫荧光检测发现与BMP-2 处理组相比,BMP-9 处理组能够在细胞核中观察到更高水平的Smad-1/5/8[2]。与此同时,测定Smad-6/7 的表达水平,发现Noggin 存在时,与其他BMP 相比,BMP-9 更能诱导Smad-6/7 的表达,这一结果表明BMP-9 不受Noggin 抑制,且相比其他BMP,能够更好地促进BMP-SMAD信号通路。此外,还发现BMP-9刺激的C2C12 细胞或小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)出现较多的异位骨形成,而BMP-2、BMP-4、BMP-6、BMP-7刺激的细胞异位骨形成较少或可忽略,这也证实了Noggin 对除BMP-9以外的其他BMP家族蛋白有明显抑制作用。苏木精和伊红染色结果表明,BMP-9能够在无或存在Noggin的情况下诱导C2C12和MEF的骨形成[2]。
5 结论与展望
近年的研究表明BMP-9 在骨再生及骨组织工程中起重要作用。现有的研究表明,BMP-9 可以通过多条信号通路(如BMP-9-SMAD、BMP-9-MAPK、BMP-9-TGFβ、BMP-9-Wnt/β-catenin 与BMP-9-Notch信号通路)发挥调控作用[8-16]。但BMP-9 调控干细胞成骨分化的具体机制目前尚不明确,有待进一步探究。调节BMP-9的SMAD信号通路不受Noggin影响[2,26],这是BMP-9 相比其他BMP 家族蛋白的优势之一。多项体内外研究都是借助过表达BMP-9 基因的载体来探索BMP-9 在骨形成和骨再生过程中的作用,例如质粒、腺病毒,或是搭载rhBMP-9 蛋白或腺病毒的支架材料,如琼脂糖、磷酸钙、石墨烯、胶原膜、凝胶等[7]。一些研究也可以明显看出rhBMP-9 可以有效修复大鼠的颅骨缺损。且与目前了解较多的BMP(如BMP-2)相比,BMP-9 在低剂量时便能很好地介导足够的新骨形成[24-25]。低剂量BMP-9 的应用效果表明,在局部缺损区域优化BMP 的释放动力学是控制BMP-9 介导骨再生的关键因素之一;当BMP 介导的成骨分化效率可能因BMP 摄取量较低和/或BMP 从载体中快速释放而降低时,通常需要更高剂量的BMP 掺入。未来的研究可能会涉及各种生物聚合物复合材料,如纳米材料等,从而能够更好地吸附BMP-9 以及延长其释放时间。

