间作菠萝模式下不同品种椰子根际土壤微生物多样性及群落结构特征
刘莹莹,卢丽兰,谢淑云,陈思婷,王玉萍,杨伟波
[1 中国地质大学(武汉)地球科学学院,武汉,430074;2 中国热带农业科学院椰子研究所/海南省热带油料作物生物学重点实验室,海南文昌,571339]
椰子为海南省重要的经济作物,树形较高,土地利用率低,容易滋生杂草,杂草既会增加椰园管理成本,又影响椰树生长和经济效益,椰子短期经济效益不佳,严重制约椰子产业发展[1-2]。椰子长时间定植同一位置,土壤地力易发生退化,归因于根系分泌物以及根系微生物变化。根系分泌的化感物质会累积在土壤,影响根系生长,降低椰子吸收营养的效率,最终导致椰子长势下降,抗性降低。间作可增强根系效应,改善微生物群落结构,改良土壤环境,增加作物产量[3-6]。椰子幼树与豆科牧草间种发现,椰子生长速度较单作提高20%~30%[7];与单作椰子相比,椰子间作牧草提升土壤养分有效成分含量[8];椰子常间作短期作物来增加种植收入[9-11]。不同椰子品种根系生长和发育具有不同特性,根际分泌物、根际营养、与间作作物相作也可能存在差异。目前,间作菠萝对不同品种椰子种植根际区域土壤养分及微生物的影响鲜见报道,因此开展此项研究可为椰子间作栽培模式提供参考。
1 材料与方法
1.1 试验地点
在海南省文昌市中国热带农业科学院椰子研究所的1队椰子种植基地开展试验,北纬19°45′,东经109°21′,地势平坦,属于热带季风岛屿气候,年平均温度23.9 ℃,年平均日照时数1 953.8 h,常年降雨量1 721.6 mm,砂质或砖红壤黏粉砂质土壤,种植有椰子、菠萝、番木瓜等热带经济作物。
1.2 试验设计
设置红矮椰子文椰3号单作(对照)、红矮椰子文椰3号间作菠萝、香水椰子文椰4号间作菠萝、黄矮椰子文椰2号间作菠萝1、黄矮椰子文椰2号间作菠萝2 等5个处理,椰子株行距6 m×6 m,两行椰子间种植菠萝两行,株行距50 cm×50 cm;文椰2号间作2处理分布一个片区,其他处理分布在另一个片区,两个片区直线距离1 km,所有处理管理方式一致。椰子定植3年,间作菠萝连续3年,每年菠萝定植5个月时采集土壤样品。
土样采集:每处理随机挑选区域3个,每个区域面积约40 m2,每个区域选择椰子3株,将根系挑出,抖根收集根际土壤进行混样,土样带回实验室,连续3年采集根际土壤样品风干保存备用;第3年取部分新鲜土样用于提取微生物总DNA进行高通量测序。
1.3 测定方法
1.3.1 土壤理化性质测定 风干及过筛后的土样进行理化性质分析:土壤pH值(土壤∶水=2.5∶1)采用便携式土壤pH值计,电导率采用便携电导率仪,有机质采用重铬酸钾容量-外加热法,全氮采用半微量凯氏法,碱解氮采用碱解扩散法,全磷采用HClO4-H2SO4法,速效磷采用钼锑抗比色法,全钾采用NaOH熔融-火焰光度法,速效钾采用NH4Ac浸提-火焰光度法[12],有效钙、镁含量采用DTPA提取-原子吸收分光光度法(AAS,型号SHIMADZU AA6300F)测定。
1.3.2 土壤微生物基因组DNA的提取、PCR扩增和测序 土壤微生物总DNA采用土壤基因组DNA快速抽提试剂盒(上海生工生物工程股份有限公司产)提取,提取的DNA样品送至百迈客生物技术有限公司进行测序。整个上机流程包括PCR的扩增,PCR产物混样,纯化,文库构建。
采用两轮法对细菌16S rDNA V3—V4区进行扩增,上游引物338F:5′-ACTCCTACGGGAGGCAGCA-3′;下游引物806R:5′-GGACTACHVGGGTWTCTAAT-3′;真菌ITS1扩增,上游引物序列ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′;下游引物序列ITS2:5′-GCTGCGTTCTTCATCGATGC-3′。
反应体系10 μL,基因组DNA 5~50 ng,*Vn F(10 μM)0.3 μL,*Vn R(10 μM)0.3 μL,KOD FX Neo Buffer 5 μL,dNTP(2mM each)2 μL,KOD FX Ne 0 0.2 μL。
扩增条件:95 ℃ 5 min,95 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,扩增25个循环,72 ℃延伸7 min。然后以第一次的PCR产物为模板,采用Illumina桥式PCR兼容引物,反应体系20 μL,PCR纯化引物5 μL,*MPPI-a(2 μM)2.5 μL,*MPPI-b(2 μM)2.5 μL,2×Q5HF MM 10 μL。扩增条件:98 ℃ 30 s,98 ℃ 10 s,65 ℃ 30 s,72 ℃ 30 s,扩增10个循环,72 ℃延伸5 min。PCR产物经磁珠法回收并定量。每处理样品的重复个体PCR产物进行等量混合,保证样品检测浓度,将15份混合样品送至百迈客生物技术有限公司,利用Illumina-MiSeq平台进行高通量测序。
1.3.3 数据分析 对97%相似度的OTU代表序列进行分类学分析(USEARCH,version 10.0),在界、门、纲、目、科、属水平上统计各个样品的细菌和真菌群落组成,绘制物种分类条形图以及物种丰度热图。采用16S和18S序列,重取样统一测序深度后,计算alpha的多样性指数,即Chao1、Shannon、Simpson指数和覆盖度。绘基于OTUs丰富度,绘制稀释曲线图,进行稀释分析。
Beta多样性分析:基于binary jaccard呈现物种的多样性矩阵。根据R语言绘出样本的主成分分析(PCA、NMDS)、环境因子以及样本组成的相关性分析(CCA)。通过Mothur软件完成OTU划分、alpha多样性指数计算以及稀释分析;利用Graphpad 6软件完成配对t检验及作图;采用R的vegan软件包分析PCoA和CCA。以OUT数据标准化(取对数)之后,选取数目最多的物种,基于R heatmap作图,热图每1个色块表示1个样品的1个属丰度,样品横向排列,物种纵向排列,聚类分析样品间相似性和各分类群落组成的相似性。
2 结果与分析
2.1 椰子根际土壤理化性质
从表1可以看出,与单作处理相比,间作处理显著增加土壤含水量、电导率,有机质、全氮、碱解氮、全钾、速效钾、全磷、速效磷、有效钙和有效镁含量,说明间作处理可以增加椰子根际土壤的养分含量。其中,文椰2号间作1处理土壤养分含量最高,其次是文椰2号间作2,主要可能由于椰子与菠萝根际分泌物的交叉影响。5种处理的pH值变化不大,间作处理比单作处理有所降低。间作处理中,菠萝种植和椰子互作影响土壤养分吸收和转换等作用,可能是引起土壤养分含量差异的原因。
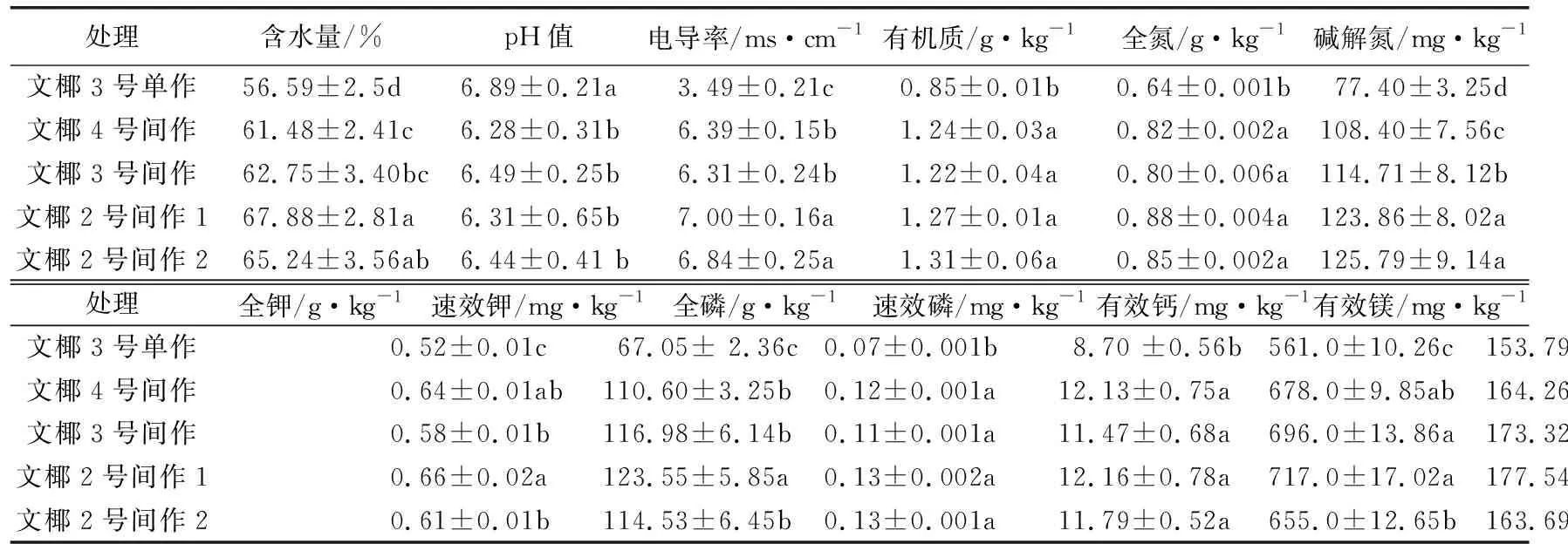
表1 不同品种椰子间作菠萝椰子根际土壤理化性质比较
2.2 椰子根际土壤微生物多样性及群落结构
2.2.1 土样测序情况 从图1和表2可以看出,15个样品稀释曲线最终平缓,测序已接近饱和,说明取样基本合理,可以正确反映15个土样中微生物群落,再结合各样品的覆盖率为0.969 1~0.998 5,测序基本包括土样全部微生物类群,可以看出微生物的群落结构组成。比较真菌和细菌稀释曲线发现,真菌稀释曲线更加平缓,并且覆盖率也更高,说明几乎全部的真菌物种被发现,而仍有少量细菌种类未被发现。
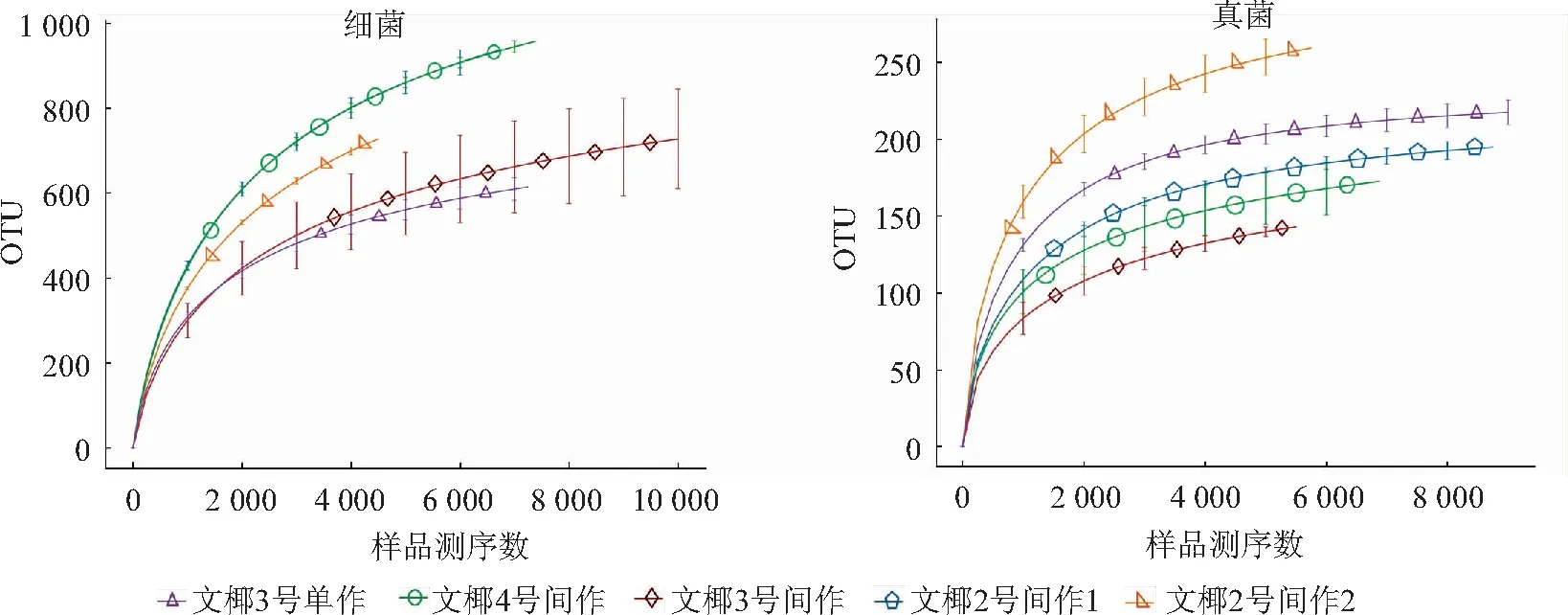
图1 不同品种椰子间作菠萝椰子根际土样稀释曲线
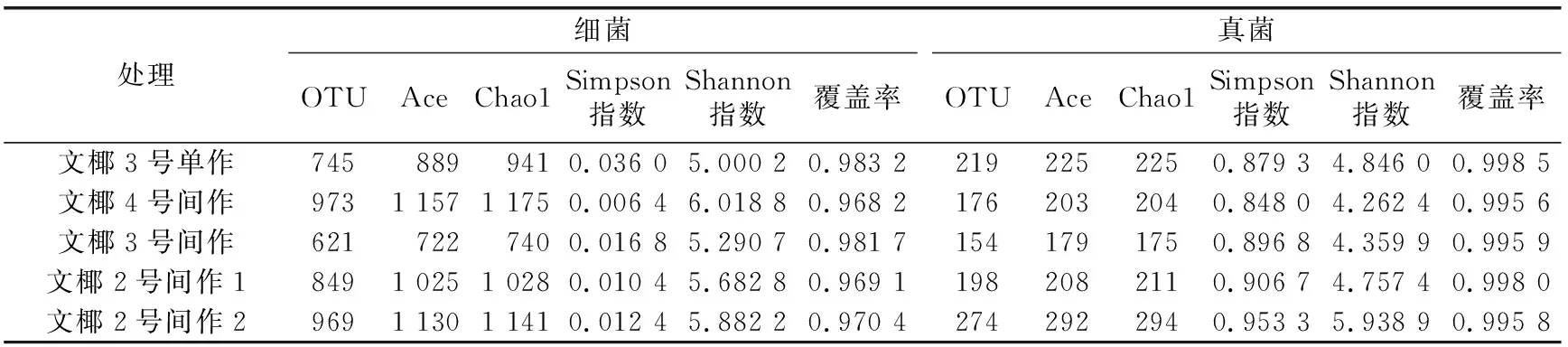
表2 不同品种椰子间作菠萝椰子根际土壤测序及alpha多样性
2.2.2 根际土壤微生物群落多样性 从表2可以看出,不同间作处理椰子根际土壤细菌的Chao1和Ace具有相同变化趋势,即从高到低依次为文椰4号间作>文椰2号间作2>文椰2号间作1>文椰3号单作>文椰3号间作。其中,文椰4号间作的土壤细菌丰度最大,文椰3号间作的土壤细菌丰度最小;文椰4号间作、文椰2号间作2和文椰2号间作1处理的Ace比文椰3号单作处理分别高30.06%、27.09%和15.28%,而文椰3号间作处理的Ace比文椰3号单作处理低18.78%,文椰4号间作、文椰2号间作2和文椰2号间作1处理的Chao1比文椰3号单作处理分别高24.85%、21.27%和9.20%,而文椰3号间作处理的Chao1比文椰3号单作处理低21.36%。文椰3号单作处理细菌的Shannon指数最小,Simpson指数最大,细菌多样性最低;而文椰4号间作处理细菌的Shannon指数最大,Simpson指数最小,土壤细菌的多样性最高;文椰4号间作、文椰2号间作2、文椰2号间作1和文椰3号间作的细菌Simpson指数比文椰3号单作处理低82.13%、65.46%、71.02%和53.33%,文椰4号间作、文椰2号间作2、文椰2号间作1和文椰3号间作的细菌Shannon指数比文椰3号单作处理高20.37%、17.64%、13.65%和5.81%。间作处理的细菌丰度除文椰3号间作外均大于单作处理,而间作处理的细菌多样性均大于单作处理,说明间作可以明显提高细菌丰度和多样性。
不同品种不同间作处理的根际土壤真菌的Chao1和Ace具有相同的变化趋势,即从高到低依次为文椰2号间作2>文椰3号单作>文椰2号间作1>文椰4号间作>文椰3号间作。其中,文椰2号间作2的土壤真菌丰度最大,文椰3号间作的土壤真菌丰度最小;除文椰2号间作2处理外,间作处理的真菌丰度均低于文椰3号单作处理,文椰2号间作2处理的Ace和Chao1比文椰3号单作处理高30.00%和30.72%,文椰2号间作1、文椰4号间作和文椰3号间作处理的Ace比文椰3号单作处理低7.31%、9.45%和20.25%,文椰2号间作1、文椰4号间作和文椰3号间作处理的Chao1比文椰3号单作处理低6.16%、9.17%和22.04%。 文椰2号间作2处理的真菌Shannon比文椰3号单作处理高22.55%,文椰2号间作1、文椰4号间作和文椰3号间作处理的真菌Shannon比文椰3号单作处理低1.83%、12.04%和10.03%;文椰4号间作处理的真菌Simpson比文椰3号单作处理低3.56%,文椰2号间作2、文椰2号间作1和文椰3号间作处理的真菌Simpson比文椰3号单作处理高8.42%、3.12%和1.99%。
15个土样中细菌OTU约是真菌的2.8~6.1倍,显著高于真菌,说明不同品种椰子间作菠萝其根际土壤微生物以细菌为主。其中,细菌OTU由大到小依次为文椰4号间作>文椰2号间作2>文椰2号间作1>文椰3号单作>文椰3号间作,真菌OTU由大到小依次为文椰2号间作2>文椰3号单作>文椰2号间作1>文椰4号间作>文椰3号间作。这表明文椰4号间作处理细菌类群最丰富,文椰2号间作2处理真菌类群最丰富,而文椰3号间作处理细菌和真菌的OTU均最低,微生物类群最贫乏。说明间作在一定程度上可以增加细菌数量以及降低真菌数量。
从图2可以看出,文椰3号单作、文椰2号间作2、文椰2号间作1、文椰3号间作和文椰4号间作独有的细菌OTU分别为71、48、19、58和32,共有的细菌OTU为352,5种处理之间相互重叠,共有细菌OTU占比大,5个处理的根际土壤细菌类群一致性较高。文椰3号单作、文椰2号间作2、文椰2号间作1、文椰3号间作和文椰4号间作独有的真菌OTU分别为108、70、57、41和47,共有的真菌OTU为51,5个处理的根际土壤真菌类群一致性较低。

图2 不同品种椰子间作菠萝椰子根际土壤细菌和真菌的OTU分布
2.2.3 根际土壤微生物群落组成 从图3和图4可以看出,15个样品高通量测序后,除未分类和其他门细菌外,数量排名前10的细菌占比64%以上。5个处理中细菌相对含量有差异,但数量排名前10的细菌门相同,包括变形菌门,相对含量26.02%~34.08%;酸杆菌门,相对含量10.02%~20.45%;拟杆菌门,相对含量4.45%~14.02%;疣微菌门,相对含量5.25%~8.25%;放线菌门,相对含量1.75%~6.58%;浮霉菌门,相对含量2.54%~6.25%;厚壁菌门,相对含量4.12%~5.24%;芽单胞菌门,相对含量0.89%~6.25%;Myxococota,相对含量2.01%~4.05%;硝化螺旋菌门,相对含量1.25%~4.02%。文椰3号单作的根际土壤拟杆菌门(4.45%)、芽单胞菌门(0.89%)相对数量显著低于其他处理(p<0.05),5个处理其他细菌门相对数量无显著性差异(p>0.05),5个处理的变形菌占比均最大。基于门水平的细菌聚类热图分析表明,文椰2号间作1、文椰2号间作2、文椰4号间作与文椰3号间作的细菌群落聚为一类,处于同一水平。文椰3号单作的细菌群落组成与其他处理相差较大,单独聚为一类。
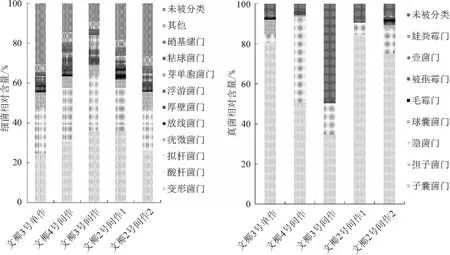
图3 不同品种椰子间作菠萝椰子根际土壤细菌和真菌门水平相对含量
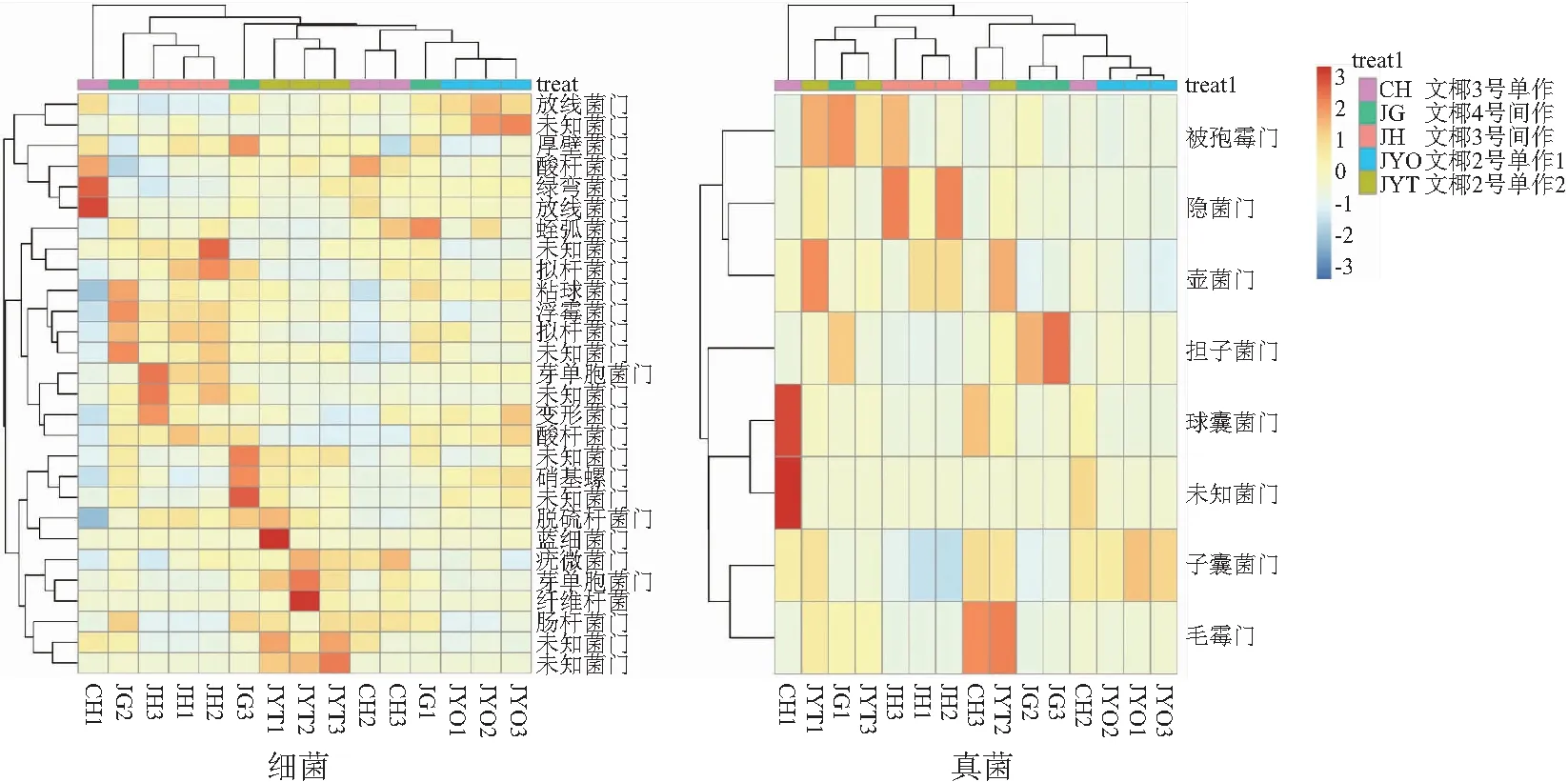
图4 不同品种椰子间作菠萝椰子根际土壤细菌和真菌门类水平聚类
15个样品高通量测序后,共发现9个真菌门。在5个处理中,未确定分类门的真菌相对丰度变化范围较大,相对含量4.56%~48.25%。除此之外,已确定的真菌门的相对含量51.75%~95.44%,说明根际土壤中已确定的真菌类群为中高水平,且5个处理中变化较大。根际土壤真菌前8个门分别为子囊菌门,相对含量34.58%~84.50%;担子菌门,相对含量0.73%~40.92%;Rozellomycota,相对含量0.71%~14.91%;球囊菌门,相对含量0.14%~7.23%;Mucoromycota,相对含量0.02%~2.82%;Mortierellomycota,相对含量0.09%~1.02%;壶菌门,相对含量0.08%~0.78%;Basidiobolomycota,相对含量0%~0.02%。不同处理的真菌组成差异性较大,各处理中子囊菌占比均最大;在文椰3号单作土壤中,优势真菌为子囊菌、担子菌和球囊菌,其余的门占比较小;文椰4号间作、文椰2号间作1、文椰2号间作2中优势真菌为子囊菌、担子菌和Rozellomycota;文椰3号间作土壤中优势真菌为子囊菌和Rozellomycota。文椰4号间作、文椰3号间作处理与文椰2号间作1、文椰2号间作2和文椰3号单作相比,Ascomycota占比显著下降(p<0.05);文椰4号间作处理与其他处理相比,担子菌占比显著增加(p<0.05);文椰3号间作处理与其他处理相比,Rozellomycota相对丰度显著增加,Basidiomycota占比显著下降(p<0.05);文椰4号间作的根际土壤中Basidiomycota的相对丰度显著高于文椰2号间作1、2和文椰3号单作、间作。
基于门水平的真菌聚类热图分析表明,文椰2号间作1、文椰2号间作2、文椰4号间作与文椰3号间作的真菌群落聚为一类,处于同一水平。文椰3号单作的真菌群落组成与其他处理相差较大,单独聚为一类。
2.3 土壤微生物群落差异性分析
从图5可以看出,对于细菌群落,文椰4号间作、文椰2号间作1和文椰2号间作2处理之间的距离较近,说明这3个处理的细菌群落相似度较高;文椰3号单作和文椰3号间作处理分别单独位于1个区域,说明文椰3号单作、文椰3号间作与其他3个处理的细菌群落组成差异较大。不同处理椰子根际土壤细菌群落差异分析中主成分1和主成分2的贡献率分别为67.07%和11.29%。
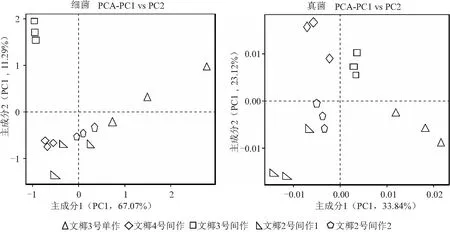
图5 不同品种椰子间作菠萝椰子根际土壤细菌和真菌主成分分析
对于真菌群落,文椰2号间作1和文椰2号间作2位于同一区域,说明同品种不同区域处理的真菌群落具有很高的相似性;其他处理各自位于1个区域,说明不同品种之间、间作和单作之间真菌群落组成差异性较大。不同处理椰子根际土壤真菌群落差异分析中主成分1(PC1)、主成分2( PC2)的贡献率分别为33.84%和23.12%。
2.4 微生物群落与土壤理化因子的关系
从表3和图6可以看出,椰子根际微生物细菌多样性与椰子根际土壤含水量、电导率,有机质、全氮、碱解氮、全钾、速效钾、全磷、速效磷、有效钙、有效镁含量间呈显著正相关(p<0.05),与根际土壤pH值间呈显著负相关(p<0.05)。椰子根际土壤微生物真菌多样性与土壤pH值、含水量、电导率,有机质、全氮、碱解氮、全钾、速效钾、全磷、速效磷含量间呈正相关(p>0.05),与有效钙、有效镁含量间呈负相关(p>0.05)。pH值与土壤含水量、电导率,有机质、全氮、碱解氮、全钾、速效钾、全磷、速效磷、有效钙、有效镁含量间呈显著负相关(p<0.05);除pH值之外,土壤养分含量间呈显著正相关(p<0.05)。

注:EC.电导率,OM.有机质,AN.碱解氮,AP.速效磷,AK.速效钾,ACa.有效钙,AMg.有效镁。
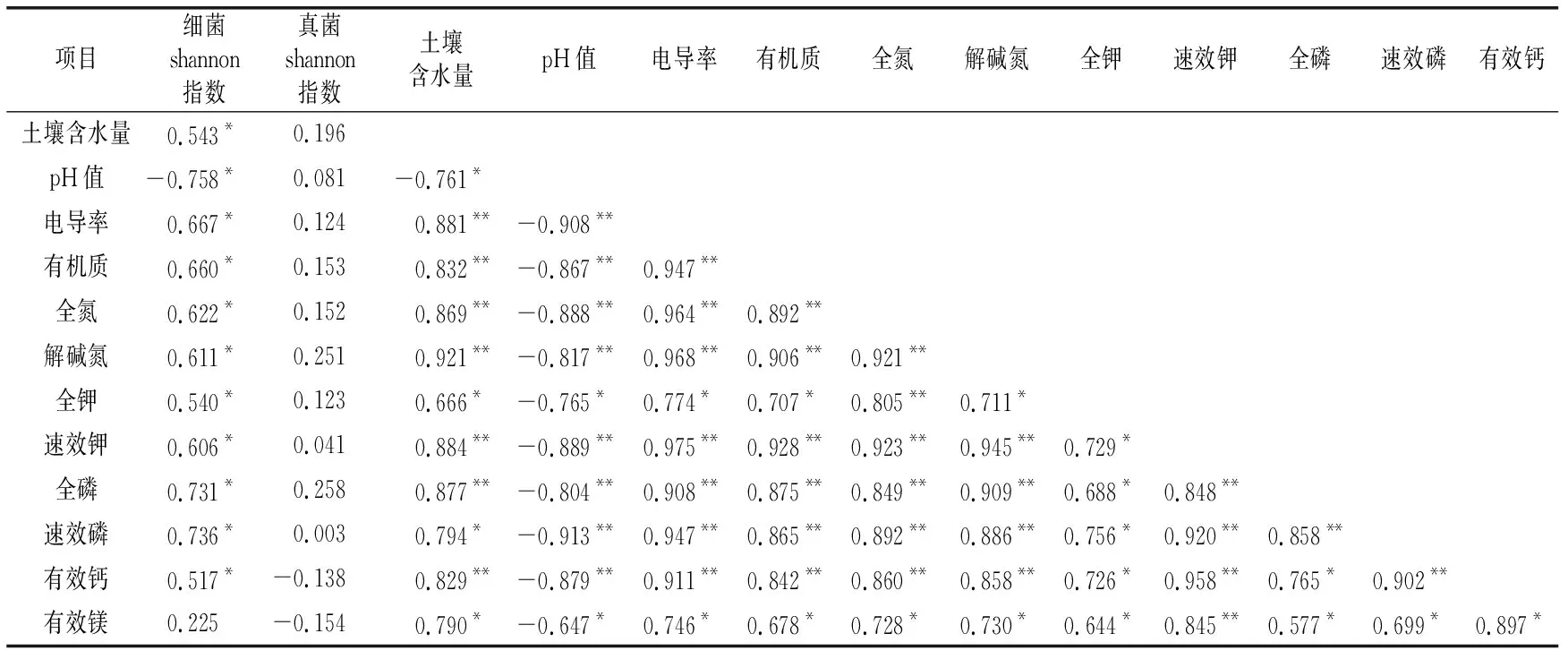
表3 不同品种椰子间作菠萝椰子根际土壤理化性质与细菌和真菌群落结构的相关性分析
冗余分析看出,pH值、有效钙、速效钾、速效磷是椰子根际土壤细菌的关键环境因子,其中pH值是文椰3号单作处理土壤细菌的最大影响因子。除有效钙、速效钾、速效磷外,文椰2号间作1处理土壤细菌还受有效镁、有机质、电导率、碱解氮的影响。文椰3号间作、文椰2号间作2、文椰4号间作处理土壤细菌受土壤理化性质的影响较小。椰子根际土壤真菌群落受pH值的影响程度最大,是文椰3号单作处理土壤真菌的最大影响因子,文椰2号间作2、1处理土壤真菌则受到有效钙、速效钾、速效磷、有效镁、有机质、电导率、碱解氮的影响。文椰4号间作、文椰3号间作处理土壤真菌受到土壤理化性质的影响较小。
3 结论与讨论
试验结果表明,椰子间作菠萝显著提高椰子根际土壤含水量、电导率,氮、磷、钾、有效钙和有效镁含量,提高椰子土壤根际细菌丰度和多样性,降低真菌丰度和多样性。不同品种椰子间作菠萝处理的根际土壤根际微生物组成及多样性存在差异。间作模式中不同品种椰子的根际土壤微生物多样性与土壤理化性质之间存在不同程度的相关性。
已有研究表明,对于土壤养分,间作的有效性比单作高,间作增加土壤供肥,改善根系对养分的吸收环境[13-15],改变土壤理化性质,使根际土壤微生物群落发生变化[16-19]。本研究中,间作处理显著增加土壤含水量、电导率,有机质、氮、钾、磷、有效钙、有效镁含量。相关性分析也表明细菌、真菌多样性和组成与这些土壤养分呈正相关(p<0.05)。说明间作菠萝可提高椰子根际土壤养分,间作对土壤微生物群落结构具有重要影响。
有机碳含量较高的作物系统促进土壤微生物多样性[20],在陆地生态系统中,土壤微生物作为重要组成单元,在众多生态过程中发挥着关键作用[21]。本研究中,相比于文椰3号单作处理,间作处理有机质含量均增加,细菌多样性增加。文椰4号间作处理的细菌丰度和多样性最高,文椰3号单作处理的土壤细菌多样性最低,这说明文椰4号间作最有利于细菌群落的生长,间作提高了土壤细菌多样性。文椰3号间作处理的土壤细菌丰度最低,且低于文椰3号单作,说明文椰3号间作降低土壤细菌丰度,不利于细菌数量增长;除此之外,其他间作模式相比于单作均可以增加根际土壤细菌丰度。可以推测椰子品种对于土壤根际细菌丰度有一定影响。
除文椰2号间作2处理外,文椰2号间作1、文椰4号间作、文椰3号间作处理真菌丰度均低于单作,即不同品种椰子对椰子根际土壤真菌生长影响不大,但是间作降低真菌丰度,这与陈慧等[22]发现植物品种对土壤根际真菌影响较大的情况相反。文椰2号间作2处理中土壤真菌丰度最大,表明只有该处理有利于真菌丰度增加,其他处理相比单作均降低真菌丰度。文椰3号间作处理的土壤细菌和真菌丰度都最小,该处理不利于根际土壤微生物生长,反而抑制其生长。微生物数量能指示土壤肥力,一般肥力越高,对应的细菌数也更高[23-24];而土壤真菌及放线菌数量越多,则表示土壤地力降低[25],作物生长受限。本研究中文椰4号间作处理可能提供最有利于椰子生长的微生态环境,而单作处理可能提供不利于椰子生长的环境。
不同处理的椰子根际土壤微生物主要以细菌为主,文椰4号间作处理的细菌类群最丰富,文椰2号间作2处理的真菌类群最丰富;文椰3号间作处理细菌和真菌的OTU均最低,微生物类群最贫乏,并且与其他处理的微生物组成存在较大差异。与单作相比,间作可以显著增加土壤细菌丰度和多样性,而降低真菌丰度和多样性,这与乔月静等[19]的研究一致。生境不一致,根系周围分布的微生物群落自然也不同[26-27]。单作的土壤微生物群落主要受pH值的影响,间作则主要受到土壤有效钙、速效磷、速效钾、有效镁、有机质、碱解氮等土壤养分的影响。
间作模式相比单作种植,根际土壤变形菌和拟杆菌占比均增加,酸杆菌占比下降,即间作模式有利于变形菌和拟杆菌生长,但不利于酸杆菌生长。相比于文椰2号间作1、2处理,文椰4号间作和文椰3号间作处理有利于拟杆菌生长,这可能主要取决于椰子品种,即文椰4号根系更有利于拟杆菌生长。文椰4号间作处理与其他处理相比,担子菌占比显著增加;文椰3号间作处理与其他处理相比,Rozellomycota丰度显著增加,Basidiomycota占比显著下降,未分类群占比大,不确定的真菌类种类高,均可能由于椰子品种是主因。
文椰4号间作、文椰2号间作1和文椰2号间作2的细菌群落相似度较高,表明文椰4号和文椰2号根际土壤微生物群落组成一致性较高,可能由于椰子品种以及间作模式共同作用引起。文椰2号间作1和文椰2号间作2处理,椰子品种相同,真菌群落相似性较高,而文椰4号间作、文椰3号间作和文椰3号单作真菌群落组成差异性较大。主成分分析也证实,主成分1和主成分2是不同品种椰子间作微生物群落的两个最大差异特征,对细菌多样性贡献率分别为67.07%和11.29%,对真菌多样性贡献率分别为33.84%和23.12%。说明不是1个因素对同品种椰子间作土壤微生物产生影响,而是多因素共同作用的效应[28]。合理间作可以优化土壤微生物群落结构,使土壤向着良性健康的方向发展,较单作具有更显著的根系效应。间作可能是促进土壤微生物多样性和功能的好方法,土壤微生物群落在间作系统中具有潜在有益作用,同时也反映作物多样性对于微生物群落的相对重要性[29-31]。

