河流原位自生古菌对四醚脂类古温度代用指标的影响
郑平波,张虎才,孙惠玲**
(1.云南师范大学 地理学部,云南省高原地理过程与环境变化重点实验室,云南 昆明 650500;2.云南大学 生态与环境科学学院,高原湖泊生态与污染治理研究院,云南 昆明 650500)
古菌膜脂类化合物(isoprenoid GDGTs,isoGDGTs)广布于海洋和陆地环境,其碳链具有独特的类异戊烯烃结构,且与甘油分子以醚键形式相连,常被认为来源于氨氧化奇古菌膜脂[1-2].IsoGDGTs 包含多种化合物,主要是依次含有0~3个五元环的GDGT-0、GDGT-1、GDGT-2、GDGT-3,及具有4 个五元环和1 个六元环的泉古菌醇(Crenarchaeol,Cren)及其异构体(Crenarchael′,Cren′).对海洋、陆地、湖泊和河流等环境中isoGDGTs 数十年的研究表明,古菌膜脂类化合物采取合成更多的五元环的策略来适应更高的环境温度,进而维持细胞膜内外环境之间稳定的质子渗透梯度[3].由于奇古菌合成的isoGDGTs 结构与温度的这种关联特征,代表GDGTs-1~3 和Cren′相对丰度变化的四醚指数(TEX86)可以良好反映表层海水温度(SST)变化[4].随后,古温度TEX86指标逐渐由海洋沉积物的应用拓展到陆相湖泊沉积物[5-6]、黄土[7]、石笋[8-9]等地质载体中.目前,TEX86指数已成为海陆古温度定量重建的常用指标[10-15].
学者们注意到,TEX86指标在海洋和湖泊环境中广泛应用的同时,不同古菌来源的isoGDGTs 彼此组分的分布特征差异显著,进而会影响TEX86信号的解译.例如,土壤通常以Group I.1b 奇古菌来源的古菌类群为主,水环境中以Group I.1a 奇古菌来源的古菌类群为主.当湖泊环境中的土壤Group I.1b 类群贡献的Cren′比例远高于水生Group I.1a类群的Cren′输入时,较多土壤来源的isoGDGTs会导致湖泊沉积物中的TEX86信号出现偏差[11,16-17].此外,厌氧的水体环境中的产甲烷古菌贡献的isoGDGTs 比例增加时,不仅会产生丰度较高的GDGT-0 组分,也会干扰TEX86的信号[18-19],导致TEX86重建的温度异常.河流是内陆环境中地表径流的重要环节,是陆相土壤生成的isoGDGTs 输入海洋或湖泊环境的重要载体.在独立的河流环境中,其原位自生的isoGDGTs 属性特征是什么?是否会影响湖泊环境中isoGDGTs 衍生的TEX86指标的温度重建?目前相关的研究工作多集中在边缘海附近的河口[20-24]环境中,内陆湖泊[11,25-26]环境的相关研究常常忽视了河流这一中间介质在土壤-河流-湖泊体系中原位自生古菌的作用及影响[27].本研究检测了抚仙湖流域表层土壤、河流表层沉积物与抚仙湖表层水体悬浮颗粒物(SPM)的isoGDGTs 相对分布特征,旨在探究TEX86在不同载体中的信号特征,检验TEX86衍生温度是否会受到河流相原位自生古菌的影响.
1 研究区域和研究方法
1.1 研究区域概况抚仙湖(24°21′~24°38′N,102°49′~102°57′E)地处亚热带高原半湿润季风气候区的云南省中部[图1(b)],属于高原贫营养型深水湖泊(海拔1 721 m,湖泊表面积211 km2,平均水深89.6 m).抚仙湖由地质构造断裂形成[28].抚仙湖出湖河流仅为海口河,尖山大河、梁王河、东大河、路局河、牛魔大河和青鱼湾等为稳定的入湖河流.此外,由于长期人类活动,流域植被覆盖率仅为27%,水土流失较严重[29].
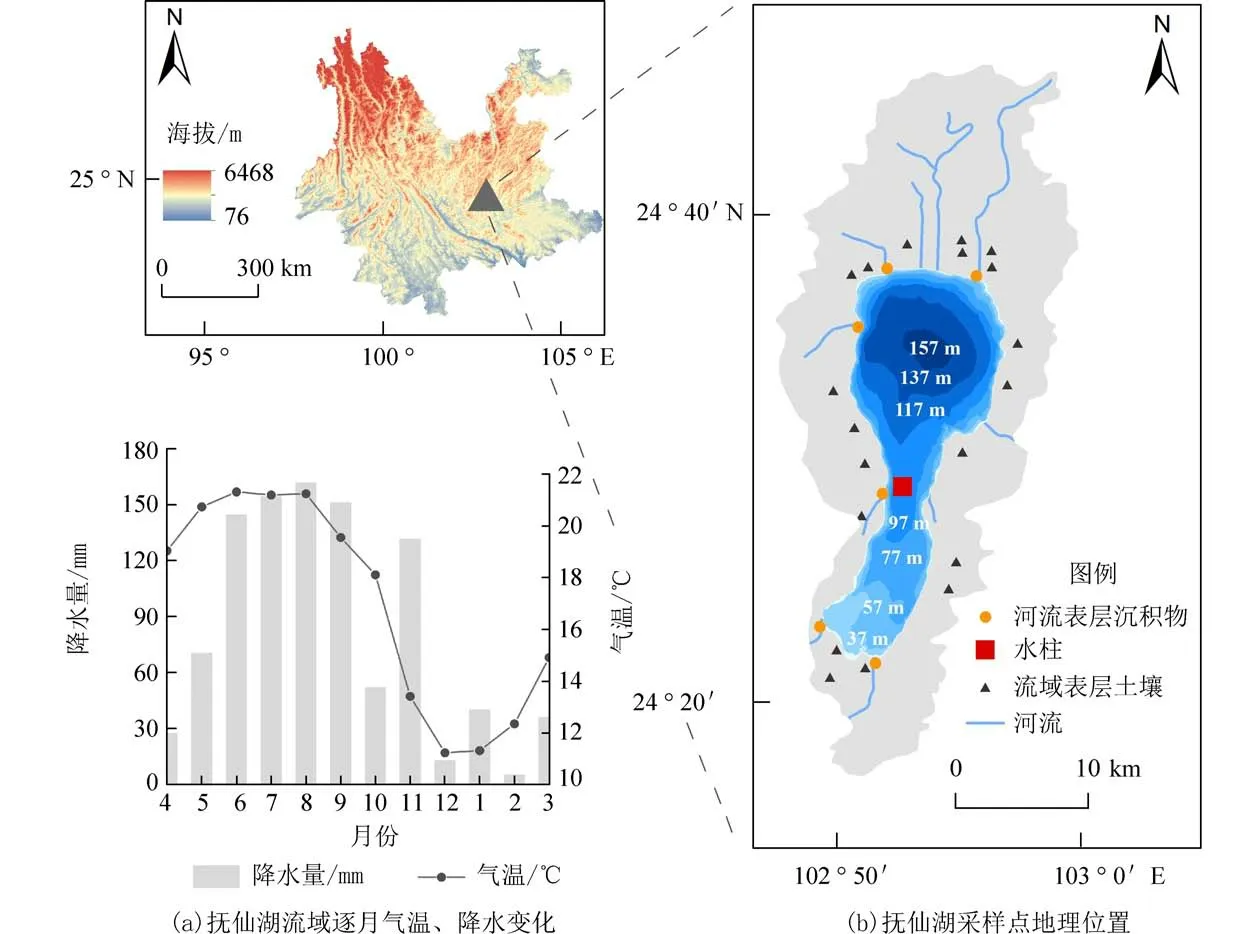
图1 抚仙湖流域2016 年4 月至2017 年3 月气温、降水逐月变化及采样点地理位置Fig.1 The monthly temperature and precipitation variations during the year cycle from April 2016 to March 2017 of lake basin and the sampling site of Lake Fuxian
抚仙湖流域多年平均气温15.6 ℃,平均降水量为879.1 mm[30].本研究采样期间(2016 年4 月至2017 年3 月)年均温和降水量分别约为17.0 ℃和980 mm,月均温在春季(3—5 月)至夏季(6—8 月)处于升高阶段,由14.9 ℃升高至21.3 ℃;秋季(9—11 月)至冬季(12 月—次年2 月)气温由19.6 ℃降至12.3 ℃[图1(a)].流域降水以夏秋季(雨季)为主,占全年降水量的81%[图1(a)].气象数据获取自国家气象科学数据中心(http://data.cma.cn/data/weatherBk.html).
1.2 样品采集2016 年7 月在抚仙湖流域分别采集了19 个表层土壤样品(0~0.5 cm)、6 个入湖河流(东大河,尖山大河,路居河,梁王河,牛魔河和青鱼湾)的表层沉积物样品(0~0.5 cm)和9 个湖泊表层水样[图1(b)].表层水样使用20 L Niskin 瓶采集,并现场用预先灼烧过的Whatman 玻璃微纤维滤纸GF/C(100 目,孔径47 mm)过滤水样获得SPM样品,并冷冻干燥后低温保存.
1.3 脂类提取、检测及计算GDGTs 的提取检测在中国地质大学武汉的生物地质与环境地质国家重点实验室完成.具体方法如下:流域表土、河流沉积物样品均冷冻干燥后研磨成粉末;水柱SPM滤纸剪碎放铜片,置于以下有机溶剂中抽提.随后用二氯甲烷(DCM)-甲醇[V(DCM)∶V(甲醇)=9∶1]溶液分别对上述样品进行超声抽提,同时在分液漏斗中用DCM 溶液萃取过滤的溶液,萃取完成后合并萃取液.萃取液用旋转蒸发仪浓缩至1~2 mL,并通过0.45 μm 疏水性聚四氟乙烯(PTFE)滤膜后,利用液相色谱-质谱联用仪(LC-MS/MS)进行检测[31].
样品溶解在300 μLV(正己烷)∶V(异丙醇)=9∶1 的混合溶液中,在样品中加入10 μL 的C46GTGTs 内标[32](质量浓度为1.157 μg/L).随后,用Agilent 1200 系列液相色谱-质谱联用仪(LCMS/MS)的APCI 源对GDGTs 进行检测,GDGTs化合物的检测条件为:A 流动相为正己烷,B 流动相为V(正己烷)∶V(异丙醇)=9∶1 的混合液.使用的色谱柱为AlltectPrevail 氰基柱(规格150 mm×ϕ2.1 mm,3 μm).洗脱梯度分为2 个阶段,0~5 min:90% A,10% B(体积分数);5~45 min:A 比例从90%线性减至82%之后冲洗色谱柱并回到100%B,流速保持0.2 mL/min,柱温箱恒温40 ℃.接下来对化合物离子化,该过程在APCI 源中进行,具体要求为APCI/MS 条件为雾化器压力413.69 kPa,雾化温度400 ℃,干燥气(N2)流速6 L/min,温度200 ℃,毛细管电压3 500 V.为提高检测信噪比和重现性,采用单离子扫描模式(SIM)对质子化离子[M+H]+进行扫描,扫描化合物质核比(m/z)为1 302、1 300、1 298、1 296、1 292、1 292′和653.上述数字 分别对 应GDGT-0、GDGT-1、GDGT-2、GDGT-3、Cren、Cren′和Archaeol的质荷比.化合物在提取离子色谱(EIC)中对相应的峰积分,获取的积分峰面积用于后续计算不同类型样品的 GDGTs化合物的含量,该含量通过在 LC-MS/MS 中检测到的具体化合物的峰面积和内标C46GTGTs 的峰面积的比值算得.在本文中,土壤和河流中的GDGTs 化合物的衍生代用指标和比值使用质量比(ng·g-1)计算,湖泊 SPM 中的 GDGTs 化合物的衍生代用指标和化合物的比值使用质量浓度(ng·mL-1)计算.
在本文中,土壤和河流中的GDGTs 化合物的衍生代用指标和比值使用质量比(ng.g-1)计算,湖泊SPM 中的GDGT s 化合物的衍生代用指标和化合物的比值使用质量浓度(ng·mL-1)计算.
依据式(1)计算得出土壤和河流中的化合物的相对丰度,
式中:X定义为isoGDGTs 中的某一个化合物;w(X)为这一化合物的质量比;w(GDGT-0)、w(GDGT-1)、w(GDGT-2)、w(GDGT-3)、w(Cren)、w(Cren′)分别为isoGDGTs 各组分(GDGT-0、GDGT-1、GDGT-2、GDGT-3、Cren、Cren′)的质量比.化合物isoGDGTs衍生的TEX86 指标的计算式如公式(2)[4]:
依据式(3)计算得出湖泊SPM 的化合物的相对丰度,
式中:X定义为isoGDGTs 中的某一个化合物;ρ(X)为这一化合物的质量浓度;ρ(GDGT-0)、ρ(GDGT-1)、ρ(GDGT-2)、ρ(GDGT-3)、ρ(Cren)、ρ(Cren′)分别为isoGDGTs 各组分(GDGT-0、GDGT-1、GDGT-2、GDGT-3、Cren、Cren′)的质量浓度.化合物isoGDGTs衍生的TEX86 指标的计算式如公式(4)[4]:
2 结果与讨论
2.1 表层土壤、河流表层沉积物及湖泊SPM 中isoGDGTs 的主要生物源为了解isoGDGTs 在抚仙湖流域的分布异同,本研究对流域表层土壤、河流表层沉积物及湖泊表层水体SPM 中isoGDGTs的相对丰度(图2)进行了对比.结果显示,一方面,河流表层沉积物isoGDGTs 相对丰度与表土和SPM差异显著,其中GDGT-0 相对丰度的均值(71.8%)远高于表土和SPM,而Cren 相对丰度的均值(18.8%)远低于表土和SPM.另一方面,表土与SPM 中isoGDGTs 的相对丰度分布模式相近,均以Cren(分别47.0%及51.2%)为主,其次为GDGT-0(分别为26.9%及28.6%),但表土Cren′(3.6%)相对丰度显著高于湖泊(0.5%).
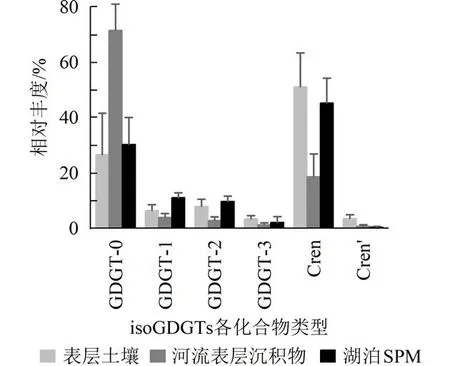
图2 表层土壤、河流表层沉积物和湖泊水柱 SPM 各isoGDGTs 化合物的相对丰度(误差棒为标准误差)Fig.2 The relative abundances of individual isoGDGTs in soils,river surface sediments and SPM of lake water(The error bars show the standard error)
前人研究表明,产甲烷古菌以GDGT-0 为主要的膜脂成分[11],而奇古菌isoGDGTs 以Cren 为主要组分[3].因此,当化合物GDGT-0 与Cren 的质量比或质量浓度比的比值(GDGT-0/Cren)大于2 时,样品通常以厌氧产甲烷古菌贡献的isoGDGTs 为主[11].河流表层沉积物的GDGT-0/Cren 值均大于2(图3),均值为5.3,指示厌氧产甲烷古菌可能在河流古菌群落中占主导.相反,表土和湖泊中的GDGT-0/Cren 均值分别为0.3 和0.7,表明两者受厌氧产甲烷古菌活动的影响相对较弱.
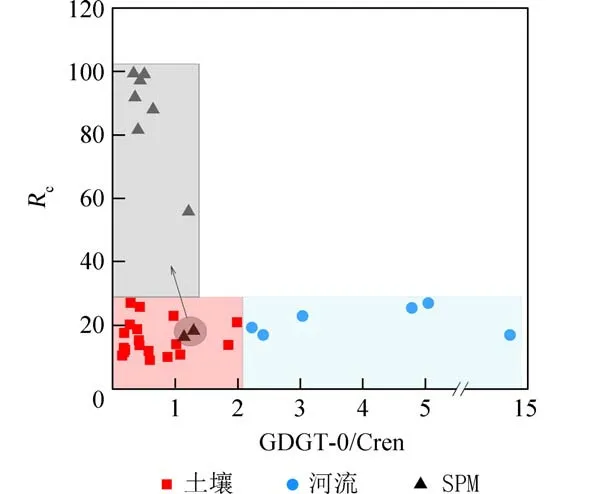
图3 对比GDGT-0/Cren 和Rc 在流域表土(红色区域)、河流表层沉积物(蓝色区域)和湖泊SPM(灰色区域)中的分布Fig.3 The comparison values distributions of GDGT-0/Cren and Rc indexes in the surface soils(red area),river surface sediments(blue area) and lake SPM(grey area)
奇古菌广布于土壤和湖泊环境中,但土壤和湖泊一般分别由奇古菌中的Group I.1b[33-34]和Group I.1a 类群占主导[35].上述两种古菌类型均以Cren为主要isoGDGTs 成分,不同的是,Group I.1b 类群的Cren′的相对丰度远高于Group I.1a 类群[36-38].因此,化合物Cren 及其异构体Cren′的质量比或质量浓度比的比值(Rc)在土壤和湖泊中通常分别小于25 和远大于50[39-40].抚仙湖表土中Rc指标均值15.6,基本小于25(图3),指示表土isoGDGTs 可能来源于奇古菌Group I.1b.在表层水SPM 中,Rc均值为72.0,指示其isoGDGTs 主要来自于Group I.1a 奇古菌(雨季9—10 月除外,后述).河流表层沉积物Rc值分布(均值为21.4)与流域表土(均值15.6)相近,表明河流中同样存在强烈的陆源土壤Group I.1b 奇古菌isoGDGTs 的信号.这与抚仙湖流域植被覆盖度较低(27%)、土壤侵蚀较强[41-43]的事实相符.
综上所述,在isoGDGTs 来源方面,流域表土可能主要来自于Group I.1b 奇古菌;河流表层沉积物中的isoGDGTs 部分来源于陆源Group I.1b 奇古菌,但以水体原位生产的厌氧产甲烷古菌的贡献为主.湖泊表层水体SPM 中的isoGDGTs 主要来自Group I.1a 奇古菌的贡献.
2.2 厌氧产甲烷古菌isoGDGTs 对河流表层沉积物温度重建的影响作为承接了流域侵蚀土壤的河流表层沉积物,其TEX86值整体上显著低于表土TEX86(图4).考虑到GDGT-0/Cren 指标指示河流表层沉积物中以厌氧产甲烷古菌为主要菌群,这种TEX86值显著偏低的现象可能与河流中该类群古菌影响有关.生物标志化合物Archaeol 广泛存在于奇古菌和广古菌膜脂中[44],但广古菌的Archaeol丰度高于奇古菌[45].尤其在盐度变化不大[46]的厌氧环境,如饱水土壤[47]、泥炭中[48-50],Archaeol 首要来源于厌氧产甲烷古菌,并被用于指示厌氧产甲烷古菌的生物量[47-48,50-51].因此,可通过Archaeol与isoGDGTs 各化合物的相关性分析判别厌氧河流[52]中产甲烷古菌对isoGDGTs 的影响,进而分析其对河流表层沉积物TEX86指标的影响[21,50,53].
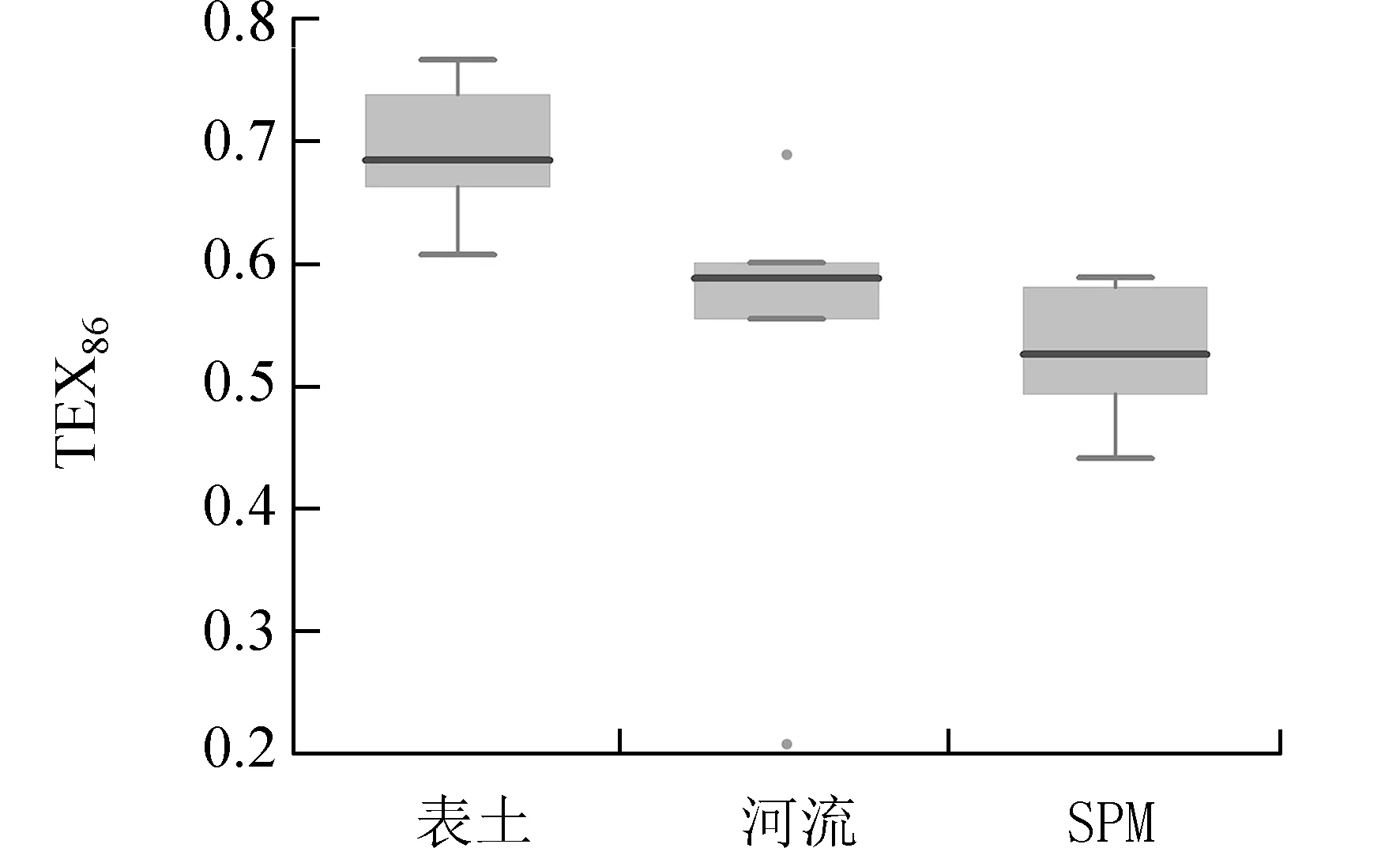
图4 流域表土、河流表层沉积物及湖泊表层SPM 载体中TEX86 值的对比Fig.4 The comparison of TEX86 values in surface soils,river surface sediments and lake SPM
结果显示,河流表层沉积物中仅有GDGT-0(r=0.87,P<0.01)和GDGT-1(r=0.99,P<0.001)与Archaeol 显著且正相关(图5),表明他们具有高度的生物同源性,即,均主要来自厌氧产甲烷古菌.鉴于GDGT-1 组分与产甲烷古菌正相关(图5).可以推测高丰度的产甲烷古菌可能导致GDGT-1 相对丰度的增加,进而增大TEX86的分母值,使TEX86值降低.这种推测可以解释河流表层沉积物中TEX86的值为何显著低于流域表层土壤(图4).
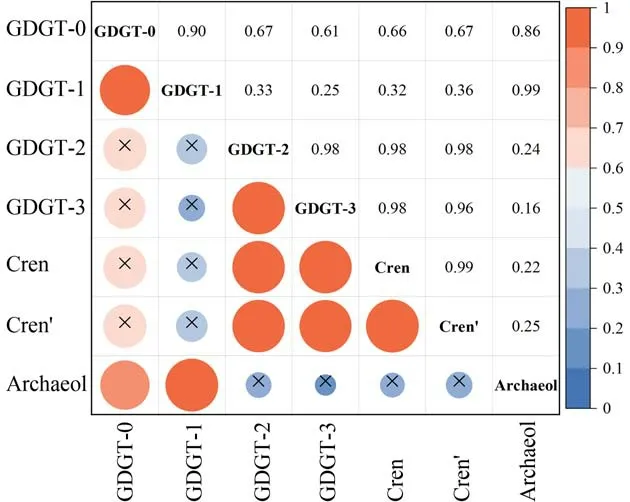
图5 河流表层沉积物Archaeol 与各isoGDGTs 质量比(ng/g)之间的相关性Fig.5 The correlation between Archaeol and individual isoGDGT concentrations(ng/g) in river surface sediments
此外,相对于GDGT-1,GDGT-0 与Archaeol 相关性更弱(图5),这可能指示了河流中存在其他的古菌对GDGT-0 组分的额外贡献.GDGT-0 生物来源广泛,除厌氧产甲烷古菌、奇古菌外,GDGT-0 还会由嗜甲烷古菌、深古菌等合成[44].然而,由于嗜甲烷古菌产生GDGTs-0~2 的比例大致相等[54-56],而河流沉积物中高丰度的GDGT-0 及低丰度的GDGTs-1~2,表明嗜甲烷古菌在河流沉积物中isoGDGTs 的贡献可能较为有限;而深古菌可能并不主要生成GDGT-0 以外的isoGDGTs 组分[25,50,55,57],因而它对TEX86指标的潜在影响可以忽略.总之,这种TEX86值显著偏低的结果可能主要与厌氧产甲烷古菌影响有关.
事实上,近年对抚仙湖微生物群落结构的宏基因调查结果发现[58],抚仙湖湖上层(富氧)的水柱剖面的产甲烷广古菌以Methanonatronarchaeia 为主,该古菌类群可占古菌群落丰度29.87%(除奇古菌外),并且该古菌丰度随深度增加显著下降.该现象与Methanonatronarchaeia 的厌氧(anaerobic)生理特征相悖[59-62],指示着该古菌在抚仙湖水体中是外源输入.对Methanonatronarchaeia 的纯培养研究发现[61],该古菌核心脂质有高丰度的Archaeol,并且在isoGDGTs 中只检测到GDGT-0 和GDGT-1 的存在.结合入湖河流的Archaeol 与GDGT-0、GDGT-1 丰度正相关(图5),以及抚仙湖湖上层异常高丰度的Methanonatronarchaeia,可以推测本文在抚仙湖入湖河流中的产甲烷古菌信号可能主要来源于Methanonatronarchaeia,并且该古菌可能通过大量贡献GDGT-1,导致了河流表层沉积物中的TEX86值偏低.
与抚仙湖流域河流表层沉积物的结果类似,一些土壤[49-50,63]的研究表明,当样品中存在明显的厌氧产甲烷古菌影响时会伴随着TEX86值的偏低.譬如,在东亚、东南亚及欧洲水稻土的研究中[63],淹水期的稻田土壤的GDGT-0/Cren 升高至周边土壤的3~27 倍,指示强烈的厌氧产甲烷古菌活动;相应地,其TEX86均值普遍降至不足周边土壤的一半,并且GDGT-1 的相对丰度变化是控制淹水期水稻土中四醚指数值变化的关键.仍需注意,可能由于海洋-河口古菌群落结构的复杂变化[20,50],入海河口与陆地厌氧产甲烷古菌对TEX86的影响并不完全一致.如,福建九龙江河口有较强厌氧产甲烷古菌活动[21],但TEX86变化不显著[23];在厌氧产甲烷古菌活动强烈的珠江河口,TEX86值偏高[20,22].尽管如此,鉴于高丰度厌氧产甲烷古菌广泛造成TEX86值出现偏差[6,44].因此,推测Archaeol 与GDGT-1 质量比相关性变化可能也存在于其他陆地河口以及饱水厌氧土壤中,并指示着厌氧产甲烷古菌对TEX86的影响.
2.3 河流携带的isoGDGTs 在湖泊表层水SPM中的表现抚仙湖全年GDGT-0/Cren 小于阈值2,Rc值在一年中的大部分时期都大于阈值50,表明抚仙湖整体受河流输入的isoGDGTs 的影响不大(图6).相较于土壤与河流中的TEX86值的分布,SPM 具有更低的TEX86值(图4),可能指示了湖泊内部来源的isoGDGTs 变化.不过,GDGT-0/Cren与Rc值在表层SPM 中呈现显著的季节变化(图6).在降雨集中的8—10 月,GDGT-0/Cren 迅速升高至1.3,而Rc值快速降低至20 左右,表现出显著反相位关系,说明河流自生来源的产甲烷古菌及土壤来源的Group I.1b 奇古菌的isoGDGTs 信号可能在雨季有一定程度的表达,这种现象也可见于其他研究中[23,27,64].不同的是,湖泊GDGT-0/Cren 值在雨季小于指示产甲烷古菌显著影响的阈值2,而Rc值在9—10 月达到指示陆源Group I.1b 古菌影响的阈值25,表明相对于河流中厌氧产甲烷古菌的信号,陆源isoGDGTs 信号在湖泊中得到更好的表达.关于河流中主要携带的是产甲烷古菌信号,为何湖泊SPM 却主要表达了陆源Group I.1b 奇古菌信号.一方面,可以推测湖泊SPM 中的Group I.1a 古菌以合成Cren 为主(图2),从而削弱了GDGT-0/Cren 的信号;另一方面,Group I.1a 奇古菌合成的Cren′比例相对于土壤Group I.1b 合成的Cren′极低[35-36,40],因而代表土壤Group I.1b 奇古菌信号的Rc值在雨季相对于GDGT-0/Cren 更容易得到表达.

图6 湖泊表层水SPM 的GDGT-0/Cren 和Rc 指标值的逐月变化Fig.6 The monthly value variations of the GDGT-0/Cren and Rc indexes in SPM of lake surface water
3 结论
通过分析对比抚仙湖流域表层土壤、河流表层沉积物与抚仙湖表层水体悬浮颗粒物(SPM)的isoGDGTs 相对丰度异同,本研究得到了河流厌氧产甲烷古菌合成的isoGDGTs 如何影响TEX86指标的一些认识,可为TEX86指标更好地应用于湖泊古温度重建提供参考.
(1)抚仙湖流域表层土壤isoGDGTs 主要来源于Group I.1b 奇古菌;河流表层沉积物中isoGDGTs虽然受到一定程度的陆源土壤输入的影响,但自生的厌氧产甲烷古菌为其主要生物源;湖泊表层水体SPM 中的isoGDGTs 以Group I.1a 奇古菌为主.
(2)河流表层沉积物中厌氧产甲烷古菌丰度(Archaeol)与GDGT-1 含量显著正相关,表明其生物来源的同源性.即,河流厌氧产甲烷古菌(如Methanonatronarchaeia 类群)可以导致GDGT-1 相对丰度的增加,进而使TEX86值下降,最终导致河流表层沉积物TEX86值显著低于表层土壤.
(3)在雨季,湖泊表层水SPM 一定程度表达了河流输入的isoGDGTs 信号,其余大部分时间,抚仙湖中isoGDGTs 指示的是湖泊内源古菌的信号.
(4)总之,本研究丰富了厌氧产甲烷古菌作用于TEX86古温度代用指标的影响方式的认知,即,河流厌氧产甲烷古菌(如,Methanonatronarchaeia)可能导致湖相环境中GDGT-1 丰度的升高和TEX86值的下降.

