镍/锌协同催化γ-酮酸的不对称氢化反应研究
邓 耀,周冰洁,刘子秀,张科阳,李泓江,陈景超**,樊保敏
(1.云南民族大学 民族医药学院,云南 昆明 650500;2.云南民族大学 化学与环境学院,云南 昆明 650500)
γ-戊内酯(γ-valerolactones)是一类有着广泛应用的有机化合物.γ-戊内酯及其衍生物[1-2]表现出突出的生物活性,是许多手性药物合成中的重要中间体,也是许多天然产物和生物活性分子的关键结构组成部分之一,如:抗生素[3]、抗癌[4]和抗肿瘤[5-7]化合物(图1).因此,γ-戊内酯类药物分子的开发受到了广泛关注,是药物合成中的热点分子之一.同时,γ-戊内酯也是一种重要的化学工业原料,在工业原材料、医药中间体以及新能源材料方面有着广泛的应用,并且需求巨大.具有手性的γ-戊内酯更具有应用价值,用于制备具有光学活性γ-戊内酯的实用和有效方法的发展引起了学术和工业实验室的浓厚兴趣.迄今为止,已经开发了一些用于不对称合成的方法,包括氢化[8-11],硅氢化[12],不对称转移氢化[13],酶催化[14]等近年来合成手性γ-戊内酯的方法相继被报道.这些方法中,不对称氢化因其具有合成效率高、立体选择性好、操作简便、合成成本低廉、产物易纯化等优势,无疑是合成这类手性分子的强大且实用的方法.不对称催化反应一般需要手性配体或手性催化剂来控制反应的立体选择性,反应的收率也主要取决于手性配体及手性催化剂的催化活性.因此,寻找新型高效的手性配体或催化剂是不对称催化氢化反应研究的关键和核心.
自1978 年第一代 Ru-BINAP 催化剂得到开发以来,钌催化前手性酮的不对称氢化反应成为了合成手性醇及其衍生物的主要方法[15-18],几十年里,贵金属 Rh、Ir、Pd 对酮(C=O)的不对称氢化等方面相继取得了巨大进展,其表现出优异的催化活性和对映选择性[19-23].2020 年南开大学周其林、朱守非团队发展了一类手性螺环膦氮配体和铱的络合物催化剂,并成功将其用于多种不饱和γ-和δ-酮酸的不对称催化氢化,在温和条件下获得很高的收率和对映选择性.同年该课题组又报道了一例铱与手性螺环配体络合物催化的脂肪族γ-酮酸的不对称氢化反应,反应温度温和、催化剂载量低、收率和对映选择性高达99%,反应的转化数达100 000[24-25].2019 年,Ohkuma,Lu 和Zhang 等[26-28]报道了高活性Ru(Ⅱ)催化剂催化的γ-酮酸或酮酸酯的不对称氢化.本课题组近年来一直致力于构建过渡金属/路易斯酸协同催化体系,在2021 年实现了使用钯/锌协同催化的γ-酮酸不对称氢化环化反应[27],合成了具有高度光学纯度的二氢呋喃-2(3H)-酮类化合物.目前所报道的γ-酮酸或酮酸酯的不对称氢化都依赖于Ru、Ir、Pd 过渡金属催化剂,然而这些金属的储量稀少、价格昂贵和毒性限制了它们在更大规模不对称氢化中的应用,因此很有必要开发储量丰富、价格低廉且无害的催化剂来替代它们.
与贵金属相比,地球中含量丰富的第一系列过渡金属铁、钴、镍,由于成本较低、环境友好,毒性相对较低等特点,近年来在不对称加氢中逐渐越来越受到青睐.此外,铁、钴、镍过渡金属具有相对较小的离子半径和独特的电子特性,使其在不对称催化中具有不寻常的活性.其中,镍催化受到了更多的关注,近年来镍催化在不对称氢化反应中取得了不错的进展.2019 年,张万斌课题组[29]报道了使用金属镍与双磷配体形成的络合物催化的亚胺进行不对称氢化反应,收率和对映选择性最高可达 99%,得到了多种手性胺化合物.我们课题组在报道了钯锌协同催化对γ-酮酸的不对称氢化反应之后,注意到镍催化酮的不对称氢化报道很少,再考虑到镍钯位于同一副族,很可能对酮的不对称氢化反应也有较好的催化活性.因此我们成功建立了镍锌协同催化体系,该催化体系被成功应用于γ-酮酸的不对称氢化,最终以良好至优秀水平的收率和对映选择性得到了一系列高光学纯度的γ-戊内酯.
1 实验部分
1.1 仪器和试剂电热鼓风干燥箱;手性色谱柱(AD-H、As-H);暗箱式紫外分析仪;奥豪斯电子天平;循环水式真空泵;低温冷却液循环泵;旋转蒸发仪;低温控温搅拌器;电磁加热搅拌器;高效液相色谱仪;VG Autospec-3000 型质谱仪;Brucker 400 MHz核磁共振仪;熔点测定仪;米开罗那真空无水无氧手套箱;旋光仪(美国鲁道夫公司).
干燥溶剂:DCM、DCE 经过氢化钙加热回流1 d后收集馏分所得.THF、MTBE、甲苯、1,4-二氧六环等醚类溶剂是加入金属钠和指示剂二苯甲酮后冷凝回流直至溶剂变蓝即可使用.甲醇、乙醇等溶剂则是购买的超干溶剂.金属、配体及实验用常规试剂购买自乐妍公司、安耐吉公司、阿拉丁公司等.γ-酮酸部分购买于安耐吉公司,其余由实验室自行合成.
1.2 合成方法手性γ-戊内酯类化合物 2a~2z 的合成.以γ-酮酸1a 为底物,通过改变反应的温度、配体、溶剂等条件对反应条件进行了筛选,优化反应过程如下:
在米开罗那真空无水无氧手套箱中,准确称量Ni(OAc)4.H2O(0.01 mmol)和配体(R,R)-QuinoxP*(0.012 mmol),装入含有磁力搅拌子的干燥耐压反应管中,用移液枪移取1,4-dioxane(1 mL) 加入反应管中,室温下在手套箱内电磁力搅拌器搅拌30 min 后,准确称量γ-酮酸底物(0.2 mmol)和添加剂Zn(OTf)2(0.02 mmol),最后再加入1,4-二氧六环(1 mL).将上述反应管移出手套箱装入高压反应釜中,充入氢气并连续置换3 次,最后充入的氢气压为3 MPa,将充好氢气的高压反应釜放入70 ℃的油浴锅中加热搅拌.待反应完全后,TLC(薄层色谱法)检测,减压浓缩除去反应溶剂,经石油醚-乙酸乙酯(体积比5∶1)柱层析得到产物.目标化合物称重计算产率,用HPLC 手性柱测量对映选择性,400 MHz 核磁共振仪确定目标化合物结构.最终得到手性γ-戊内酯类化合物2(2a~2z),其绝对构型通过与文献报道[10,24-28]对比HPLC 图谱确定,反应结果如图2 所示.

图2 底物适用性研究Fig.2 Scope of substrates
(S)-5-苯基二氢呋喃-2(3H)-酮(2a):无色液体,31 mg,收率:96%,92%ee;=-13.33(c=0.14,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.49~7.30(m,5H),5.58~5.46(m,1H),2.77~2.59(m,3H),2.20(ddd,J=12.8,8.2,5.2 Hz,1H);13C NMR(100 MHz,CDCl3)δ:176.9,139.4,128.8,128.5,125.3,81.3,31,29.0.ee值用高效液相通过手性柱AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=11.0 min,tmajor=13.0 min.
(S)-5-(4-氟苯基)二氢呋喃-2(3H)-酮(2b):无色液体,33 mg,收率:96%,90%ee;=-12.22(c=0.12,CH2Cl2) .1H NMR(400 MHz,CDCl3)δ:7.29~7.21(m,2H),7.05~6.96(m,2H),5.41(dd,J=8.3,6.0 Hz,1H),2.64~2.53(m,3H),2.16~2.03(m,1H);13C NMR(100 MHz,CDCl3)δ:175.7,161.6,134.1,126,114.7,79.7 30.0,28.0;19F NMR(376 MHz,CDCl3)δ:-113.4.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=16.7 min,tmajor=19.7 min.
(S)-5-(4-氯苯基)二氢呋喃-2(3H)-酮(2c):无色液体,38 mg,收率:95%,90%ee;=-5.08(c=0.059,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.40~7.34(m,2H),7.31~7.25(m,2H),5.48(dd,J=8.1,6.1 Hz,1H),2.74~2.60(m,3H),2.22~2.06(m,1H);13C NMR(100 MHz,CDCl3)δ:176.6,137.9,134.3,129.0,126.7,80.5,31.0,28.9.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=80/20,1.0 mL/min,λ=254 nm;tminor=15.3 min,tmajor=18.1 min.
(S)-5-(4-溴苯基)二氢呋喃-2(3H)-酮(2d):白色固体,45.6 mg,收率:95%,90%ee,=-8.91(c=0.131,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.56~7.51(m,2H),7.24~7.19(m,2H),5.47(dd,J=7.9,6.4 Hz,1H),2.71~2.61(m,3H),2.18~2.09(m,1H);13C NMR(100 MHz,CDCl3)δ:176.5,138.5,132.0,127.0,122.4,80.4,30.9,28.8.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=11.5 min,tmajor=13.8 min.
(S)-5-(3-氟苯基)二氢呋喃-2(3H)-酮(2e):无色液体,31 mg,收率:81%,77%ee;=-13.75(c=0.16,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.36(td,J=7.9,5.9 Hz,1H),7.11(d,J=7.7 Hz,1H),7.08~7.00(m,2H),5.50(dd,J=9.8,4.8 Hz,1H),2.74~2.63(m,3H),2.24~2.11(m,1H);13C NMR(100 MHz,CDCl3)δ:176.5,163.0(d,J=248.46 Hz),142.0(d,J=7 Hz),130.5(d,J=8 Hz),120.8(d,J=3 Hz) 115.4(d,J=21 Hz),112.5(d,J=22 Hz),80.3,30.9,28.7;19F NMR(376 MHz,CDCl3)δ:-112.0,-112.0,-112.0.ee值用高效液相通过手性柱 AS-H(25 cm×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ==210 nm;tminor=7.4 min,tmajor=8.5 min.
(S)-5-(3-氯苯基)二氢呋喃-2(3H)-酮(2f):无色液体,38 mg,收率:78%,85%ee;=-54.17(c=0.016,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.36~7.29(m,3H),7.22(ddd,J=5.5,3.3,1.2 Hz,1H),5.50~5.45(m,1H),2.73~2.62(m,3H),2.23~2.09(m,1H);13C NMR(100 MHz,CDCl3)δ:176.5,141.5,134.8,130.2,128.6,125.5,123.4,80.2,30.9,28.8.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=10.8 min,tmajor=12.9 min.
(S)-5-(4-(三氟甲基)苯基)二氢呋喃-2(3H)-酮(2g):无色液体,45 mg,收率:82%,85%ee,=-15.04(c=0.133,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.66(d,J=8.2 Hz,2H),7.47(d,J=8.2 Hz,2H),5.60~5.54(m,1H),2.79~2.62(m,3H),2.23~2.11(m,1H);13C NMR(100 MHz,CDCl3)δ:176.4,143.5,130.7,125.7,122.5,80.2,30.9,28.7;19F NMR(376 MHz,CDCl3)δ:-62.6.ee值用高效液相通过手性柱 AD-H(25 cm ×ϕ0.46 cm ID)测定,条件 为:V(正己烷)/V(异丙醇)=85/15,1.0 mL/min,λ=254 nm;tminor=19.9 min,tmajor=25.5 min.
(S)-5-(2-(三氟甲基)苯基)二氢呋喃-2(3H)-酮(2h):无色液体,43 mg,收率:83%,70%ee,=-17.56(c=0.093,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.68(d,J=7.8 Hz,1H),7.63(dd,J=4.6,3.7 Hz,2H),7.50~7.42(m,1H),5.88(dd,J=10.9,4.0 Hz,1H),2.79~2.67(m,3H),2.07(ddt,J=10.8,8.8,7.2 Hz,1H);13C NMR(100 MHz,CDCl3)δ:176.7,138.6,132.6,128.4,126.8,126.1,125.5,122.8,77.5,31.9,28.8;19F NMR(376 MHz,CDCl3)δ:-58.6.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=60/40,1.0 mL/min,λ=210 nm;tminor=6.1 min,tmajor=6.9 min.
(S)-5-(4-甲氧基苯基)二氢呋喃-2(3H)-酮(2i):白色固体,34.5 mg,收率:90%,30%ee,=+5.75(c=0.029,CH2Cl2),熔点144~146℃.1H NMR(400 MHz,CDCl3)δ:7.27~7.22(m,2H),6.90(t,J=5.7 Hz,2H),5.44(dd,J=8.2,6.2 Hz,1H),3.80(s,3H),2.67~2.55(m,3H),2.22~2.12(m,1H);13C NMR(100 MHz,CDCl3)δ:177.0,159.8,131.2,127.0,114.1,81.4,55.3,30.9,29.2.HRMS(ESI) C11H12O3,[M+H]+m/z:193.085 9,实测:193.0860.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=20.2 min,tmajor=25.6 min.
(S)-5-(5,6,7,8-四氢萘-2-基)二氢呋喃-2(3H)-酮(2j):无色液体,13.2 mg,收率:34%,72%ee,=-0.82(c=0.122,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.10~7.06(m,1H),7.05~7.02(m,2H),5.47~5.42(m,1H),2.76(t,J=6.4 Hz,4H),2.68~2.57(m,3H),2.26~2.14(m,1H),1.83~1.77(m,4H);13C NMR(100 MHz,CDCl3)δ:177.1,137.6,136.4,129.5,126.1,122.5,81.4,77.4,77.0,76.7,30.9,29.4,29.1,23.1.HRMS(ESI) C14H16O2,[M+H]+m/z:217.122 3,实测:217.1224.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=10.6 min,tmajor=14.6 min.
(S)-5-([1,1′-联苯基]-4-基)二氢呋喃-2(3H)-酮(2k):白色固体,47.9 mg,收率:95%,90%ee,=-6.25(c=0.032,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.64~7.57(m,4H),7.48~7.34(m,5H),5.57(dd,J=9.2,4.9 Hz,1H),2.75~2.65(m,3H),2.29~2.20(m,1H);13C NMR(100 MHz,CDCl3)δ:176.9,141.5,140.5,138.3,128.9,127.6,127.1,125.8,81.1,31.0,29.0.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=10.8 min,tmajor=21 min.
(S)-5-(4′-甲基-[1,1′-联苯基]-4-基)二氢呋喃-2(3H)-酮(2l):白色固体,49 mg,收率:99%,87%ee,=-14.38(c=0.102,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.64~7.57(m,2H),7.49(d,J=8.1 Hz,2H),7.39(d,J=8.2 Hz,2H),7.27(s,1H),5.59~5.53(m,1H),2.74~2.64(m,3H),2.29~2.20(m,1H);13C NMR(100 MHz,CDCl3)δ:177.0,137.5,134.4,131.7,130.3,130.0,128.2,124.4,124.2,120.7,81.2,31.0,29.1.HRMS(ESI) C17H16O2,[M+Na]+m/z:275.104 3,实测:275.1039.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=11.1 min,tmajor=13.3 min.
(S)-5-(4′-乙基-[1,1′-联苯基]-4-基)二氢呋喃-2(3H)-酮(2m):白色固体,51.9 mg,收率:98%,95%ee,=-10(c=0.12,CH2Cl2),熔点113~115℃.1H NMR(400 MHz,CDCl3)δ:7.63~7.59(m,2H),7.54~7.49(m,2H),7.39(d,J=8.1 Hz,2H),7.28(d,J=8.3 Hz,2H),5.58~5.54(m,1H),2.73~ 2.65(m,5H),2.29~ 2.20(m,1H),1.29(d,J=7.6 Hz,3H);13C NMR(100 MHz,CDCl3)δ:176.9,143.8,141.5,137.9,128.4,127.3,127.0,125.8,81.1,31.0,29.0,28.5,15.6.HRMS(ESI) C18H18O2,[M+Na]+m/z:289.119 9,实测:289.1198.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=90/10,1.0 mL/min,λ=254 nm;tminor=22.5 min,tmajor=25 min.
(S)-5-(4′-氟-[1,1′-联苯基]-4-基)二氢呋喃-2(3H)-酮(2n):白色固体,45.2 mg,收率:88%,92%ee,=-10.80(c=0.108,CH2Cl2),熔点 163~165 ℃.1H NMR(400 MHz,CDCl3)δ:7.59~7.51(m,4H),7.40(d,J=8.2 Hz,2H),7.18~7.10(m,2H),5.60~5.52(m,1H),2.75~2.65(m,3H),2.28~2.19(m,1H);13C NMR(100 MHz,CDCl3)δ:169.6,142.4,137.6,136.0,134.0,128.4,127.7,126.7,126.2,123,58.3,52.0,20.5,20.2;19F NMR(376 MHz,CDCl3)δ:-115.2.HRMS(ESI) C16H13FO2,[M+Na]+m/z:279.079 2,实测:279.0785.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=80/20,1.0 mL/min,λ=254 nm;tminor=25.1 min,tmajor=31.5 min.
(S)-5-(4′-氯-[1,1′-联苯基]-4-基)二氢呋喃-2(3H)-酮(2o):白色固体,53.5 mg,收率:98%,90%ee,=-10.85(c=0.126,CH2Cl2),熔点170~172 ℃.1H NMR(400 MHz,CDCl3)δ:7.51(d,J=38.1 Hz,8H),5.60(s,1H),2.73(s,3H),2.27(s,1H);13C NMR(100 MHz,CDCl3)δ:177.0,139.0,134.0,129.3,128.6,127.6,126.1,81.2,31.2,29.2.HRMS(ESI) C16H13ClO2,[M+H]+m/z:273.067 7,实测:273.0678.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=16.0 min,tmajor=20.2 min.
(S)-5-(4′-溴-[1,1′-联苯基]-4-基)二氢呋喃-2(3H)-酮(2p):白色固体,50.7 mg,收率:80.2%,96%ee,=-7.22(c=0.12,CH2Cl2),熔点201~203 ℃.1H NMR(400 MHz,CDCl3)δ:7.62~7.55(m,4H),7.48~7.39(m,4H),5.56(dd,J=9.2,5.2 Hz,1H),2.80~2.59(m,3H),2.30~2.11(m,1H);13C NMR(100 MHz,CDCl3)δ:140.3,132.0,128.7,127.3,125.9,80.9,77.3,77.0,76.7,29.0.HRMS(ESI)C16H13BrO2,[M+Na]+m/z:338.999 1,实测:338.9996.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=14.8 min,tmajor=18.5 min.
(S)-5-(2′-溴-[1,1′-联苯基]-4-基)二氢呋喃-2(3H)-酮(2q):无色液体,46.3 mg,收率:73.3%,94%ee,=-5.97(c=0.134,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.67(dd,J=8.0,1.1 Hz,1H),7.48~7.15(m,8H),5.59~5.54(m,1H),2.70(qd,J=7.5,3.8 Hz,3H),2.32~ 2.23(m,1H);13C NMR(100 MHz,CDCl3)δ:176.8,141.8,141.3,138.7,133.2,131.2,129.8,129.0,127.5,125.0,122.5,81.0,30.8,29.0.HRMS(ESI) C16H13BrO2,[M+H]+m/z:317.017 2,实测:317.0171.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=14.3 min,tmajor=16.1 min.
(S)-5-(3′-溴-[1,1′-联苯基]-4-基)二氢呋喃-2(3H)-酮(2r):白色固体,53.3 mg,收率:84.3%,81%ee,=-3.76(c=0.062 CH2Cl2),熔点49~51℃.1H NMR(400 MHz,CDCl3)δ:7.64(t,J=1.8 Hz,1H),7.52~7.47(m,2H),7.44~7.38(m,2H),7.33(d,J=8.2 Hz,2H),7.22(t,J=7.9 Hz,1H),5.47(dd,J=9.3,5.1 Hz,1H),2.65~2.57(m,3H),2.13(dddd,J=10.3,7.2,4.4,1.7 Hz,1H);13C NMR(100 MHz,CDCl3)δ:175.8 141.5,138.9,138.0,129.4,129.1,126.5,124.8,121.9,79.9,29.9,27.9.HRMS(ESI) C16H13BrO2,[M+H]+m/z:317.017 2,实测:317.0175.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=16.2 min,tmajor=17.9 min.
(S)-5-(4-苄基苯基)二氢呋喃-2(3H)-酮(2s):无色液体,44.5 mg,收率:89%,94%ee,=-7.02(c=0.095,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.31~7.15(m,9H),5.46(dd,J=7.7,6.4 Hz,1H),3.98(s,2H),2.67~2.55(m,3H),2.24~2.10(m,1H);13C NMR(100 MHz,CDCl3)δ:176.9,141.6,140.7,137.1,129.3,128.9,128.5,126.2,125.6,81.2,77.4,77.1,76.7,41.6,30.9,29.0.HRMS(ESI) C17H16O2,[M-H]-m/z:251.107 8,实测:251.1079.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=13.4 min,tmajor=17.9 min.
(S)-5-(4-(4-氯苄基)苯基)二氢呋喃-2(3H)-酮(2t):无色液体,41 mg,收率:72%,92%ee,=-5.18(c=0.103,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.25(dd,J=8.3,2.5 Hz,4H),7.18(d,J=8.1 Hz,2H),7.10(d,J=8.3 Hz,2H),5.47(dd,J=7.9,6.2 Hz,1H),3.94(s,2H),2.67~2.58(m,3H),2.17(ddd,J=13.6,8.0,4.9 Hz,1H);13C NMR(100 MHz,CDCl3)δ:176.9,141.0,139.2,137.4,132.1,130.3,129.2,128.7,125.9,81.1,40.9,30.9,29.0.HRMS(ESI) C17H15ClO2,[M-H]-m/z:285.068 8,实测:285.0692.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=15.9 min,tmajor=24.3 min.
(S)-5-(4-苯氧基苯基)二氢呋喃-2(3H)-酮(2u):白色固体,37 mg,收率:94%,87%ee,=-10.86(c=0.135,CH2Cl2),熔点125~127℃.1H NMR(400 MHz,CDCl3)δ:7.38~7.28(m,4H),7.15~7.10(m,1H),7.04~6.98(m,4H),5.51~5.45(m,1H),2.69~2.59(m,3H),2.26~2.15(m,1H);13C NMR(100 MHz,CDCl3)δ:176.8,157.6,156.8,133.8,129.9,127.1,123.7,119.2,118.8,81.1,30.9,29.1.HRMS(ESI) C16H14O3,[M-H]-m/z:253.087 3,实测:253.0877.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=25.2 min,tmajor=33.8 min.
(S)-5-(3,4-二氯苯基)二氢呋喃-2(3H)-酮(2v):无色液体,31.2 mg,收率:69%,73%ee,=-18.52(c=0.117,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.26(t,J=1.8 Hz,1H),7.17~7.14(m,2H),5.37(dd,J=9.6,4.9 Hz,1H),2.66~2.56(m,3H),2.12~2.04(m,1H);13C NMR(100 MHz,CDCl3)δ:176.0,142.9,135.6,128.6,123.7,79.4,30.7,28.6.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=99/1,1.0 mL/min,λ=210 nm;tminor=15.5 min,tmajor=21.7 min.
(S)-5-(3-氯-5-甲基苯 基)二氢呋 喃-2(3H)-酮(2w):白色固体,20.4 mg,收率:90%,30%ee,=-4.35(c=0.023,CH2Cl2),熔点65~67℃.1H NMR(400 MHz,CDCl3)δ:7.29(d,J=8.3 Hz,1H),7.24~7.17(m,2H),5.68~5.62(m,1H),2.72~2.62(m,3H),2.32(s,3H),2.12~2.01(m,1H);13C NMR(100 MHz,CDCl3)δ:176.7,136.1,133.8,130.6,126.5,125.7,78.3,29.6,28.6,18.8.HRMS(ESI)C11H11ClO2,[M+H]+m/z:211.052 0,实测:211.0519.ee值用高效液相通过手性柱 AD-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=99.5/0.5,1.0 mL/min,λ=254 nm;tminor=10.8 min,tmajor=11.6 min.
(R)-5-(萘-2-基)二氢呋喃-2(3H)-酮(2x):无色液体,27.4 mg,收率:65%,61%ee,=-62.86(c=0.175,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.90(dd,J=7.1,2.3 Hz,1H),7.84(dd,J=7.6,2.4 Hz,2H),7.59~7.45(m,4H),6.26(t,J=7.0 Hz,1H),2.94~2.84(m,1H),2.75~2.60(m,2H),2.34~2.24(m,1H);13C NMR(100 MHz,CDCl3)δ:177.2,135.0,133.8,129.5,129.2,128.8,126.6,125.9,125.4,122.5,121.6,78.6,30.0,28.3.ee值用高效液相通过手性柱AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=27.6 min,tmajor=24.7 min.
(S)-5-(8-溴萘-2-基)二氢呋喃-2(3H)-酮(2y):白色固体,47.3 mg,收率:82%,93%ee,=-3.57(c=0.112,CH2Cl2),熔点133~135℃.1H NMR(400 MHz,CDCl3)δ:8.02(d,J=1.7 Hz,1H),7.80(d,J=8.6 Hz,2H),7.72(d,J=8.7 Hz,1H),7.60(dd,J=8.7,1.9 Hz,1H),7.44(dd,J=8.6,1.7 Hz,1H),5.70~5.65(m,1H),2.77~2.69(m,3H),2.32~2.24(m,1H);13C NMR(100 MHz,CDCl3)δ:176.9,137.5,134.4,131.7,130.3,129.9,128.2,124.4,124.2,120.7,81.2,31.0,29.1.HRMS(ESI) C14H11BrO2,[M+H]+m/z:291.001 5,实测:291.0013.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=70/30,1.0 mL/min,λ=254 nm;tminor=17.9 min,tmajor=22.4 min.
(S)-5-苯乙基二氢呋喃-2(3H)-酮(2z):无色液体,27.3 mg,收率:72%,60%ee,=+57.89(c=0.095,CH2Cl2).1H NMR(400 MHz,CDCl3)δ:7.33~7.25(m,2H),7.21(t,J=6.8 Hz,3H),4.51~4.43(m,1H),2.87~2.69(m,2H),2.57~2.50(m,2H),2.36~2.26(m,1H),2.05(dtd,J=14.1,8.7,5.5 Hz,1H),1.97~1.81(m,2H);13C NMR(100 MHz,CDCl3)δ:177.2,140.7,128.5,126.19,79.93,37.4,31.6,28.8,27.9.ee值用高效液相通过手性柱 AS-H(25 cm ×ϕ0.46 cm ID)测定,条件为:V(正己烷)/V(异丙醇)=85/15,1.0 mL/min,λ=254 nm;tminor=16.4 min,tmajor=18.7 min.
2 结果与讨论
2.1 合成
2.1.1 反应条件筛选 使用γ-酮酸 1a 作为模板底物,氢气作为氢源对不对称氢化反应条件进行探索(图3).首先以Ni(OAc)2·4H2O 和(R)-Duanphos为手性催化剂、Zn(OTf)2为共催化剂、甲苯为溶剂,在 130 ℃反应,能以98%收率和61%ee得到不对称氢化产物 2a(表1 中序号1).接下来,我们考察了常用的手性配体对反应的影响,从实验结果来看,具有富电子基的双膦配体(R,R)-Quinox P*、(2R,3R)-dppe 和(R,R)-Me-BPE 具有较为优异的对映选择性(序号 2~4,80%~85%).而当使用噁唑啉系列配体时反应基本不发生(序号 5),二茂铁(序号 6)和螺环类配体(序号 7)反应不发生.使用(R)-Binap 配体只能得到 40% 收率,反应没有立体选择性(序号 8).因此,我们最终确定(R,R)-Quinox P*和(R)-Duanphos 为相对比较理想的配体,进一步优化反应条件.

表1 配体筛选Tab.1 Screening of Ligand
接下来,我们对反应温度进行考察.从实验结果(表2)可以看出从130 ℃ 至50 ℃ 过程中,(R,R)-Quinox P*作为配体,70 ℃ 反应时对映选择性有所降低.为了进一步提高反应的对应选择性,我们又考察了三氟甲磺酸类的添加剂,Fe(OTf)3、AgOTf 对映选择性能达到良好水平(序号5~6),但收率偏低.当使用Al(OTf)3时,反应收率和对映选择性都能达到良好的水平(序号 7),而使用Cu(OTf)2、ZnI2或不加入添加剂反应都不能发生(序号 8~10).对不同溶剂的考察表明(序号11~14),除了DCE、1,4-二氧六环以外,当前反应在其他的有机溶剂中都不能发生.其中DCE、1,4-二氧六环是当前反应最佳溶剂,得到 2a 的产率为96%,对映选择性为 92%.

表2 温度、添加剂、溶剂优化结果Tab.2 Optimization of temperature,additives and solvents
2.1.2γ-酮酸上不同取代基和位阻效应对反应的影响 当确定了最优反应条件后,我们研究了含有不同取代基的γ-酮酸在当前反应中的普适性(图4).令我们高兴的是,所有底物都能被顺利氢化并完全转化,得到相应的γ-戊内酯,收率高达99%,对映选择性高达98%.在苯基的对位有吸电子基(F、Cl、Br、CF3)时,得到的γ-戊内酯的对映选择性(77%~92%)和收率(81%~96%)都较高(2a~2e),邻位和间位具有吸电子基团(F、Cl、CF3)的γ-酮酸的反应结果也很理想(2f~2h).一般来说,在苯环上带有给电子取代基的芳基底物可以提供比带有吸电子取代基的芳基底物更高的对映选择性.但当苯环上含有甲氧基时(2i)对映选择性只有30%ee,含有环己基时(2j)收率只有34%.当使用含有联苯基结构的γ-酮丁酸时,无论苯环上含有吸电子基还是供电子基,反应的对映选择性(81%~98%)和收率(72%~99%)都较理想(2k~2r).当γ-酮酸连接二苯甲烷或二苯醚时,对映选择性和收率也比较理想(2s~2u),当使用苯基上同时含有2 个取代基时,反应的收率和对映选择性有所下降(2v,2w).含有萘基取代的γ-酮酸和脂肪族的γ-酮酸在当前反应条件下也能以中等的收率和对映选择性得到目标γ-戊内酯(2x~2z).
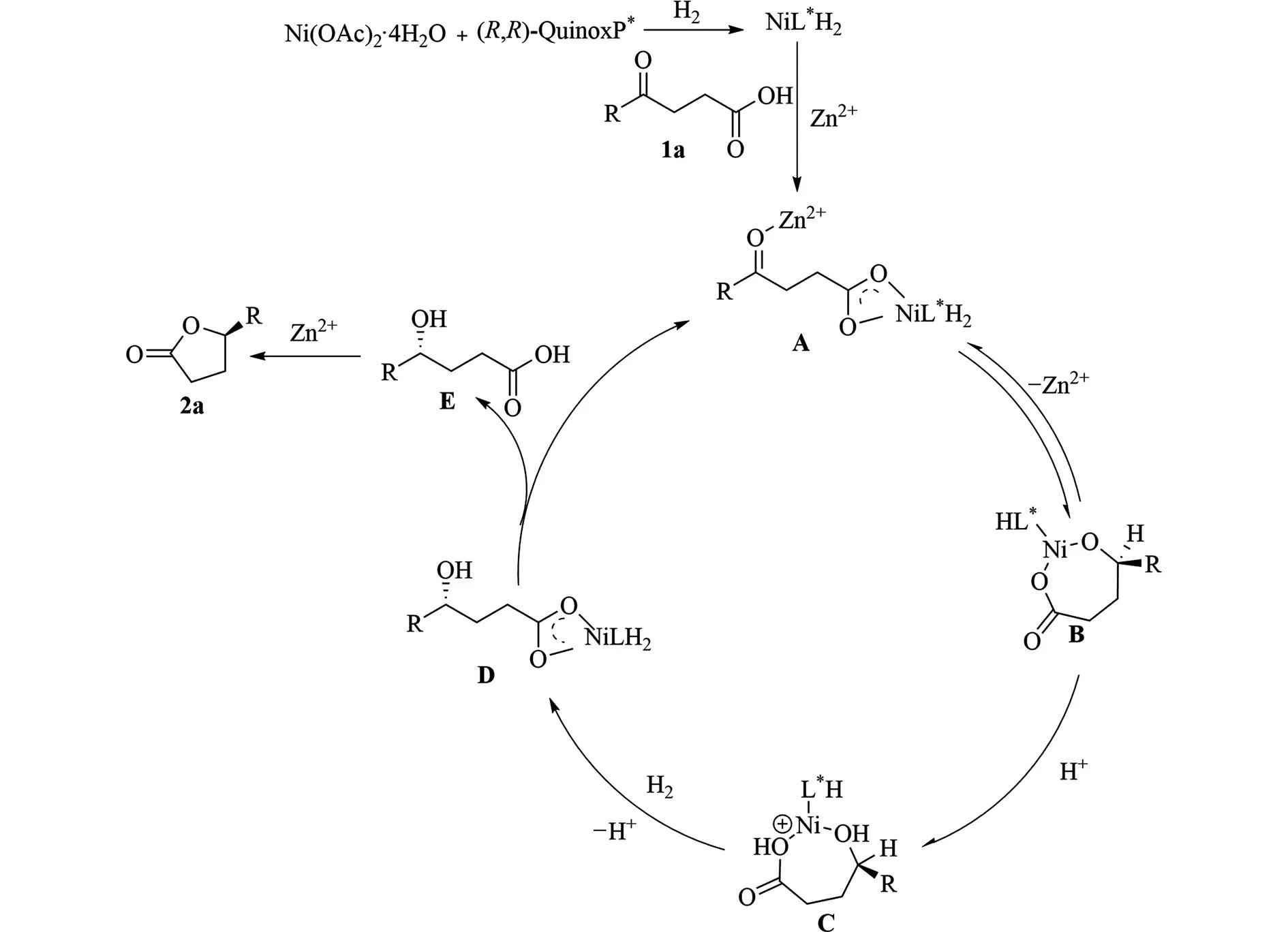
图4 可能的反应机理Fig.4 Possible mechanism
2.2 机理根据过渡金属催化γ-酮羧酸的氢化相关文献[14-15],提出可能的反应机理如图4 所示.首先,手性镍配合物与氢反应得到手性镍二氢化,与1a 配位得到中间体A.随后,通过将Ni—H 迁移插入进入羰基中,由中间体A 得到中间体B,然后,中间体B 接受1 个质子得到中间体C,紧接着C 被氢化和脱质子得到中间体D,中间体D 与1 的配体交换反应得到中间体E 并再生成中间体A,最后,E的内酯化得到手性γ-戊内酯2a.
3 结语
我们开发了一种廉价、高效的制备手性γ-戊内酯的方法.该方法以氢气为氢源,在镍-锌协同催化体系下,对市售γ-芳基酮酸进行不对称氢化反应,获得了一系列手性γ-戊内酯衍生物.该催化体系具有良好的底物适用性,收率高达 99%,对映选择性高达 98%,为获得有价值手性γ-戊内酯提供了一种高效、经济的方法,当前方法在有机合成和制药工业中具有重要的潜在应用价值.

