酮体代谢相关基因ACAT1表达对膀胱癌发生发展的影响
范博皓 曾 源 黄永胜 顾刚利 刘 钊 阎 磊
山东大学齐鲁医院泌尿外科,山东 济南 250012
膀胱癌(bladder cancer,BCa)是泌尿系统常见肿瘤之一,近年来其发病率已位居所有恶性肿瘤的前10 位,虽然其死亡率在部分发达国家有所下降,但在大多数国家仍居高不下[1]。BCa的病因及发病机制尚未完全明确,吸烟和高龄是已经证实的高危因素[2]。研究证实,饮食结构可以影响BCa 的生存和进展[3-4]。生酮饮食是指碳水化合物含量非常低、蛋白质含量适中、脂肪含量高的饮食,旨在诱导酮病或酮体的产生。酮体作为生酮饮食的代谢产物,共包含3 种,分别是20%的乙酰乙酸、2%的丙酮和78%的β-羟丁酸。酮体除了可以为机体某些器官(如心脏、大脑、肌肉等)快速提供能量,还可通过改变基因表达、细胞表面受体激活和组蛋白修饰,在代谢性疾病中发挥表观遗传学作用[5]。研究表明,酮体可以抑制结直肠癌、肝癌细胞的增殖、迁移和侵袭能力[6-7],为肿瘤的治疗提供了新的理论指导和方向。
ACAT1编码乙酰辅酶A 乙酰转移酶1(acetyl coenzyme A acetyltransferase 1,ACAT1),在酮体生成的第一步能够可逆性地将乙酰辅酶A 合成为乙酰乙酰辅酶A。ACAT1被发现与阿尔茨海默病、动脉粥样硬化和肿瘤的发生有关[8]。研究表明,胰岛素可以通过上调ACAT1进而促进结直肠癌的发生、发展[9]。研究表明,ACAT1的聚集可能促进上皮性卵巢癌的进展[10]。然而目前尚缺乏关于ACAT1对于BCa 发生、发展影响的研究。本研究旨在通过对癌症基因组图谱(the cancer genome atlas,TCGA)和基因表达综合数据库(gene expression omnibus,GEO)中BCa 的表达和临床信息数据进行生物信息学分析,评估ACAT1基因在BCa 中的表达和对预后的意义,并进行体外实验,进一步验证ACAT1在膀胱癌进展中的作用。
1 材料和方法
1.1 数据收集和整理
在TCGA 数据库(https://portal. gdc. cancer.gov/)中下载BCa 表达数据,包含409 个BCa 样本和19个正常样本,应用R软件包“DEseq2”对该数据集进行基因差异表达分析;在GEO 数据库(https://www. ncbi. nlm. nih. gov/geo/)中筛选出GSE199515和GSE13507 2个数据集,对二者进行基因差异表达分析,筛选差异表达基因。3 组差异基因绘制韦恩图,最终筛选出BCa差异表达的基因。
1.2 基因筛选
通过检索PubMed 筛选出酮体代谢相关基因。对目标基因通过Metascape数据库(https://metascape.org/gp/index. html#/main/step1)进行基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encylopaedia of genes and genomes,KEGG)富集分析验证。BCa 差异表达基因与酮代谢基因取交集,得到目的基因。
1.3 酮体相关BCa表达差异基因在泛癌中的表达
通过TIMER2.0 数据库(http://timer. cistrome.org/)对筛选出的酮体代谢相关BCa 表达差异基因在多种癌症中观察其表达差异。
1.4 酮体代谢相关BCa差异基因的生存分析
在HAP数据库中收集ACAT1在BCa中表达的免疫组织化学染色数据,并使用Ualcan数据库绘制不同临床特征下BCa 中ACAT1表达的柱状图,同时通过Kaplan-Meier方法绘制生存曲线,观察ACAT1表达对BCa生存预后的影响。进一步通过TIMER2.0数据库对BCa表达临床数据进行多因素Cox回归分析,检验ACAT1是否可以独立影响BCa预后。
1.5 免疫细胞浸润相关性分析
通过TIMER2.0数据库分析BCa中ACAT1表达与CD4+ T 细胞、CD8+ T 细胞、中性粒细胞、树突状细胞、巨噬细胞以及单核细胞6 种免疫细胞浸润之间的相关性。
1.6 ACAT1低表达模型构建
订购小干扰RNA(SiRNA1 序列为5′-GCUGAAUAUUGCACGAAAUttAUUUCGUGCAAUA UUCAGC-3′;SiRNA2序列为5′-CAGGACGCUUAUG CUAUUAttUAAUAGCAUAAGCGUCCUG-3′),选取生长状态良好的T24 细胞,采用非脂质体阳离子聚合物转染试剂polyfast(MedChemExpress,美国)介导转染。小干扰冻干粉瞬离后用125 µL DEPC-H2O溶解,震荡混匀后瞬离。弃掉旧的培养基,PBS洗涤6孔板中细胞2次,随后加入1 mL无血清培养基,每孔加入3 µL polyfast 试剂和2 µL 小干扰RNA 混合试剂,在37 ℃,5% CO2条件下培养48 h。使用定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)和Western blot实验验证转染效率。
1.7 ACAT1生物学功能验证
细胞转染siRNA 48 h 后,进行CCK8 实验验证细胞活性和增殖能力;使用克隆形成实验验证细胞的集落形成能力;使用划痕试验验证细胞的迁移能力;使用含有基质胶的Transwell实验验证细胞的侵袭能力。
1.8 统计学处理
使用Wilcoxon 秩和检验和卡方检验对比BCa和正常膀胱组织之间的ACAT1表达差异。预后分析采用Kaplan-Meier 分析、多因素Cox 回归分析。计量资料采用均数 ± 标准差表示,如符合正态分布,两组间比较则采用独立样本t检验,否则采用非参数检验。计数资料采用n(%)表示,组间比较选用χ2检验。图形及组间差异计算使用GraphPad Prism8.0 软件绘制和分析。检验水准α= 0.05。
2 结 果
2.1 酮体代谢相关的BCa差异表达基因筛选
应用R 软件包“edgeR”对TCGA 数据库中下载的BCa表达数据集进行差异分析,得到4 193个差异基因。应用“GEO2R”在线对数据集GSE199515 和GSE13507 进行基因差异分析,分别筛选出1 143 个和996 个差异表达基因,(P< 0.05,logFC > 1)。对3 组差异基因应用在线软件“Venn Diagram”绘制韦恩图,最终筛选出BCa中76个差异表达的基因。通过PubMed 输入关键词“酮体代谢”“酮体”“生酮饮食”等进行检索,筛选出酮体代谢相关基因15个,分别为ACAA1、ACAA2、ACAT1、ACAT2、HADHA、HADHB、ACSS2、HMGCS2、HMGCL、BDH1、OXCT1、GLUT1、TKTL1、SLC16A1、SLC16A7。并对筛选出的基因利用Metascape数据库进行GO和KEGG富集分析,进一步验证筛选出的基因富集在酮体代谢相关通路(图1A)。最后对筛选出的差异表达基因与酮体代谢相关基因取交集得到1个酮体代谢相关的差异表达基因,即ACAT1。

图1 酮体代谢相关膀胱癌差异基因筛选
2.2 ACAT1在BCa中的表达量低于膀胱正常组织
通过TIMER2.0数据库对ACAT1在多种癌症中进行Wilcoxon 秩和检验,发现BCa 组织中ACAT1的表达较正常膀胱组织低,差异具有统计学意义(P<0.001),见图1B。
2.3 ACAT1高表达可能是预后的独立危险因素
HPA数据库的免疫组织化学染色提示,ACAT1在正常组织中的表达高于BCa(图2A)。使用Ualcan数据库分析ACAT1与BCa不同临床性状之间的相关性,发现ACAT1的表达与BCa的性别、年龄、分期及淋巴结转移均呈正相关(P< 0.01),见图2B。通过Kaplan-Meier方法绘制生存曲线显示,高表达ACAT1患者总体生存率低于低表达患者(P< 0.01)。进一步通过TIMER2.0 数据库对BCa 表达临床数据进行多因素COX回归分析提示,高表达ACAT1生存率显著低于低表达患者(P< 0.01),见图2C。
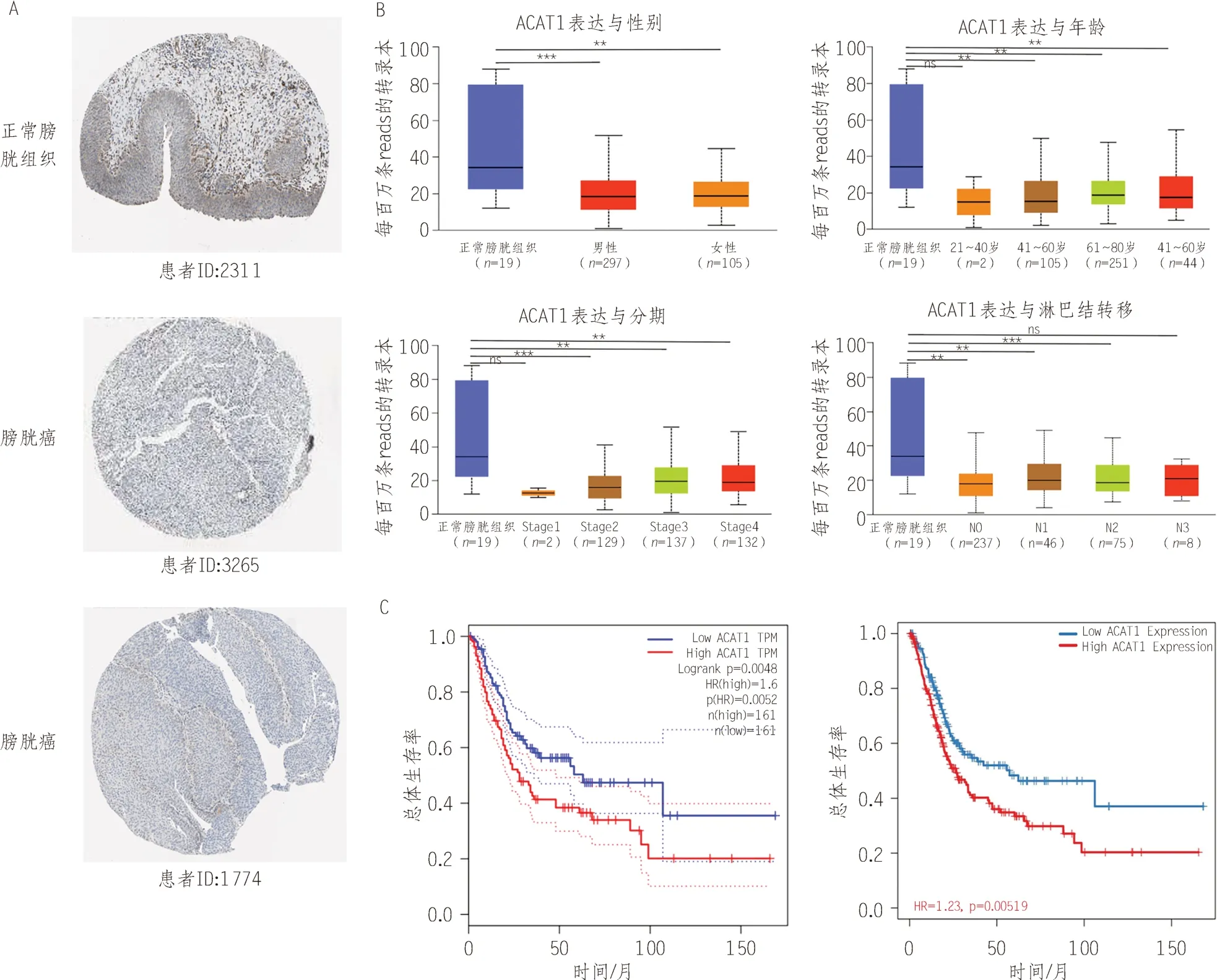
图2 ACAT1对膀胱癌分期和预后的影响
2.4 ACAT1 在BCa 中的表达与免疫细胞浸润大致呈正相关
基于TIMER2.0 数据库分析发现,ACAT1的表达和肿瘤纯度之间呈负相关(r= −0.335,P<0.001)。但ACAT1的表达与部分免疫细胞浸润之间呈正相关,其相关性和差异性为:CD8 + T 细胞(r= 0.242,P< 0.001)、肥大细胞(r= 0.257,P<0.001)、中性粒细胞(r= 0.214,P< 0.001)、巨噬细胞(r= 0.283,P< 0.001)。
2.5 敲减ACAT1促进BCa细胞增殖、迁移和侵袭
qPCR 及Western blot 结果表明,si-ACAT1-1有更高的敲减效率(图3A,B),此序列被用于后续的细胞实验。实验表明,敲减ACAT1能显著提高T24细胞的增殖能力(图3C)和克隆形成能力(图3D)。此外,ACAT1的敲减还能提高T24 细胞的迁移(图3H)和侵袭能力(图3F)。
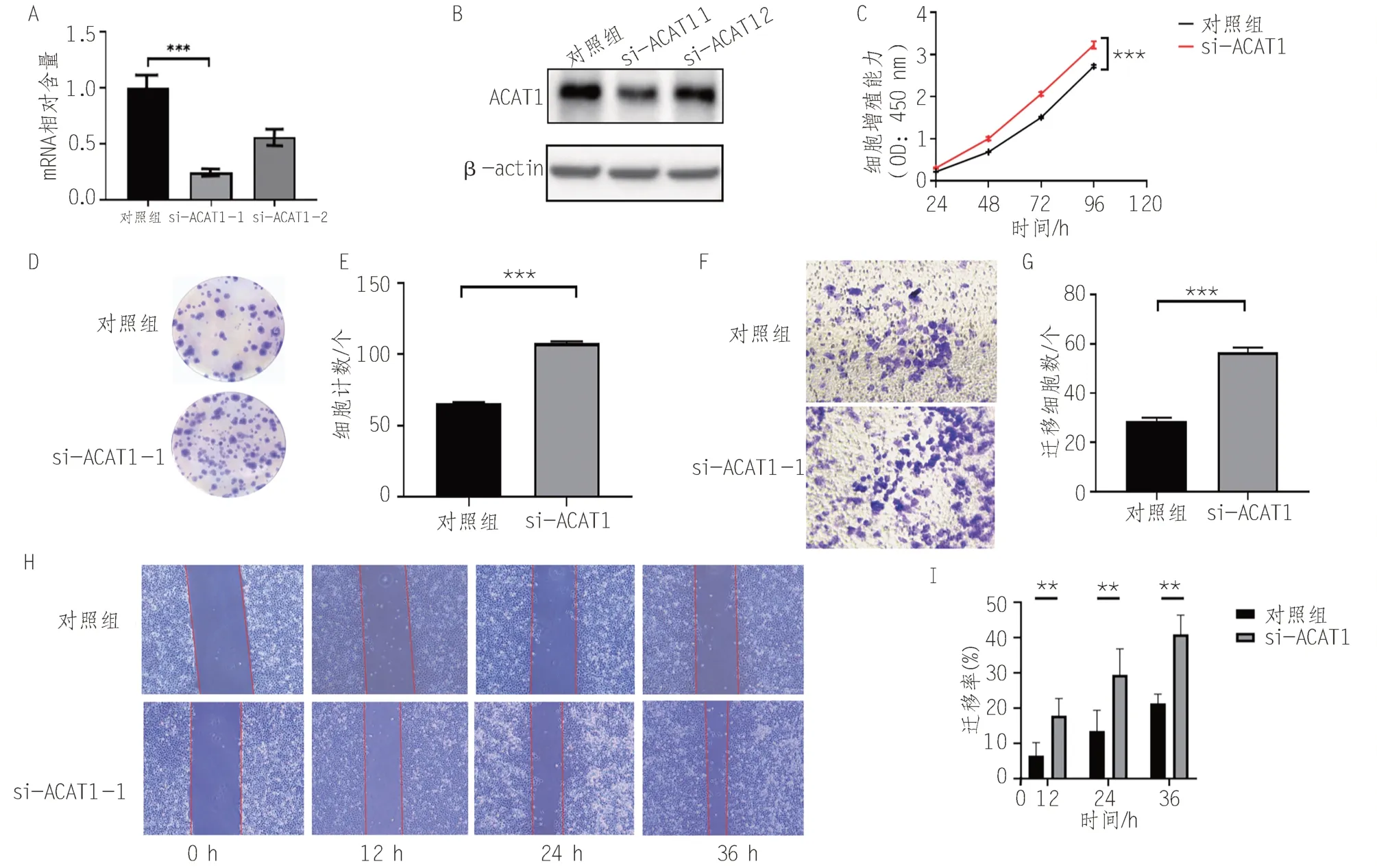
图3 体外实验验证ACAT1对膀胱癌增殖、迁移和侵袭能力的影响
3 讨 论
在泌尿系统肿瘤中,BCa 发病率仅次于前列腺癌[11]。无痛性血尿是BCa 最常见的临床表现[12-13]。大约75%的BCa 患者发现患病时是非肌层浸润性BCa[14],而其余25% ~ 30%的患者,BCa 已侵入膀胱壁更深层次,称为肌层浸润性BCa。经尿道膀胱肿瘤切除术是治疗非肌层浸润性BCa 的主要方法,而根治性膀胱切除术一般用于治疗肌层浸润性BCa。为了防止复发,膀胱肿瘤切除术在特定的患者中需要辅以膀胱内灌注[15]。尽管手术方面有了很多改进,围手术期化疗、免疫治疗也得到了广泛应用,但晚期BCa的预后仍然很差。
ACAT 是一种细胞内特有的酶,可以利用游离胆固醇生成胆固醇酯,在维持细胞内胆固醇稳态方面发挥重要作用[16]。在真核生物中,有2 个基因(ACAT1和ACAT2)编码ACAT。ACAT1无处不在,在各种组织和细胞类型中表达,包括肝细胞、肾上腺、神经元、巨噬细胞和肠道的Kupffer 细胞,而ACAT2表达具有较强的特异性,只存在于肠绒毛的顶端,与肠道吸收胆固醇有关[17]。在禁食或饥饿状态下,ACAT1可以催化2分子的乙酰辅酶A形成乙酰乙酰辅酶A进入酮体生成过程[18]。近年来,酮体及其代谢相关酶在肿瘤发生、进展中的作用逐渐受到人们的重视,例如,在肝癌中,3‐羟基丁酸脱氢酶1(3-hydroxybutyrate dehydrogenase 1,BDH1) mRNA 低表达的患者生存率和预后较差[19]。此外,3-琥珀酰辅酶A 转移酶1 (3-oxoacid coenzyme A transferase 1,OXCT1)通过NF-κB 信号通路促进胰腺导管腺癌的吉西他滨耐药[20]。研究表明,过表达ACAT1/2 和OXCT1/2 可以促进乳腺癌细胞增殖[21]。除此之外,ACAT1在前列腺癌组织中的表达较良性前列腺增生组织显著增加[22]。在肾透明细胞癌中,ACAT1的上调与肾透明细胞癌的增殖和侵袭呈负相关[18]。然而,ACAT1在BCa 中是否发挥作用,还未见研究报道。
本研究在TCGA和GEO数据库中筛选出BCa中具有差异表达的基因,与通过文献检索收集到的酮体代谢相关基因取交集得到ACAT1。通过在线数据库分析了ACAT1在BCa 中表达量高于正常膀胱组织,且ACAT1表达与BCa 免疫细胞浸润大致呈正相关,提示ACAT1可能在肿瘤免疫中发挥作用,这也是研究BCa 对免疫治疗敏感性方向的一个潜在切入点。本研究表明,敲低ACAT1可以促进BCa 的增殖、迁移和侵袭,因此认为ACAT1可以抑制BCa的发生和发展。然而,TCGA 数据库中ACAT1高表达的BCa 患者比ACAT1低表达的患者有着更差的预后。对于这种功能和预后结果的不一致性,本研究认为原因可能有以下几点:首先,ACAT1在酮体代谢过程中发挥双向的作用,它既可以促进酮体的生成,也可以加速酮体的利用,其中的机制复杂且尚未完全阐明;其次,ACAT1除了参与酮体代谢途径外,还可以参与胆固醇的代谢、脂肪酸的代谢等多种途径和通路,具体的代谢通路及参与其中的小分子调控物质尚不清楚;再者,TCGA 数据库中ACAT1的表达是基于RNA水平,而基因发挥作用是依赖蛋白水平,各种转录、翻译等阶段的修饰也是导致RNA 和蛋白水平表达不一致的潜在原因。因此,下一步将纳入BCa 临床标本,在蛋白水平检测ACAT1的表达,研究其作为预后指标的潜在意义。并纳入更多的细胞系、动物模型,进一步验证ACAT1在BCa发生进展中的作用及下游调控机制。
利益冲突所有作者均声明不存在利益冲突

