视神经脊髓炎谱系疾病相关神经病理性疼痛动物模型研究进展
宋淑佳,裴丽坚,徐 雁,张 雪,黄宇光
中国医学科学院北京协和医院 1麻醉科 2神经科,北京 100730
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)是一种主要累及视神经和脊髓,脑亦可受累的中枢神经系统自身免疫性疾病。与多发性硬化(multiple sclerosis,MS)不同,其与星形胶质细胞上的水通道蛋白4-免疫球蛋白G(aquaporin 4- immunoglobulin G,AQP4-IgG)相关[1]。AQP4及胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)丢失、嗜酸性粒细胞和中性粒细胞浸润、免疫球蛋白沉积、补体激活及脱髓鞘病变是其主要病理特征[2]。
与MS相比,慢性疼痛在NMOSD患者中的发病率更高,约为72%~86%[3-6],其中以神经病理性疼痛最常见,主要出现在胸腰部、腿部或背部,发病率高达80%以上[7],也有部分患者表现为痛性强直痉挛、自发性疼痛、眼球后疼痛或头颈部疼痛等[8-9]。疼痛严重影响NMOSD患者的生活质量与情感认知,有研究表明,超过1/3的患者同时患有抑郁症,51.5%为中至重度抑郁症[4-5,7-8]。笔者前期研究发现,NMOSD合并神经病理性疼痛的患者出现抑郁症状明显多于合并其他疼痛或无疼痛患者[10]。
NMOSD患者神经病理性疼痛可能与胸段脊髓损伤有关[11],笔者前期的临床横断面研究也显示,与不合并疼痛的NMOSD患者相比,合并神经病理性疼痛的患者伴有初始脊髓病变的比例更高[10]。然而,其具体发病机制尚不明确,一定程度上限制了NMOSD相关神经病理性疼痛治疗手段的发展[3-4,6]。如何构建成熟的NMOSD相关神经病理性疼痛动物模型,充分模拟NMOSD相关神经病理性疼痛发生发展过程中的病理变化,探索有效的预防及治疗策略,成为目前亟待解决的问题。然而,现有模型仅为单纯NMOSD动物模型,未重点关注是否合并疼痛。近年来,部分学者开始在NMOSD动物模型中探索神经病理性疼痛是否存在及其可能机制,为构建NMOSD相关神经病理性疼痛动物模型奠定了基础。本文就目前NMOSD动物模型的建立及其应用作一综述,以期为建立可靠且简便易行的NMOSD神经病理性疼痛动物模型,探索更为有效的治疗手段提供新思路。
1 实验性自身免疫性脑脊髓炎联合AQP4-IgG注射模型
实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型是MS的理想动物模型,其诱导过程较为成熟,主要通过髓鞘抗原注射至动物体内,经过一定时间的潜伏期诱导EAE的产生。EAE评分用于评估模型鼠临床残疾程度:0分代表无疾病;1分代表尾巴麻痹;2分代表后肢无力;3分代表后肢瘫痪;4分代表后肢麻痹加前肢无力;5分代表垂死或死亡。将AQP4-IgG注射至EAE模型动物体内,是目前常用的NMOSD动物模型建立方法,然而目前在NMOSD动物模型中合并疼痛的研究较少,现有研究大多是在EAE模型中进行神经病理性疼痛的特征及治疗研究[12-14]。
Iwamoto等[15]在通过豚鼠脑髓鞘碱性蛋白(myelin basic protein,MBP)建立的EAE模型基础上腹腔注射AQP4单克隆抗体(E5415)[16]构建NMOSD大鼠模型,产生了脊髓AQP4及GFAP严重丢失、中性粒细胞浸润等典型NMOSD病变,在注射后第4天活动障碍达到峰值,注射后第22天活动障碍恢复。而疼痛行为学检测结果显示注射AQP4单克隆抗体后第7天大鼠的机械痛阈值显著降低,且在整个测试期间持续存在,这说明即使NMOSD大鼠运动功能恢复,其神经病理性疼痛也并未得到缓解。该研究还发现人源化RGMa单克隆抗体不仅可以改善NMOSD大鼠的星形胶质细胞受损情况及运动功能障碍,还能有效缓解神经病理性疼痛的严重程度。除此之外,此模型还被应用于证实AQP4单克隆抗体(E5415)注射在不同部位的致病性[17],进一步说明了此模型的稳定性。
另有研究通过从NMOSD患者体内提取NMO-IgG注射至EAE模型小鼠或大鼠腹腔内建立NMOSD模型,但无法造成髓鞘损伤[18-19]。若想产生更符合临床患者特征的病理损伤,则需从NMOSD患者体内提取大量的NMO-IgG进行注射[20]。
随着超声技术的发展,Luo等[21]应用微泡增强低频超声(microbubble-enhanced low-frequency ultrasound,MELFUS)打开血脑屏障,向EAE模型小鼠静脉注射低剂量的NMO-IgG和补体,在其大脑、脊髓和视神经中均产生明显的炎症和脱髓鞘病变。在后续研究中证实了此模型小鼠较EAE模型小鼠出现了更严重的神经功能受损症状[22]。虽然此模型未对NMOSD神经病理性疼痛进行检测,但其应用无创的低频超声技术进行造模,避免对小鼠造成潜在损伤,且所需抗体剂量较低,可为未来建立理想的NMOSD神经病理性疼痛动物模型提供依据。
2 AQP4-IgG中枢神经系统注射模型
该模型是通过将人源AQP4-IgG进行鞘内注射或直接注射至鼠大脑半球或脑室系统。Ishikura等[23]应用人重组AQP4单克隆抗体(rAQP4-IgG)直接注射至大鼠脊髓中,不仅建立了NMOSD大鼠模型,且证实了神经病理性疼痛的存在,研究显示rAQP4- IgG介导的星形胶质细胞向细胞外释放三磷酸腺苷(adenosine triphosphate,ATP),并且应用ATP受体拮抗剂能够成功逆转NMOSD大鼠的机械异常性疼痛。此外,研究者还发现相比于MS或其他神经系统疾病的患者,NMOSD患者脑脊液中ATP浓度显著升高,提示ATP可能在NMOSD神经病理性疼痛的产生机制中发挥了关键作用。尽管此模型为研究NMOSD相关神经病理性疼痛指出了可能的分子学机制,但此模型中机械痛阈值降低而在第3天达到峰值后仅持续了1周,热痛阈值甚至无明显改变。这说明此模型大鼠仅在疾病的急性期出现神经病理性疼痛,而临床上NMOSD患者在疾病的慢性期神经病理性疼痛表现更为突出。这可能与此模型导致的NMOSD病理改变严重程度不足有关,为准确评估NMOSD的疼痛症状,此模型大鼠并未产生运动障碍,研究者也未对脊髓组织是否有炎性细胞浸润和脱髓鞘病变进行检查。
其他AQP4-IgG中枢神经系统注射模型虽未涉及NMOSD相关神经病理性疼痛,但也可为未来探索疼痛发生机制奠定基础。与大鼠不同,小鼠的补体低活性导致在建立NMOSD小鼠模型时需要共同注射补体[24-26]。部分颅内单次注射抗体的模型仅实现了大鼠大脑组织的典型病变,未对NMOSD其他常见病灶如脊髓和视神经进行检测[27],Marignier等[28]采用持续颅内注射则改进了这一点,但未见炎性细胞浸润。在大鼠腰椎间隙进行鞘内注射NMO-IgG的模型未能产生脱髓鞘病变[29-30],这可能与此类模型导致实验动物处于NMOSD疾病早期阶段有关。
3 其他NMOSD动物模型
Zeka等[31]将AQP4特异性T细胞转运至大鼠体内,同时合并NMO-IgG的腹腔注射,可在视神经、大脑和脊髓产生AQP4丢失、炎性细胞浸润等。将人NMO-IgG注射至眼球后、玻璃体内、视交叉附近、视神经鞘下[32],导致视神经炎,此模型可能为未来探索NMOSD相关眼球后疼痛提供模型基础。
综上,神经病理性疼痛在NMOSD患者中普遍存在,针对不同的发病部位,目前已有多种NMOSD动物模型的建立方法,为研究NMOSD相关神经病理性疼痛奠定了基础,NMOSD动物模型建立方法及病变位置、相关病理改变和行为学改变详见表1。但目前的多数研究集中在NMOSD的神经系统病理及其症状研究,而忽视了对于伴发的神经病理性疼痛方面的研究,这也与临床治疗中重视神经系统康复而未充分改善患者慢性神经病理性疼痛情况相符。尽管部分研究证实了NMOSD动物模型中神经病理性疼痛的存在,但这些研究仅将疼痛作为NMOSD的并发症状之一,针对NMOSD动物模型合并疼痛的研究较少,缺乏成熟的NMOSD相关神经病理性疼痛动物模型。此外,NMOSD相关神经病理性疼痛的发生机制尚未阐明,也未进一步探究疼痛引起的其他表征,例如临床中常见的疼痛-抑郁共病。
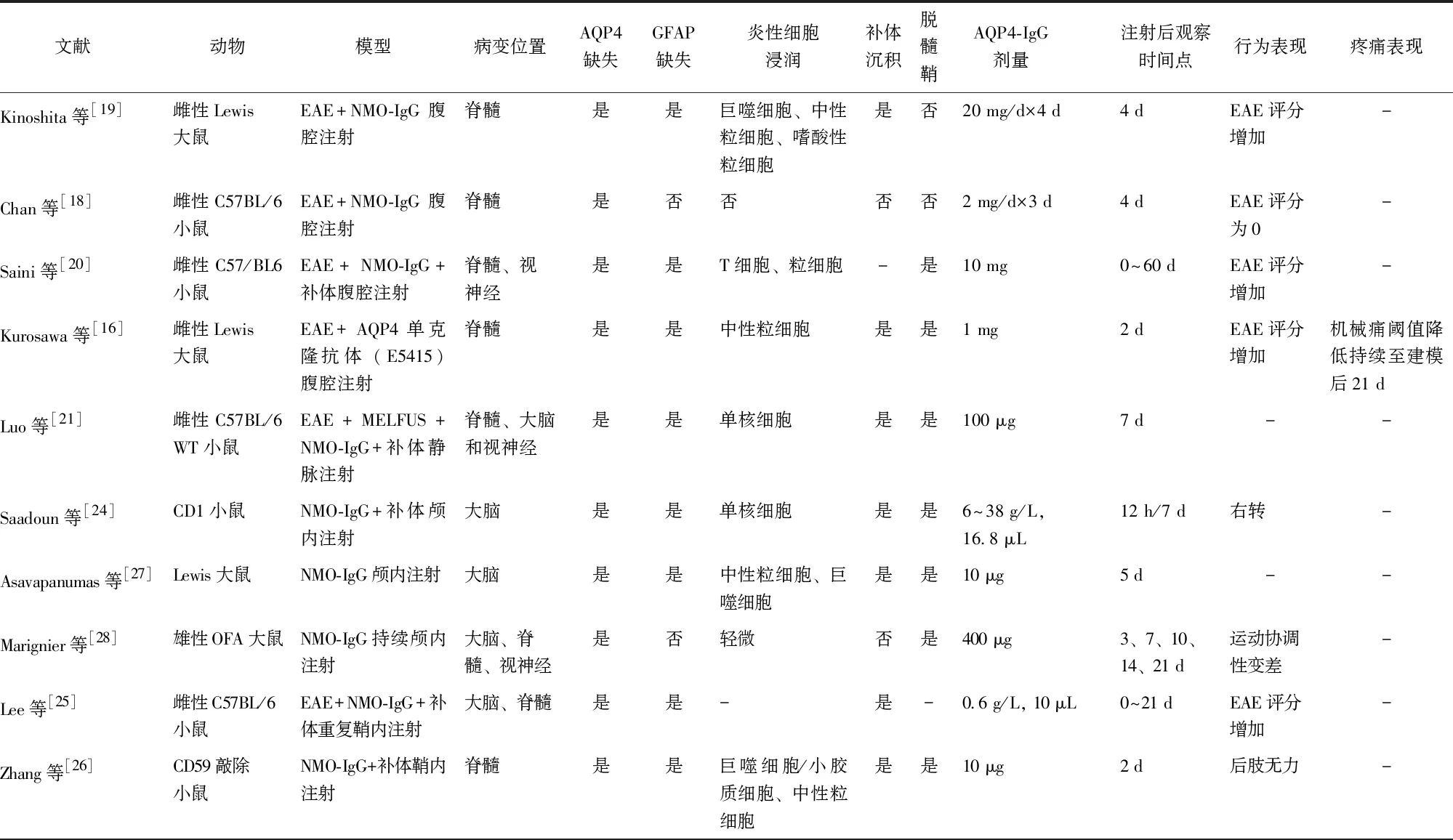
表1 NMOSD动物模型及其特征
因此,未来仍需探索建立更贴近NMOSD神经病理性疼痛发病特征的动物模型。理想的NMOSD神经病理性疼痛模型应满足疾病动物模型构建的基本原则:(1)与NMOSD患者神经病理性疼痛症状相似,如慢性疼痛在NMOSD缓解期持续存在、常具有疼痛-抑郁共病等;(2)可重复性强,神经病理性疼痛结果稳定;(3)可控性强,生命周期满足实验需要;(4)可靠性强,应具备NMOSD神经病理性疼痛的病理改变,如常伴有初始脊髓病变等;(5)具有易行性和经济性,如使用的AQP4-IgG易于获取,且对抗体的需求量较少等。除此之外,还应尽量考虑NMOSD相关神经病理性疼痛是免疫激活与慢性应激相互作用的结果,理想的动物模型需符合共同发病机制,以作为合适的疾病模型用于探索更有效的治疗手段。
作者贡献:宋淑佳负责查阅文献资料、撰写论文;裴丽坚、徐雁、张雪、黄宇光负责指导论文撰写、提出修改意见。
利益冲突:所有作者均声明不存在利益冲突

