中药复方WCAP及拆方对人胰腺癌皮下移植瘤裸小鼠模型及IL⁃6/STAT3信号通路的影响
曹妮达,李朝燕,2,华逢春,3,马芳琪,王 强,高 峰,朱莹杰
1.上海中医药大学附属龙华医院肿瘤一科(上海 200032);2.上海交通大学医学院附属瑞金医院中医科(上海200025);3.上海中医药大学附属龙华医院核医学科(上海 200032)
胰腺癌是高度恶性的肿瘤之一,居我国恶性肿瘤发病率第11位,病死率第7位[1]。由于早期多为非特异性症状,约60%的胰腺癌患者在确诊时已发生远处转移,25%的患者为局部晚期,不能行根治性切除,而接受姑息化疗者的中位生存时间仅8.8~11.1 个月[2-5],且已知药物靶点如Ras 和BRCA 突变等在胰腺癌中发生率低下,靶向和免疫治疗均尚未在胰腺癌中有肿瘤控制和生存期增加方面的显著性突破[6-7],预后极差。因此,探究胰腺癌的发病机制,寻找对胰腺癌细胞增殖、凋亡及侵袭转移等方面调控的信号通路,进而从分子水平寻求治疗靶点仍是当前基础研究的重点。
白介素-6/信号转导和转录激活因子3(IL-6/STAT3)信号通路是参与免疫、细胞生长、细胞分化以及造血等多种生理过程的经典信号通路[8]。IL-6 是由位于肿瘤微环境中的多种细胞(包括免疫细胞、基质细胞和肿瘤细胞本身)产生的细胞因子,直接作用于肿瘤细胞并诱导STAT3 靶基因的表达,然后编码驱动肿瘤细胞增殖和/或存活的蛋白质,介导STAT3的持续激活、肿瘤的发生、血管生成、免疫抑制及肿瘤的侵袭转移等过程[9]。多项研究[10-14]显示,在肝癌、胃癌、非小细胞肺癌、乳腺癌、白血病等多种人及鼠的恶性肿瘤中有STAT3 的过度激活及表达,但在胰腺癌中的研究报道较少。
全国名老中医药专家传承工作室导师、上海市名中医邱佳信教授提出脾虚在胰腺癌发生和发展中的重要作用,并创立中药复方WCAP,临床用于治疗胰腺癌30 余年。WCAP 以健脾益气为主,辅以清热解毒、软坚散结。前期相关研究[15-17]提示,与化疗组比较,化疗联合中药复方WCAP 组可降低晚期胰腺癌死亡风险48%,同时可改善根治术后患者的预后,提高患者生存质量,并能抑制BxPC-3裸小鼠皮下移植瘤的生长,提高血清自然杀伤(NK)细胞水平。为明确该复方中不同治则成分对肿瘤的抑制情况,以及单用清热解毒药或软坚散结药是否有更强的抑瘤作用,本研究通过BxPC-3细胞株悬液形成胰腺癌裸小鼠皮下接种瘤模型,观察中药复方WCAP 及其拆方对裸小鼠皮下肿瘤、瘤组织中IL-6/STAT3 通路及其下游靶基因mRNA 及蛋白表达水平的影响,探索中药复方WCAP 中对胰腺癌的抑瘤机制,并为深入机制研究提供方向。
1 材料与方法
1.1 材料
1.1.1 细胞 人胰腺癌BxPC-3 细胞株,购自中国科学院细胞库。
1.1.2 动物 6~8 周龄雄性裸小鼠(BALB/C)30 只,SPF 级,体质量17~22 g,由上海斯莱克实验动物有限责任公司提供。动物生产合格证号:SCXK(沪)2012-0002。实验动物按SPF 级动物实验要求饲养并管理,饲养于复旦大学医学院动物房。动物使用合格证号:SYXK(沪)2016-0004。
1.1.3 药物与试剂 WCAP 方由太子参12 g、炒白术12 g、茯苓15 g、龙葵30 g、红藤30 g、芙蓉叶30 g、生牡蛎30 g、夏枯草9 g、半夏9 g、壁虎4.5 g、鸡内金15 g 组成。处方以健脾益气、清热解毒、软坚散结为治则,故拆方为健脾药、清热解毒药和软坚散结药。健脾药物:太子参12 g,炒白术12 g,茯苓15 g,鸡内金15 g;清热解毒药物:龙葵30 g,红藤30 g,芙蓉叶30 g;软坚散结药物:生牡蛎30 g,夏枯草9 g,半夏9 g,壁虎4.5 g。复方组药物即原方。所有药物来自上海中医药大学附属龙华医院中药房,单味生药由上海中医药大学附属龙华医院药剂科主任中药师奚燕鉴定为正品。
5-氟尿嘧啶(5-FU)注射液,上海旭东海普药业有限公司(批号:090906);原癌基因c-myc(c-myc)蛋白、细胞周期蛋白D1(cyclin D1)、血管内皮生长因子(VEGF)、基质金属蛋白酶-2(MMP-2)、IL-6,美国Sigma公司(批号分别为ab32072、ab134175、ab46154、ab92536、ab6672);磷酸化信号转导和转录激活因子3(p-STAT3),美国Santa Cruz Biotechnology 公司(批号:T5625);甘油醛-3-磷酸脱氢酶(GAPDH)抗体,美国CST公司(批号:#5174);山羊抗兔辣根过氧化物酶(HRP)标记的二抗,碧云天生物技术有限公司(批号:A0208);山羊抗鼠HRP标记二抗,碧云天生物技术有限公司(批号:A0216);SYBR GREEN qPCR Super Mix(qPCR 试剂盒),美国Thermo Fisher Scientific 公司(批号:#K0223);逆转录试剂盒,美国Fermentas 公司(批号:#K1622);氯仿,中国医药集团有限公司(批号:10023419);TRIzol试剂,美国Invitrogen 公司(批号:1596-026);蛋白质定量试剂盒,美国Thermo Fisher Scientific 公司(批号:PICPI23223)。
1.1.4 仪器 CO2培养箱,日本Sanyo 株式会社(型号:MCO-18AIC);细胞计数仪,瑞士Roche 公司(型号:Cedex XS);超净工作台,力康生物医疗科技控股有限公司(型号:AlphaClean 1300);PCR分析仪,美国ABI公司(型号:StepOne Plus);蛋白垂直电泳系统,美国Bio-Rad 公司(型号:Mini-PROTEAN Tetra Cell);转膜仪,美国Bio-Rad公司(型号:Trans-Blot Turbo);化学发光成像系统,美国UVP公司(型号:EC3 410)。
1.2 造模 建立人胰腺癌BxPC-3 细胞裸小鼠皮下移植瘤模型[18]。采用人胰腺癌细胞株BxPC-3 体外传代培养,经胰酶消化制成细胞悬液,将1×106个(0.2 mL)细胞悬液接种于裸小鼠右前肢腋窝处皮下,每天观察成瘤情况并记录。
1.3 分组与干预 将30 只裸小鼠按随机数字表法随机分为空白对照组、5-FU组、复方组、健脾组、清热解毒组和软坚散结组,共6 组,每组5 只。以70 kg 成人体质量计算用药剂量,按人与裸小鼠药物等效剂量进行转换[19],折算每1 kg 裸小鼠需要的用药剂量,按每10 g 小鼠体质量灌胃量体积0.2 mL,计算得到各组药物煎煮浓度。不同干预组药物于同一天、同一煎药房分别进行煎煮。药材以清水浸泡30 min,煎煮30 min 后倒出药汁,将药汁按所需药物浓度进行浓缩。各组于裸小鼠造模后第2 天开始干预:复方组、健脾组、清热解毒组、软坚散结组分别给予相应的中药煎剂灌胃(每只裸小鼠0.4 mL/d,以下灌胃药液体积均同),并用质量分数为0.9%的氯化钠溶液0.04 mL 腹腔内注射,1 次/周;5-FU 组予5-FU 0.04 mL(即1 mg)腹腔内注射,1 次/周,并用质量分数为0.9%的氯化钠溶液0.4 mL灌胃,1次/d;空白对照组予质量分数为0.9%的氯化钠溶液灌胃,1 次/d,并用质量分数为0.9%的氯化钠溶液0.04 mL 腹腔内注射,1次/周。
1.4 检测指标与方法
1.4.1 裸小鼠皮下移植瘤抑瘤率 造模后第43 天,称取裸小鼠体质量,采用颈椎脱臼法处理后,完整地剥出瘤体,去除表面脂肪组织,称取瘤质量。抑瘤率=(空白对照组平均瘤质量-各治疗组平均瘤质量)/空白对照组平均瘤质量×100%。
1.4.2 IL-6/STAT3 通路及下游靶基因mRNA 的表达采用实时荧光定量逆转录聚合酶链式反应(RT-qPCR)法检测小鼠瘤组织中IL-6/STAT3 通路及下游靶基因(c-myc、cyclin D1、VEGF、MMP-2、IL-6、p-STAT3)mRNA的表达。取得裸小鼠瘤体组织后,以TRIzol 法提取瘤组织总RNA,逆转录反应体系为25 μL,根据试剂说明书操作,按条件进行逆转录。反应条件:37 ℃、60 min,85 ℃、5 min,4 ℃、5 min。扩增引物由上海闪晶分子生物科技有限公司合成(见表1)。PCR 反应条件:95 ℃、10 min,95 ℃、15 s,60 ℃、1 min,95 ℃、15 s,60 ℃、15 s;40个循环。以GAPDH的表达为内参,用2-ΔΔCt法计算目的基因的mRNA相对表达量。

表1 引物序列
1.4.3 IL-6/STAT3 通路及下游靶基因蛋白的表达 采用Western blot检测IL-6/STAT3通路及下游靶基因涉及的c-myc、cyclin D1、VEGF、MMP-2、IL-6、p-STAT3 蛋白的表达。取得裸鼠瘤体组织后,将瘤体组织剪成细小的碎片,按每20 mg 组织加入150~250 μL 裂解液的比例加入裂解液(裂解液中加入蛋白酶和磷酸酶抑制剂),匀浆器匀浆直至完全裂解。裂解后的样品4 ℃、12 000 r/min 离心15 min,取上清,进行蛋白质定量后贮存于-80 ℃冰箱,采用蛋白浓度试剂盒检测蛋白浓度。部分上清加入4倍浓度上样缓冲液,100 ℃水浴10 min,置于4%电泳浓缩胶浓缩,10%蛋白电泳分离胶分离,再经转膜、封闭,加入相应的一抗4 ℃暗盒过夜,洗膜液洗膜3 次,10 min/次。加入相应的二抗37 ℃孵育1 h,洗膜液洗膜3 次,10 min/次,采用增强型化学发光试剂荧光底物进行化学发光、显色,用凝胶成像仪拍照,以ImageJ 软件进行灰度分析。目的蛋白相对表达量=目的蛋白表达量/同一样本内参表达量。
1.5 统计学方法 实验数据采用SPSS 19.0 软件进行统计分析。计量资料以±s表示。方差齐性检验后,采用单因素方差分析对实验数据进行统计学分析,均数间多重比较采用最小显著差法(LSD 检验)。以P<0.05为差异有统计学意义。
2 结果
2.1 对裸小鼠皮下移植瘤抑瘤率的影响 与空白对照组比较,各治疗组瘤质量均减轻,瘤体积均减小,抑瘤率由低到高分别为健脾组35.87%、清热解毒组49.05%、软坚散结组64.60%、复方组70.48%、5-FU 组78.25%,WCAP 复方及其拆方和5-FU 组均可抑制裸小鼠皮下移植瘤的生长(P<0.05)。与空白对照组比较,5-FU 组和软坚散结组裸小鼠体质量降低(P<0.05),复方组、健脾组、清热解毒组差异无统计学意义(P>0.05)。复方组抑瘤率高于各拆方组,各拆方组中,软坚散结组抑瘤率最高(P<0.05)。与5-FU组比较,复方组、健脾组、清热解毒组和软坚散结组瘤体积较大,差异有统计学意义(P<0.05);与5-FU 组比较,健脾组、清热解毒组、软坚散结组瘤质量较重,差异有统计学意义(P<0.05),但复方组瘤质量差异无统计学意义(P>0.05)。与复方组比较,健脾组和清热解毒组瘤体积较大,瘤质量较重,差异均有统计学意义(P<0.05),但软坚散结组瘤体积及瘤质量差异无统计学意义(P>0.05)。与健脾组比较,清热解毒组和软坚散结组瘤体积较小,瘤质量较轻,差异有统计学意义(P<0.05)。与清热解毒组比较,软坚散结组瘤体积较小,瘤质量较轻,差异有统计学意义(P<0.05)。见表2、图1。

图1 各组裸小鼠皮下移植瘤抑瘤情况比较
表2 各组裸小鼠瘤质量、抑瘤率等比较(n=5,±s)

表2 各组裸小鼠瘤质量、抑瘤率等比较(n=5,±s)
注:5‑FU 为5‑氟尿嘧啶。与空白对照组比较,*P<0.05;与5‑FU 组比较,#P<0.05;与复方组比较,△P<0.05;与健脾组比较,▽P<0.05;与清热解毒组比较,▲P<0.05。
组别空白对照组5-FU组复方组健脾组清热解毒组软坚散结组体质量/g 24.82±0.26 23.44±0.26*22.98±0.78 23.35±1.07 24.61±0.49 23.11±0.13*瘤体积/mm3 2 095.64±216.00 281.22±31.21*606.73±68.37*#1 301.02±27.36*#△1 023.05±156.35*#△▽775.23±36.95*#▽▲抑瘤率/%-78.25 70.48 35.87 49.05 64.60瘤质量/g 2.10±0.18 0.46±0.19*0.62±0.04*1.35±0.07*#△1.07±0.11*#△▽0.73±0.03*#▽▲
2.2 对裸小鼠皮下移植瘤IL-6/STAT3通路及下游靶基因mRNA 表达的影响 与空白对照组比较,复方组、软坚散结组和5-FU 组c-myc、cyclin D1、VEGF、MMP-2、IL-6和p-STAT3的mRNA 表达降低(P<0.05)。而健脾组和清热解毒组c-myc、cyclin D1、VEGF、IL-6和p-STAT3的mRNA 表达差异无统计学意义(P>0.05)。与5-FU 组比较,健脾组和清热解毒组c-myc、cyclin D1、VEGF、MMP-2、IL-6和p-STAT3的mRNA 表达升高(P<0.05)。与复方组比较,健脾组cyclin D1、VEGF、MMP-2、IL-6和p-STAT3的mRNA 表达升高(P<0.05),清热解毒组c-myc、cyclin D1、VEGF、MMP-2、IL-6和p-STAT3的mRNA 表达升高(P<0.05)。与健脾组比较,软坚散结组cyclin D1、VEGF、IL-6和p-STAT3的mRNA 表达升高(P<0.05)。与清热解毒组比较,软坚散结组c-myc、cyclin D1、VEGF、IL-6和p-STAT3的mRNA表达升高(P<0.05)。见表3。
表3 各组裸小鼠皮下移植瘤IL-6/STAT3通路及下游靶基因mRNA表达比较(n=5,±s)
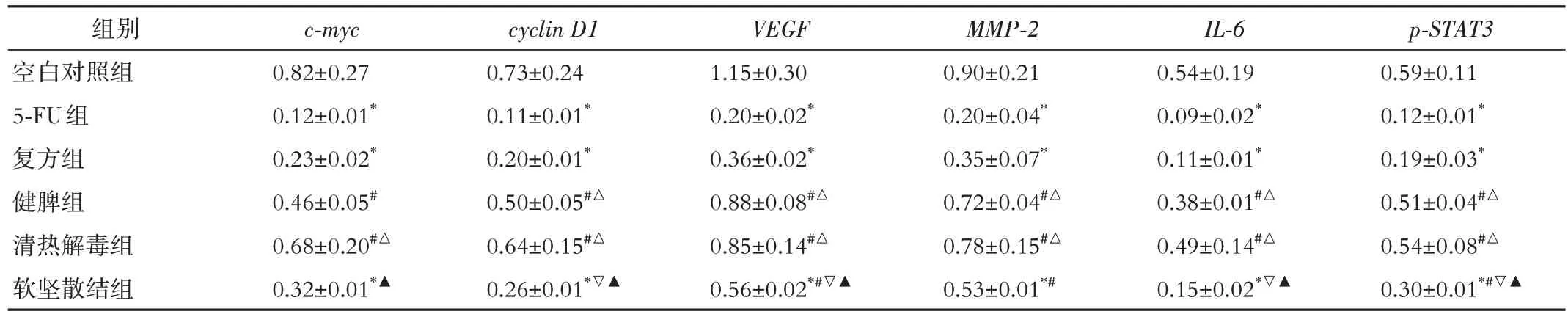
表3 各组裸小鼠皮下移植瘤IL-6/STAT3通路及下游靶基因mRNA表达比较(n=5,±s)
注:c⁃myc为原癌基因c⁃myc基因,cyclin D1为细胞周期蛋白D1基因,VEGF 为血管内皮生长因子基因,MMP⁃2为基质金属蛋白酶‑2基因,IL⁃6为白介素⁃6基因,p⁃STAT3为磷酸化信号转导和转录激活因子3基因。5⁃FU 为5⁃氟尿嘧啶。与空白对照组比较,*P<0.05;与5‑FU 组比较,#P<0.05;与复方组比较,△P<0.05;与健脾组比较,▽P<0.05;与清热解毒组比较,▲P<0.05。
p⁃STAT3 0.59±0.11 0.12±0.01*0.19±0.03*0.51±0.04#△0.54±0.08#△0.30±0.01*#▽▲组别空白对照组5-FU组复方组健脾组清热解毒组软坚散结组c⁃myc 0.82±0.27 0.12±0.01*0.23±0.02*0.46±0.05#0.68±0.20#△0.32±0.01*▲cyclin D1 0.73±0.24 0.11±0.01*0.20±0.01*0.50±0.05#△0.64±0.15#△0.26±0.01*▽▲VEGF 1.15±0.30 0.20±0.02*0.36±0.02*0.88±0.08#△0.85±0.14#△0.56±0.02*#▽▲MMP⁃2 0.90±0.21 0.20±0.04*0.35±0.07*0.72±0.04#△0.78±0.15#△0.53±0.01*#IL⁃6 0.54±0.19 0.09±0.02*0.11±0.01*0.38±0.01#△0.49±0.14#△0.15±0.02*▽▲
2.3 对裸小鼠皮下移植瘤IL-6/STAT3通路及下游靶基因蛋白表达的影响 与空白对照组比较,复方组和5-FU 组c-myc、cyclin D1、VEGF、MMP-2、IL-6 和p-STAT3的蛋白表达均降低(P<0.05),软坚散结组c-myc、MMP-2 和IL-6 的蛋白表达均降低(P<0.05)。健脾组和清热解毒组c-myc、cyclin D1、VEGF、MMP-2、IL-6 和p-STAT3 的蛋白表达差异无统计学意义(P>0.05)。与5-FU 组比较,健脾组和清热解毒组c-myc、VEGF 和IL-6的蛋白表达升高(P<0.05),软坚散结组c-myc 和IL-6 的蛋白表达升高(P<0.05)。与复方组比较,健脾组和清热解毒组c-myc 和IL-6 的蛋白表达升高(P<0.05)。见表4、图2。

图2 各组裸小鼠皮下移植瘤IL-6/STAT3通路及下游靶基因蛋白表达情况
表4 各组裸小鼠皮下移植瘤IL-6/STAT3通路及下游靶基因蛋白表达比较(n=5,±s)
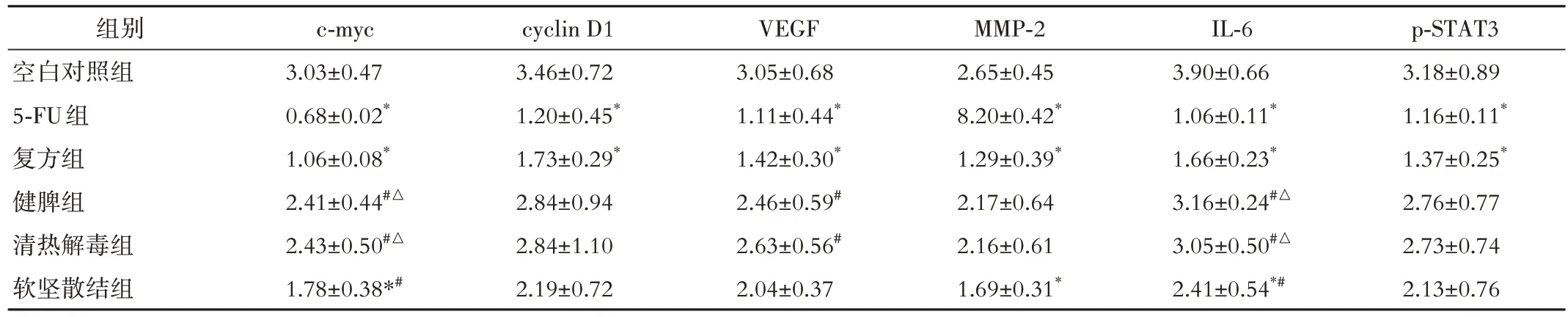
表4 各组裸小鼠皮下移植瘤IL-6/STAT3通路及下游靶基因蛋白表达比较(n=5,±s)
注:c⁃myc为原癌基因c⁃myc,cyclin D1为细胞周期蛋白D1,VEGF 为血管内皮生长因子,MMP⁃2为基质金属蛋白酶⁃2,IL⁃6为白介素⁃6,p⁃STAT3为磷酸化信号转导和转录激活因子3。5⁃FU为5⁃氟尿嘧啶。与空白对照组比较,*P<0.05;与5⁃FU组比较,#P<0.05;与复方组比较,△P<0.05。
p-STAT3 3.18±0.89 1.16±0.11*1.37±0.25*2.76±0.77 2.73±0.74 2.13±0.76组别空白对照组5-FU组复方组健脾组清热解毒组软坚散结组c-myc 3.03±0.47 0.68±0.02*1.06±0.08*2.41±0.44#△2.43±0.50#△1.78±0.38*#cyclin D1 3.46±0.72 1.20±0.45*1.73±0.29*2.84±0.94 2.84±1.10 2.19±0.72 VEGF 3.05±0.68 1.11±0.44*1.42±0.30*2.46±0.59#2.63±0.56#2.04±0.37 MMP-2 2.65±0.45 8.20±0.42*1.29±0.39*2.17±0.64 2.16±0.61 1.69±0.31*IL-6 3.90±0.66 1.06±0.11*1.66±0.23*3.16±0.24#△3.05±0.50#△2.41±0.54*#
3 讨论
目前,外科手术是唯一可能治愈胰腺癌的手段,但由于胰腺癌隐匿性高、缺乏早期临床特异性症状,只有小部分患者在诊断时适合进行手术切除;而即便已行切除,仍因其对传统治疗手段欠敏感、局部复发与远处转移率高的特征,患者的5年生存率不足10%。中医古典文献中并无“胰腺癌”的具体病名,但有类似胰腺癌的论述,例如“脾病,当脐有动气,按之牢若痛。动气筑筑然,坚牢如有积而硬,若似痛也,甚则亦大痛,有是则脾虚病也”(《脾胃论》),相关描述与胰腺癌上腹痛和腹块症状相似。
“邪之所凑,其气必虚”,胰腺癌的发生发展与脾密切相关,究其根源是脾虚所致。李东垣在《兰室秘藏》中指出:“推其百病之源,皆因饮食劳倦,而胃气元气渐散,不能滋荣百脉、灌溉脏腑、卫护周身之所致也。”健脾扶正是中医治疗胰腺肿瘤的基本法则,WCAP 是邱佳信教授及其团队以健脾法为主,辨证结合清热解毒、软坚散结等法形成的治疗胰腺癌的中药复方。临床研究[16]提示,遵循该法则的中药复方是影响胰腺癌患者生存期的独立预后因素,可以改善根治术后以及晚期胰腺癌患者的生存期,西医综合治疗联合中药的晚期胰腺癌患者生存期为12.7 个月,较单纯西医综合治疗患者的9.9个月显著延长。
现代研究发现,胰腺癌的发生与局部慢性炎症密切相关。为探讨单用清热解毒或软坚散结等“祛邪”药物力量能否取得与复方类似的肿瘤抑制作用,课题组开展了本次复方与拆方的研究。本研究通过BxPC-3细胞株悬液制备胰腺癌裸小鼠皮下接种瘤模型,研究中药复方WCAP 及其拆方对裸小鼠皮下肿瘤的影响,观察复方WCAP中对人胰腺癌BxPC-3细胞株裸小鼠皮下瘤产生影响的可能成分。本研究结果显示,抑瘤率由低到高分别为健脾组、清热解毒组、软坚散结组、复方组、5-FU 组,提示WCAP 及其拆方和5-FU 组均可抑制裸小鼠皮下移植瘤的生长(P<0.05);各拆方组中,软坚散结组抑瘤率最高。而裸小鼠体质量结果显示,5-FU组和软坚散结组裸小鼠体质量降低(P<0.05),复方组、健脾组、清热解毒组则差异无统计学意义(P>0.05),与临床所见化学疗法患者干预早期多见肿瘤明显缩小,但后期多合并有体质量下降等恶病质相似;各拆方组中,健脾组抑瘤率虽逊于软坚散结组,但后者小鼠体质量也明显降低,而加入健脾药物的复方组抑瘤率高于软坚散结组,小鼠体质量也无显著降低,体现出中医治疗注重整体观念,扶正和祛邪并重,不可一味攻邪,不拘泥于一时瘤体的大小。本研究提示,复方WCAP 组方合理,健脾益气药物扶助人体正气为治本,清热解毒联合软坚散结祛邪外出为治标,寓攻于补,一方面使机体不断适应内在环境,达到新的“稳态平衡”,另一方面可充分调节体内抗瘤机制,联合化疗使肿瘤生长速度减慢,甚至使肿瘤缩小。这与临床上接受中医药干预的化疗患者较单纯化疗患者消化道反应、骨髓抑制等不良反应减少、生活质量改善的现象相符;这也提示临床,肿瘤前期及中期,如人体正气尚强,在扶正基础上,清热解毒、软坚散结等祛邪药物剂量可稍大,以达抗瘤的目的,而至肿瘤晚期,正气耗损,则需注重扶正健脾对改善生活质量、长期生存的重要作用。
胰腺癌的发生是多环节、多步骤参与的复杂过程,尤其炎症反应在胰腺癌的发生发展中起重要作用,IL-6是STAT3 重要的细胞活化因子,通过自分泌或旁分泌途径作用于受体IL-6 Rα 和共同受体gpl30 激活JAK/STAT 信号通路,从而诱发肿瘤[20-21]。其信号通路受细胞因子、生长因子等细胞外信号刺激,作用于细胞核内特异的DNA结合位点,调节特定基因的表达,影响细胞的增殖、分化、凋亡和侵袭转移。c-myc 基因编码蛋白质是一种短半衰蛋白,能调节乳酸脱氢酶(LDH-A)、细胞周期蛋白(cyclin)、凋亡相关蛋白Bax的表达[22],从而介导细胞外的传入生物信号向细胞核内传递,调控细胞的增殖和凋亡[23]。cyclin D1 是细胞周期调节的正性调控因子,同时又是STAT3 的靶作用物之一。cyclin D1 在一定的条件下可被STAT3 激活,异常高表达cyclin D1可明显减少G1期,促进细胞通过G-S调控点,引发细胞周期的紊乱和增殖失调[24-25]。持续性激活的STAT3 信号转导通路在血管重建、浸润转移等过程中起重要作用,磷酸化STAT3蛋白可使MMP-2过度表达,导致基质降解,进而有利于肿瘤细胞的浸润转移。VEGF 是促进血管新生的生长因子,STAT3 在VEGF基因启动子区有结合位点,持续激活STAT3能诱导VEGF表达,导致肿瘤形成新生血管[26]。本实验通过观察IL-6/STAT3信号通路上相关靶基因的表达,探讨中药复方WCAP 及其拆方治疗胰腺癌的分子机制。结果显示,中药复方WCAP 可下调c-myc、cyclin D1、VEGF、MMP-2的mRNA 和蛋白表达,说明WCAP 有抑制胰腺癌增殖及转移的作用,与前期WCAP 可抑制胰腺癌生长的研究结果一致[18]。与此同时,各拆方组中,仅软坚散结组药物体现出c-myc、cyclin D1、VEGF、MMP-2的mRNA 表达降低和c-myc、MMP-2 蛋白的表达降低,其他拆方组则未显示出差异,这也与软坚散结组小鼠在所有拆方组中体质量最轻、瘤体最小的情况相符。从另一角度提示,各拆方可通过协同作用,将抗肿瘤的整体作用最大化,使得WCAP 复方在抑瘤率、小鼠带瘤体质量及IL-6/STAT3 通路及其下游靶基因调控方面作用更好。同时WCAP 可下调IL-6及p-STAT3的mRNA 和蛋白的表达,显示出WCAP 的抗肿瘤作用机制可能是通过抑制IL-6/STAT3 信号通路的活化并下调相关基因c-myc、cyclin D1、VEGF、MMP-2的表达来实现。
综上所述,本研究从IL-6/STAT3 信号通路角度阐述中药复方WCAP 及其拆方治疗胰腺癌的分子机制,为临床应用提供了一定的实验支持。进一步完善针对该信号通路的靶向治疗机制,可能对治疗胰腺癌起到积极的作用,进而达到稳定、缓解乃至更加理想的治疗效果。但是,由于胰腺癌的发病机制复杂,涉及多条通路、多靶点的共同作用,需在进一步的实验中探寻中药复方WCAP 抑制胰腺癌细胞的具体靶点,为中药治疗胰腺癌寻找更适合的途径。

