基于网络药理学及体外实验验证探讨黄连素治疗非酒精性脂肪性肝炎的作用机制
黄燕萍,伍月兰,孙明瑜1,,张 琴
1.上海中医药大学附属曙光医院(上海 201203);2.上海交通大学医学院附属同仁医院(上海 200336);3.上海中医药大学(上海 201203)
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是由多种因素导致的肝脏疾病,其特征为肝细胞脂肪变性和肝细胞损伤,伴或不伴肝纤维化,与心脑血管疾病、肝硬化、肝细胞癌的发生密切相关。NASH的发病是多种病理过程共同作用的结果,如脂毒性、氧化应激、免疫细胞调控失常、肝细胞凋亡,涉及多个靶点,最终导致肝免疫细胞浸润和炎症,肝星状细胞激活[1-3]。临床首选生活方式干预治疗本病,但多数患者无法从中获益,需采用药物治疗。然受限于“一种基因,一种药物,一种疾病”思维,临床尚无合适的单一药物治疗本病,因此具有实质药理活性的多靶点天然产物具有潜在优势[4]。
黄连素对糖脂代谢有独特的药理作用,如抗氧化、抗炎、肝细胞保护,可有效治疗糖尿病、脂肪肝,临床应用广泛[5-9],但其发挥作用的具体机制尚不清楚。本研究借助网络药理学、分子对接技术、体外细胞实验探讨黄连素治疗NASH 的潜在机制,以期为黄连素的临床应用及NASH的防治研究提供参考。
1 资料与方法
1.1 化学成分的收集与筛选 采用中药系统药理学数据库和分析平台(TCMSP,https://tcmsp-e.com/)[10]获取黄连素的药代动力学参数,以及吸收、分布、代谢和排泄(absorption、distribution、metabolism、excretion,ADME)特征性信息[11-12]。
1.2 潜在靶点的预测 通过比较毒物基因组学数据库(CTD,http://ctdbase.org/)[13]筛选黄连素的候选靶基因,设置阈值化学-基因相互作用≥1,并去除非人源基因。在人类基因综合数据库(GeneCards,https://www.genecards.org)中搜索“non-alcoholic steatohepatitis”以获得NASH 相关基因。借助Bioinformatics 工具获得黄连素靶基因与NASH 相关基因的交集,即为黄连素靶向NASH的基因。
1.3 “黄连素-目标基因-通路”网络的构建与分析 使用Cytoscape v3.6.1 软件(https://www.nigms.nih.gov/)构建“黄连素-目标基因-通路”网络图。
1.4 基因互作网络分析 将靶基因导入GeneMANIA(http://www.genemania.org)和String(https://string-db.org)数据库,分析黄连素作用于NASH 的相关基因,探讨基因互作网络关系并得到网络中的hub基因。
1.5 靶点的通路分析 借助WebGestalt(http://www.webgestalt.org)数据库对靶基因进行基因本体(GO)、京都基因与基因组百科全书(KEGG)和基因探针(GSEA)通路富集分析[14]。
1.6 分子对接 使用webina 数据库(https://durrantlab.pitt.edu/webina/)[15]进行分子对接,上传PDB 格式的候选基因的晶体结构和黄连素MOL2格式信息至webina,相关参数均设置为默认值,用于分析黄连素与多种蛋白的结合潜力。
1.7 体外细胞实验验证
1.7.1 细胞培养与干预 小鼠正常肝细胞(AML12)购自美国菌种保藏中心(ATCC)(批号:CRL-2254),采用含10%胎牛血清及1%青霉素-链霉素的DMEM/F12 基础培养基进行培养,培养条件为37 ℃、5%CO2。
1.7.2 药物与试剂 黄连素,美国TargetMol 公司(批号:T4S0797);DMEM/F12基础培养基,中国中乔新舟生物科技有限公司(批号:ZQ-606); 二甲基亚砜(DMSO),美国Sigma-Aldrich公司(批号:C6164-50ML);TRIzol,生工生物工程(上海)股份有限公司(批号:B511311-0100);RNA 反转录试剂盒、荧光定量试剂盒,日本Takara株式会社(批号分别为RR047B、RR820B)。
1.7.3 主要仪器 PCR 热循环仪(型号:A24811)、实时荧光定量PCR 仪(型号:A31665),美国Thermo Fisher公司。
1.7.4 细胞分组与干预 AML12 细胞密度达80%~90%后传代培养于含有棕榈酸(PA)200 μmol/L 的培养基中,设为模型组;在此基础上,给予梯度浓度的黄连素(6.25、12.5、25、50 μmol/L)进行干预,分别设为黄连素6.25、12.50、25.00、50.00 μmol/L 组;另取AML12 细胞培养于不含PA 的正常培养基中,正常培养不予处理,设为空白组。各组均培养诱导24 h,用于后续实验。
1.7.5 实时荧光定量逆转录聚合酶链式反应(RTqPCR)法检测相关基因表达 取适量AML12 细胞并转移至EP 管中,加入TRIzol 提取总RNA,加入逆转录酶进行逆转录制备cDNA。以甘油醛-3-磷酸脱氢酶基因(GAPDH)为内参进行PCR 扩增,检测各组AML12 细胞中前列腺素内过氧化物合酶2(PTGS2)、CC趋化因子配体2(CCL2)和Toll 样受体4(TLR4)mRNA 的表达水平。反应条件:95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸25 s;40 个循环。扩增引物由苏州金唯智生物科技有限公司合成。引物序列见表1。各组均设3 个复孔。以2-ΔΔCt法表示PTGS2、CCL2和TLR4mRNA的相对表达量。

表1 引物序列
1.8 统计学方法 所有分析均使用所用工具的默认值进行。计量资料以±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。CTD 的查询结果中仅显示得分≥1 的预测候选目标蛋白。所有报告的P值均为双尾,以P<0.01为差异有统计学意义。
2 结果
2.1 黄连素的药代动力学特性 借助TCMSP 共得到黄连素的12种AMDE特性。见表2。

表2 黄连素的药理和分子特性
2.2 潜在靶点的预测 借助CTD 数据库筛选黄连素的靶基因,去除非人源基因后,共得到250 个黄连素作用的靶基因。借助GeneCards 数据库共得到NASH 相关基因501 个。通过Bioinformatics 工具获得黄连素靶基因与NASH 相关基因的交集,即为黄连素靶向NASH的基因,主要包括炎症因子及转录因子。见表3、图1。
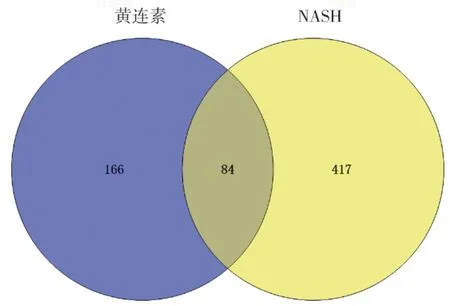
图1 黄连素治疗非酒精性脂肪性肝炎(NASH)靶点

表3 黄连素靶向非酒精性脂肪性肝炎的基因(度数前10者)
2.3 “黄连素-目标基因-通路”网络的构建与分析 根据目标和途径分析,我们借助Cytoscape v3.6.1 软件构建了“黄连素-目标基因-通路”网络,包括65 个节点和217个边缘。见图2。

图2 “黄连素-目标基因-通路”网络图
2.4 基因互作网络分析 将靶基因导入GeneMANIA,发现37.05%的基因具有物理相互作用,20.16%发挥了共定位作用,19.43%具有相似的共表达特性,其他还有相关途径、共有的蛋白质结构域和遗传相互作用。见图3。

图3 基因互作网络
将靶基因导入String数据库(PPI得分>0.7)构建PPI网络,PPI网络由84 个交互节点和517 个交互边缘组成(见图4)。本研究选取了度数最大的10 个节点作为关键基因,分别是白介素-10(IL-10)、PTGS2、血红素加氧酶1(HMOX1)、CCL2、重组人白介素8(CXCL8)、TLR4、JUN 原癌基因(JUN)、基质金属蛋白酶9(MMP9)、肿瘤坏死因子(TNF)、白介素-6(IL-6)。见图5。

图4 黄连素治疗非酒精性脂肪性肝炎的靶点基因互作网络示例
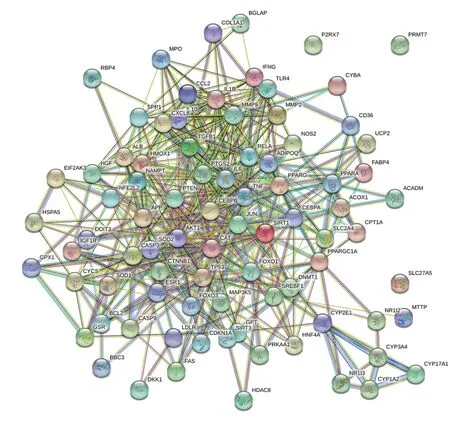
图5 黄连素治疗非酒精性脂肪性肝炎的靶基因
2.5 靶点的通路分析 如图6 所示,GO 分析富集在前面的功能分别是炎症反应(GO:0006954)、外部刺激反应的调节(GO:0032101)、蛋白质代谢过程的负调控(GO:0051248)、压力反应的调节(GO:0080134)、细胞蛋白质代谢过程的负调控(GO:0032269)、免疫系统过程的调控(GO:0002682)、分子功能正调控(GO:0044093)、防御反应(GO:0006952)、细胞内信号转导的调控(GO:1902531),这些功能性术语与脂代谢、抗炎反应高度相关。

图6 黄连素治疗非酒精性脂肪性肝炎靶点的GO富集分析
KEGG 通路分析显示,靶基因显著富集在AGERAGE 糖尿病并发症的信号通路(hsa04933)及非酒精性脂肪性肝病(NAFLD)(hsa04932)、胰岛素抵抗(hsa04931)、动脉粥样硬化的流体剪切力(hsa05418)、乙型肝炎(hsa05161)等通路。NASH 的主要病理是肝细胞脂肪变和炎症,伴有肝细胞的坏死和炎症细胞浸润。上述生物学过程或病理变化可能参与NASH 的致病,而这些病理变化可采用黄连素进行治疗。见图7。

图7 黄连素治疗非酒精性脂肪性肝炎靶点的KEGG通路分析
2.6 分子对接 上传黄连素的MOL2结构信息至webina,用于分析其与IL-10、PTGS2、HMOX1、CCL2、CXCL8、TLR4、JUN、MMP9、TNF、IL-6的结合潜力。结果表明,黄连素与TLR4、CCL2、MMP9、CXCL8蛋白之间存在强相互作用,提示黄连素对NASH具有治疗作用。见图8。

图8 分子对接示意图
2.7 体外细胞实验验证 体外细胞实验结果显示,与空白组比较,模型组PTGS2、CCL2和TLR4mRNA 表达升高(P<0.01);与模型组比较,黄连素各剂量组PTGS2、CCL2和TLR4mRNA 表达降低(P<0.01),并呈现剂量依赖趋势。见图9。

图9 黄连素对小鼠正常肝细胞相关基因表达的影响
3 讨论
NASH 是造成肝脏损伤、肝脏不良结局的常见疾病,近年来其患病率呈不断上升趋势[16]。深入了解疾病的病因和发病机制十分必要,网络药理学为中药多成分、多途径和多靶点的作用机制研究提供了参考[17]。药代动力学特性是药物最重要的特征[18],Lipinski 的5条规则认为,满足分子量介于180~500 Da、油水分配系数<5、氢键供体<5、氢键受体<10 的化合物更具有可药性[19]。我们从TCMSP 数据库中获得了黄连素的12个非常重要的药代动力学特性,满足Lipinski 规则,这意味着黄连素治疗NASH具有一定的前景。
在药物开发中,目标基因鉴定是第一步。本研究共鉴定出与NASH 相关的基因501 个,匹配后得到与黄连素靶点重叠的基因84 个。GeneMANIA 可以提供有关物理相互作用、共定位、共表达以及共有蛋白结构域的信息,由此提示靶标及其相互作用蛋白可能具有相同或相似的功能。为了更深入地了解黄连素对NASH的影响,我们对靶基因进行了GO 功能分析和KEGG 通路富集分析。GO 分析结果表明,黄连素靶基因主要与炎症反应、应激反应过程、代谢过程的负调控及免疫系统的调控等相关。KEGG通路分析结果表明,黄连素靶基因显著富集在NAFLD 信号通路、胰岛素抵抗信号通路、AMPK信号通路、乙型肝炎信号通路,上述途径参与了NASH 进程中的关键步骤。已有研究[20-21]表明,黄连素可以通过激活凋亡途径发挥调节脂代谢、抗氧化、抗炎,甚至抗肿瘤等药理作用。脂肪肝及其并发症的发病机制复杂,多靶标的药物治疗更为有效。本研究中的药物目标网络揭示了黄连素具有多靶标、多层次作用的特点,具有多种药理活性。这与既往研究[22]结果一致,即黄连素可以通过靶向多种蛋白质和途径发挥系统的药理作用。
已有研究证实,NASH 患者的基因表达会发生变化,这些研究多聚焦在细胞或动物中基因的转录水平。PTGS2 是合成前列腺的关键速率限制酶,也是重要的促炎因子和治疗炎症疾病的核心目标。PTGS2 参与了NASH 的发展,选择性PTGS2 抑制剂可以显著改善NASH 模型小鼠的肝脂肪变性、炎症和肝损伤;作为炎症和氧化应激的桥梁,PTGS2 不仅能够产生炎症细胞因子,也是脂质代谢中的重要酶[23]。CCL2 是CC 趋化因子家族的小分子量细胞因子,在NASH 的发展过程中,CCL2 及其受体在肝脏中的水平上调,从而促进巨噬细胞的积聚,发生炎症、纤维化和脂肪变性,可见CCL2 与肝脏炎症密切相关[24-25]。NASH 患者的循环血CCL2 水平持续升高,提示高CCL2 水平可以促进NASH的进展[26-27]。TLR4 是TLR 家族中最有特色的成员,通常起模式识别受体的作用,与NASH 的发病密切相关[28]。TLR4 激活后,核因子(NF)-κB 途径随之被一系列下游信号激活,从而产生促炎分子[29]。黄连素可以通过抑制TLR4活性来发挥肝脏保护作用[30-31]。本研究中的体外细胞实验结果显示,与空白组相比,模型组PTGS2、CCL2、TLR4mRNA 表达升高;黄连素干预后,PTGS2、CCL2、TLR4mRNA 表达呈现剂量依赖性降低,为临床用药提供理论了一定依据。
综上,黄连素可以靶向调控NASH 发生发展过程中的关键分子构成的网络,进而发挥系统药理作用,有望被开发为一种安全有效的抗NASH药物。

