CCCTC结合因子对翼状胬肉中B淋巴细胞瘤-2基因表达的调控及其机制
殷秀琴 于莉 易璐 方家华
长沙市第一医院眼科,长沙 410005
翼状胬肉是一种良性增生性眼部疾病,向角膜表面进行性生长,导致眼部异物感、眼球运动障碍及视物遮挡[1-3]。病理学研究显示,翼状胬肉的主要成分是大量异常增生的成纤维细胞和新生血管,成纤维细胞的病理性增生是翼状胬肉形成和发展的主要因素[4-5]。因此探明翼状胬肉成纤维细胞病理性增生的分子机制是解析该病发病机制及靶向治疗的关键。B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)是一种原癌基因,具有明显抑制细胞凋亡的作用[6-7]。已有研究证实,翼状胬肉组织中过度表达的Bcl-2通过抑制成纤维细胞及上皮细胞凋亡,导致其过度增生,是翼状胬肉形成的重要原因[8-10]。目前,Bcl-2在翼状胬肉中过度表达的分子机制还不明确。Bcl-2基因启动子-483~-1 065 bp区域包含多个CCCTC结合因子(CCCTC binding factor,CTCF)结合位点,而且该区域含有多个CpG岛,为DNA甲基化敏感区域。DNA发生甲基化修饰后会导致DNA结构超螺旋,进而阻遏基因转录,引起基因转录沉默;而去甲基化则会使DNA结构松散,促进基因转录[11-12]。研究显示,CTCF能介导靶基因DNA发生去甲基化,上调靶基因的表达[13-14]。CTCF与Bcl-2的调控关系以及CTCF与翼状胬肉的关系目前均未见研究报道。本研究拟通过检测翼状胬肉中CTCF表达水平、Bcl-2基因DNA甲基化水平,以及CTCF与Bcl-2基因DNA甲基化水平的关系,阐述翼状胬肉中Bcl-2异常表达的分子机制。
1 材料与方法
1.1 材料
1.1.1标本来源与采集 收集2017年6月至2019年2月在长沙市第一医院眼科行翼状胬肉切除联合自体角膜缘干细胞移植术的22例原发性翼状胬肉患者翼状胬肉组织作为翼状胬肉组,其中男12例,女10例,平均年龄(50.4±9.1)岁;采集同期行修复手术的20例眼外伤患者少量正常结膜组织作为正常结膜组,其中男13例,女7例,平均年龄(48.3±10.9)岁。翼状胬肉组纳入标准:原发性翼状胬肉。排除标准:眼局部损伤引起的结膜异常增生;复发性翼状胬肉。正常结膜组纳入标准:结膜裂伤、眼球破裂伤或眼球穿通伤的眼外伤患者。排除标准:结膜炎、结膜肿物等结膜相关疾病患者。用生理盐水充分洗净术中切取的翼状胬肉组织和正常结膜组织表面血液,修剪组织后立即置于液氮中保存。2个组患者年龄、性别等一般资料比较差异均无统计学意义(均P>0.05)。本研究方案通过长沙市第一医院伦理委员会审批(批文号:KL-2017021),所有标本来源患者均签署知情同意书。
1.1.2主要试剂及仪器 Trizol、青霉素/链霉素混合双抗、Ⅱ型胶原酶、DMEM培养基、胰蛋白酶、胎牛血清、Lipofectamine 3000(美国Invitrogen公司);PrimeScriptTM逆转录试剂盒、SYBR Green荧光染料(日本TaKaRa公司);蛋白酶抑制剂、RIPA细胞裂解液、SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术有限公司);PVDF膜(美国Millipore公司);BCA试剂盒(美国Merck公司);鼠抗人CTCF抗体、鼠抗人Bcl-2抗体、鼠抗人3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、羊抗鼠IgG抗体、鼠抗人波形蛋白抗体、ECL化学发光法检测试剂盒、DAB显色试剂盒(美国Cell Signaling Technology公司);基因组DNA提取试剂盒(北京天根生化科技有限公司);EpiTect Fast DNA Bisulfite试剂盒(德国Qiagen公司);CTCF干扰质粒pRS-CTCF、对照质粒pRS(美国OriGene公司);细胞计数试剂盒(cell counting kit-8,CCK-8)(日本同仁化学公司)。Light Cycler96实时荧光定量PCR仪(瑞士Roche公司);微量电动组织匀浆器(美国Kimble公司)。
1.2 方法
1.2.1实时荧光定量PCR检测各组CTCF、Bcl-2的mRNA表达水平 将翼状胬肉组和正常结膜组组织剪成小块,加入液氮迅速研磨粉碎并加入1 ml Trizol,转入离心管中,使用电动组织匀浆器充分匀浆;4 ℃条件下12 000×g离心5 min,取上清,按每1 ml加入200 μl氯仿,常规Trizol法抽提总RNA。使用逆转录试剂盒将总RNA逆转录成cDNA,并以cDNA为模板采用SYBR Green荧光染料法进行实时荧光定量PCR。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火及延伸35 s,共40个循环。基因引物序列见表1,以GAPDH为内参照,采用2-ΔΔCt法计算各目的基因的相对表达量。
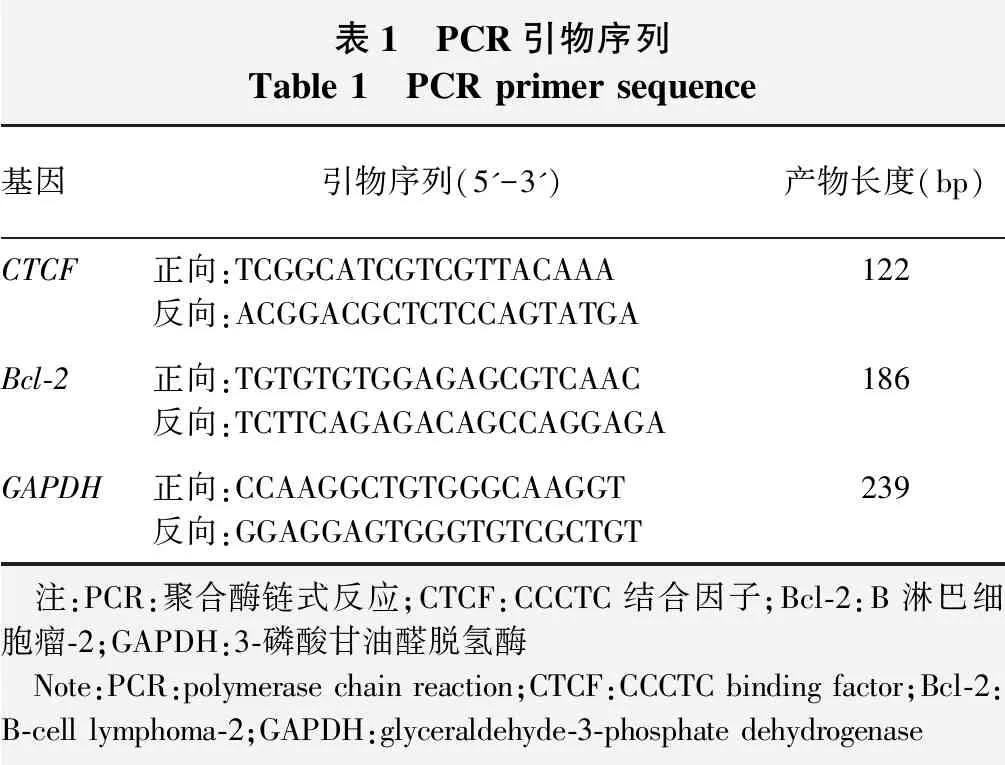
表1 PCR引物序列Table 1 PCR primer sequence基因引物序列(5'-3')产物长度(bp)CTCF正向:TCGGCATCGTCGTTACAAA反向:ACGGACGCTCTCCAGTATGA122Bcl-2正向:TGTGTGTGGAGAGCGTCAAC反向:TCTTCAGAGACAGCCAGGAGA186GAPDH正向:CCAAGGCTGTGGGCAAGGT反向:GGAGGAGTGGGTGTCGCTGT239 注:PCR:聚合酶链式反应;CTCF:CCCTC结合因子;Bcl-2:B淋巴细胞瘤-2;GAPDH:3-磷酸甘油醛脱氢酶 Note:PCR:polymerase chain reaction;CTCF:CCCTC binding factor;Bcl-2:B-cell lymphoma-2;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
1.2.2Western blot法检测各组CTCF、Bcl-2的蛋白表达水平 取翼状胬肉组和正常结膜组样本尽量剪碎,加入含蛋白酶抑制剂的RIPA细胞裂解液,于冰上进行匀浆裂解30 min,4 ℃、12 000×g离心5 min,收集上清即为总蛋白提取液,BCA试剂盒测定浓度。每个样本约取30 μg 总蛋白进行SDS-PAGE凝胶电泳,并将蛋白质转印到PVDF膜,使用质量分数5%脱脂牛奶室温封闭1 h,加入抗CTCF抗体(1∶300)、抗Bcl-2抗体(1∶300)、抗GAPDH抗体(1∶500),4 ℃孵育过夜;PBS漂洗3次后加入羊抗鼠二抗(1∶1 000)室温孵育1 h,使用ECL化学发光法显影,以GAPDH为内参照,采用ImageJ分析软件计算各目的蛋白相对表达量。
1.2.3亚硫酸氢盐处理后测序检测各组Bcl-2启动子DNA甲基化水平 通过Meth-primer在线分析Bcl-2启动子DNA序列,预测CpG岛并设计亚硫酸氢盐处理后测序法(bisulfite sequencing PCR,BSP)引物,共使用2对引物分别对CpG岛的不同区段(-465~-729 bp,-746~-1 073 bp)进行扩增,BSP引物序列见表2。取翼状胬肉组和正常结膜组样本尽量剪碎,加入液氮冷冻后研磨,使用基因组DNA提取试剂盒提取基因组DNA。使用EpiTect Fast DNA Bisulfite试剂盒处理和纯化基因组DNA,所得DNA用于后续PCR反应。PCR扩增及克隆完成后进行测序,分别统计各个样本的测序结果(每样本克隆数≥5),得出每个样本单个CG位点的甲基化百分比。每个样本所有位点甲基化百分比相加后除以位点数得到检测区域的平均甲基化水平。

表2 Bcl-2启动子BSP引物序列Table 2 BSP primer sequence of Bcl-2 promoter扩增位置正向引物(5'-3')反向引物(5'-3')产物长度(bp)-465^-729 bpTAGGTTTGAGTAGAAGGTTTAAAACCCTCCTCTAAACCACC264-746^-1 073 bpAGAGGATAGGTATTATAGTTTTCCCCCCTAAACCCCCTCTT327 注:Bcl-2:B淋巴细胞瘤-2;BSP:亚硫酸氢盐处理后测序法 Note:Bcl-2:B-cell lymphoma-2;BSP:bisulfite sequencing PCR
1.2.4翼状胬肉成纤维细胞的分离培养及鉴定 取3例翼状胬肉患者术中切除的翼状胬肉,立即置入含无菌生理盐水的EP管内,用预冷的含100 U/ml(商品单位)青霉素和链霉素的PBS重复漂洗至溶液变澄清。将标本剪碎成约1 mm3的小块,置于含1 mg/ml Ⅱ型胶原酶的无血清DMEM培养基中37 °C消化2 h,直接加入质量分数0.05%胰蛋白酶消化10 min,200×g离心10 min收集沉淀的细胞。将细胞重悬于含体积分数10%胎牛血清、100 U/ml(商品单位)青霉素和链霉素的DMEM完全培养基中培养过夜。去除未贴壁的细胞,贴壁细胞在DMEM完全培基中继续培养,传代4代后使用。无菌盖玻片经多聚赖氨酸处理后放入6孔板中,将细胞悬液滴在盖玻片上,于培养箱培养24 h;多聚甲醛固定细胞15 min,PBS冲洗3次,经双氧水和山羊血清处理后,加入鼠抗人波形蛋白抗体(1∶300),以PBS代替一抗作为阴性对照,4 °C孵育过夜;PBS漂洗后加入辣根过氧化物酶标记的羊抗鼠IgG(1∶1 000),室温孵育1 h,DAB显色剂显色后于光学显微镜下观察。
1.2.5翼状胬肉成纤维细胞的分组及转染 将翼状胬肉成纤维细胞接种到6孔板分成2个组,其中CTCF干扰组使用Lipofectamine 3000转染试剂转染CTCF干扰质粒pRS-CTCF,对照组转染空白质粒pRS。转染后48 h收集细胞分别抽提总RNA及基因组DNA,采用实时荧光定量PCR检测CTCF、Bcl-2表达水平,采用BSP法检测Bcl-2启动子DNA甲基化水平。
1.2.6CCK-8法检测转染细胞的增生活性 先分别将CTCF干扰质粒和空白质粒转染进翼状胬肉成纤维细胞,每组转染细胞培养后6 h按4×103个/孔的密度分别接种于96孔板,每组设置6个复孔,每组共接种3块板。分别于转染后12、24和48 h进行检测。检测前更换培养基后每孔加入10 μl CCK-8试剂,37 °C培养2 h,测量波长450 nm处吸光度(absorbance,A)值。细胞活力抑制率=(对照组A值-CTCF干扰组A值)/对照组A值×100%。
1.3 统计学方法

2 结果
2.1 翼状胬肉组与正常结膜组中CTCF和Bcl-2 mRNA和蛋白相对表达量比较
翼状胬肉组CTCF mRNA和蛋白相对表达量分别为7.23±3.34和0.92±0.21,明显高于正常结膜组的1.10±0.44和0.28±0.07,差异均有统计学意义(t=-8.136、-13.025,均P<0.01)。翼状胬肉组Bcl-2 mRNA和蛋白相对表达量分别为10.27±4.64和0.95±0.27,明显高于正常结膜组的1.10±0.41和0.32±0.14,差异均有统计学意义(t=-8.789、-10.782,均P<0.01)(图1)。
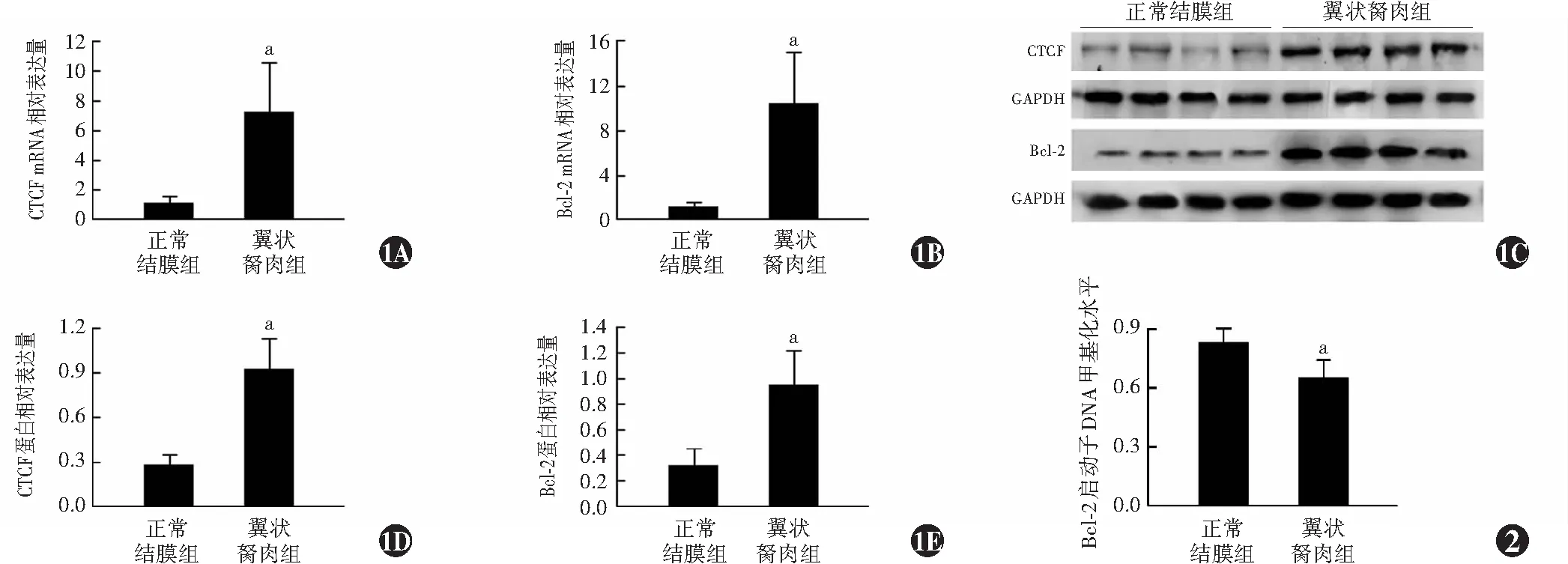
图1 正常结膜组与翼状胬肉组中CTCF和Bcl-2 mRNA及蛋白表达比较(正常结膜组n=20,翼状胬肉组n=22) A、B:各组CTCF和Bcl-2 mRNA相对表达量比较 与正常结膜组比较,aP<0.01(独立样本t检验) C:各组CTCF和Bcl-2蛋白表达电泳图 翼状胬肉组CTCF和Bcl-2蛋白条带灰度明显强于正常结膜组 D、E:各组CTCF和Bcl-2蛋白相对表达量比较 与正常结膜组比较,aP<0.01(独立样本t检验) Bcl-2:B淋巴细胞瘤-2;CTCF:CCCTC结合因子;GAPDH:3-磷酸甘油醛脱氢酶 图2 正常结膜组与翼状胬肉组中Bcl-2启动子DNA甲基化水平比较 与正常结膜组比较,aP<0.01(独立样本t检验,正常结膜组n=20,翼状胬肉组n=22) Bcl-2:B淋巴细胞瘤-2
2.2 翼状胬肉组与正常结膜组中Bcl-2启动子DNA甲基化水平比较
翼状胬肉组Bcl-2启动子DNA甲基化水平为0.65±0.09,明显低于正常结膜组的0.83±0.06,差异有统计学意义(t=7.408,P<0.01)(图2)。
2.3 翼状胬肉组织中Bcl-2 mRNA与CTCF蛋白及Bcl-2启动子DNA甲基化的相关性
翼状胬肉组织中CTCF蛋白相对表达量与Bcl-2 mRNA相对表达量呈显著正相关(r=0.746,P<0.01)。Bcl-2启动子DNA甲基化水平与Bcl-2 mRNA表达水平呈显著负相关(r=-0.635,P<0.01)(图3)。
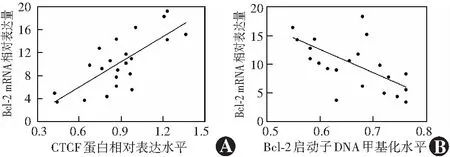
图3 翼状胬肉组织中Bcl-2 mRNA与CTCF蛋白及Bcl-2启动子DNA甲基化水平相关性散点图(Pearson线性相关分析,n=22) A:Bcl-2 mRNA与CTCF蛋白表达水平呈显著正相关 r=0.746,P<0.01 B:Bcl-2 mRNA表达水平与基因启动子甲基化水平呈明显负相关 r=-0.635,P<0.01 Bcl-2:B淋巴细胞瘤-2;CTCF:CCCTC结合因子
2.4 体外培养翼状胬肉成纤维细胞的鉴定
倒置显微镜下观察培养的细胞形态以长梭形为主,分布均匀(图4A)。免疫组织化学染色可见细胞质中波形蛋白染色呈棕黄色阳性染色,而阴性对照细胞无着色(图4B,C)。结合形态学及免疫组织化学的结果基本鉴定为成纤维细胞。

图4 体外培养翼状胬肉成纤维细胞鉴定 A:倒置显微镜下观察培养的细胞(×100,标尺=200 μm) 细胞形态均一且多呈长梭形,分布较均匀,密度较高时呈鱼群状或放射状 B:细胞爬片波形蛋白免疫组织化学染色(DAB ×200,标尺=100 μm) 细胞质中波形蛋白染色呈棕黄色阳性染色 C:细胞爬片波形蛋白免疫组织化学染色阴性对照(DAB ×200,标尺=100 μm) 细胞无着色
2.5 各转染组细胞CTCF和Bcl-2 mRNA及蛋白表达比较
CTCF干扰组CTCF和Bcl-2 mRNA相对表达量分别为0.37±0.03和0.53±0.06,均明显低于对照组的1.02±0.06和0.99±0.07,差异均有统计学意义(t=20.035、9.029,均P<0.01)。CTCF干扰组CTCF和Bcl-2蛋白相对表达量分别为0.23±0.06和0.56±0.07,明显低于对照组的0.52±0.05和0.92±0.12,差异均有统计学意义(t=6.914、4.719,均P<0.01)(图5)。
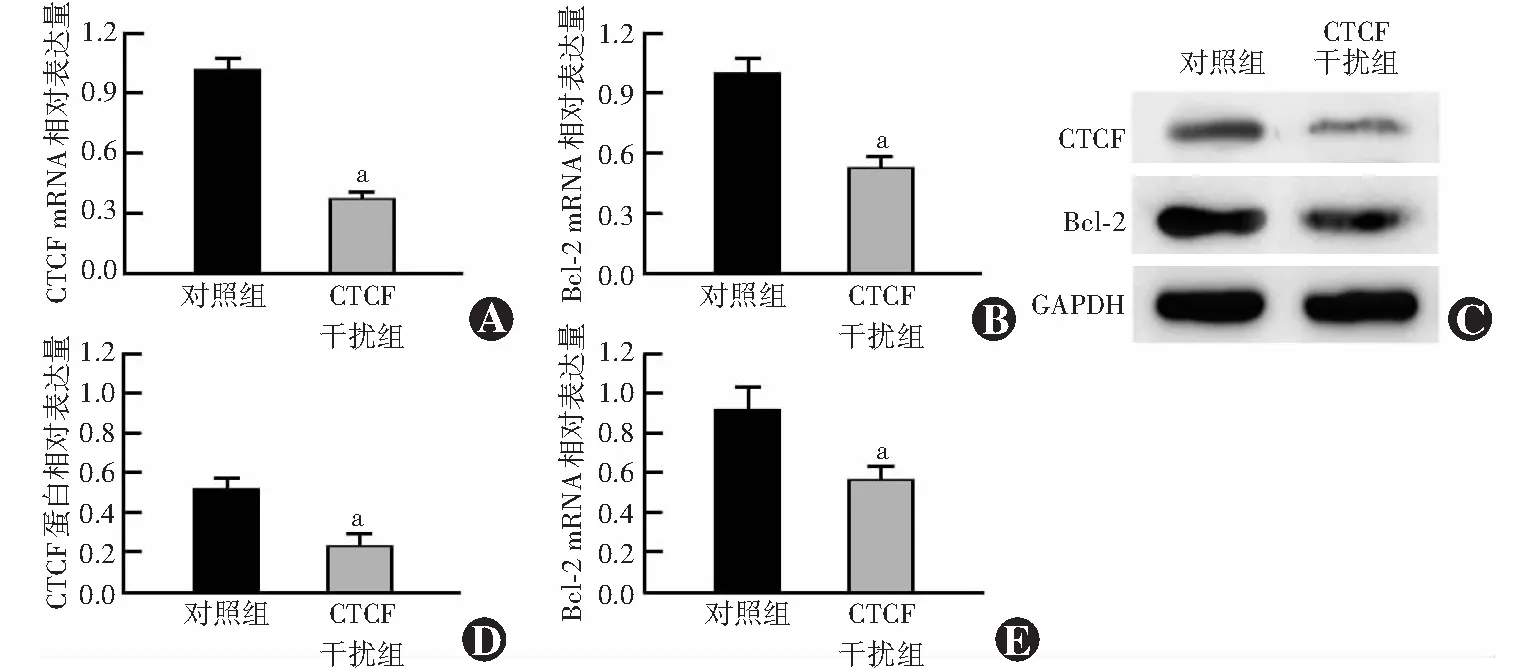
图5 CTCF干扰组与对照组CTCF和Bcl-2 mRNA及蛋白表达比较 A、B:各组CTCF和Bcl-2 mRNA相对表达量比较 与对照组比较,aP<0.01(独立样本t检验,n=3) C:各组CTCF和Bcl-2蛋白表达电泳图 CTCF干扰组CTCF和Bcl-2蛋白条带灰度明显弱于对照组 D、E:各组CTCF和Bcl-2蛋白相对表达量比较 与对照组比较,aP<0.01(独立样本t检验,n=3) CTCF:CCCTC结合因子;Bcl-2:B淋巴细胞瘤-2;GAPDH:3-磷酸甘油醛脱氢酶
2.6 各转染组细胞增生活性比较
CTCF干扰组转染后12、24和48 h细胞活力分别为0.10±0.01、0.17±0.01和0.38±0.04,明显低于对照组的0.12±0.01、0.29±0.01和0.85±0.06,差异均有统计学意义(t=3.718、18.350、15.621,均P<0.01)。CTCF干扰组转染后12、24和48 h细胞活力抑制率分别为(17.00±0.05)%、(41.00±0.05)%和(55.00±0.07)%(图6)。
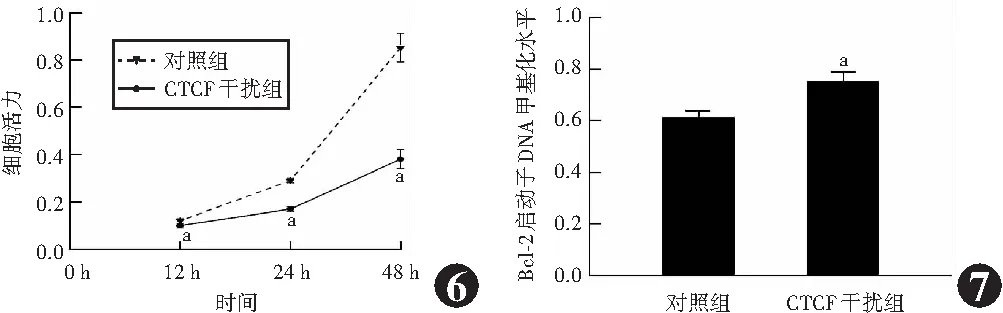
图6 各转染组不同时间点细胞活力比较 与同时间点对照组比较,CTCF干扰组细胞活力明显下降,aP<0.01(独立样本t检验,n=3) CTCF:CCCTC结合因子 图7 各转染组Bcl-2启动子DNA甲基化水平比较 与对照组比较,aP<0.01(独立样本t检验,n=3) Bcl-2:B淋巴细胞瘤-2;CTCF:CCCTC结合因子
2.7 各转染组Bcl-2启动子DNA甲基化水平比较
CTCF干扰组Bcl-2启动子DNA甲基化水平为0.75±0.04,明显高于对照组的0.61±0.03,差异有统计学意义(t=-4.472,P<0.01)(图7)。
3 讨论
CTCF是一种高度保守的具有多锌指结构的多功能转录因子,调控基因的转录[15-16]。CTCF对于不同基因发挥不同的调控作用,能结合到MYC原癌基因、Bax、HomeoboxA10等基因的启动子区,作为绝缘子阻碍相邻顺式元件对基因转录的启动[17-19]。然而,CTCF也可以结合到淀粉样β前体蛋白(amyloid beta precursor protein,APP)启动子作为转录激活剂,上调APP的转录[20]。CTCF的靶基因中有很多与细胞凋亡和增生相关,异常表达的CTCF能介导众多肿瘤细胞抵抗凋亡,导致其恶性增生[19,21-22]。大量研究证实成纤维细胞的异常增生与分化是翼状胬肉形成的关键因素[23-24]。Shen等[9]研究发现,翼状胬肉组织中微小RNA(micro RNA,miR)-15a的表达显著低于正常结膜组织,miR-15a的靶基因Bcl-2表达升高;在翼状胬肉上皮细胞中过表达miR-15a可以下调Bcl-2的表达,促进细胞凋亡。本研究结果显示,翼状胬肉组织中CTCF、Bcl-2的表达均较正常结膜组织明显升高,且二者的表达水平呈显著正相关;CTCF干扰组细胞中Bcl-2表达水平显著下调,细胞活力明显下降。这一发现完善了翼状胬肉组织中Bcl-2过度表达的分子机制,证实CTCF是Bcl-2表达的重要促进因子,从而参与翼状胬肉的疾病进程。
DNA甲基化是指在DNA甲基转移酶作用下,将甲基转移到CpG二核苷酸的脱氧胞嘧啶第5位碳原子,形成5mC的过程[25]。DNA去甲基化是在TET(ten-eleven-translocation)蛋白家族介导的羟甲基化作用下开始的,通过一系列氧化还原反应最终会去除5mC,将甲基化胞嘧啶转化为未修饰的胞嘧啶[26]。Wiehle等[27]研究发现,CTCF可以与TET家族蛋白相互作用,介导胚胎干细胞发育相关基因的DNA去甲基化。在B细胞慢性淋巴细胞及结肠癌细胞等肿瘤细胞中,Bcl-2基因DNA低甲基化导致Bcl-2过度表达,参与肿瘤细胞的恶性增生[28-29]。本研究发现翼状胬肉中Bcl-2启动子区DNA甲基化水平显著低于正常结膜组织,且Bcl-2 DNA甲基化水平与其mRNA水平呈显著负相关,说明DNA低甲基化是Bcl-2在翼状胬肉中异常表达的重要原因。此外,在翼状胬肉成纤维细胞中干扰CTCF表达后,Bcl-2启动子DNA甲基化水平显著上调。因此推测过度表达的CTCF是Bcl-2启动子低甲基化的重要原因。
综上所述,过度表达的CTCF介导Bcl-2启动子低甲基化,导致Bcl-2异常高表达,引起翼状胬肉成纤维细胞凋亡/增生失衡,参与翼状胬肉的形成。这一发现不仅完善了翼状胬肉成纤维细胞凋亡及增生失衡的分子调节机制,更为翼状胬肉患者的治疗提供了有效的生物靶点。但本研究未探明CTCF与DNA甲基化/去甲基化相关修饰酶等调节DNA甲基化的直接效应分子之间的相互作用,在后续的研究中我们会进一步完善翼状胬肉中CTCF参与Bcl-2启动子DNA低甲基化的分子机制。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明殷秀琴:参与研究选题、研究实施、论文撰写;方家华:参与研究选题、实验指导、论文修改和定稿;于莉、易璐:参与研究实施、数据分析

