虾青素对晶状体上皮细胞氧化应激损伤的抑制作用及其机制
李勇 刘钊臣 彭华琮
1孝感爱尔眼科医院,孝感 432000;2孝感市中心医院眼科,孝感 432000;3武汉艾格眼科医院,武汉 430019
白内障是一种由氧化损伤、钙紊乱、年龄、遗传等多种因素诱发的致盲眼病,其表现为晶状体混浊。晶状体的透明性和正常功能依赖晶状体上皮细胞数量、结构和功能的完整性[1]。研究证实,高浓度过氧化氢(hydrogen peroxide,H2O2)是导致晶状体上皮细胞凋亡的重要因素之一,氧化应激所产生的一系列产物使晶状体上皮细胞的通透性、蛋白构象发生改变,其生理功能也随之改变,从而导致晶状体混浊[2-3]。因此提高晶状体上皮细胞的抗氧化应激能力有助于预防和控制白内障。虾青素是叶黄素家族的一种,广泛存在于海洋动物、藻类及少数陆生植物体内[4]。研究证实,虾青素有强大的抗氧化能力,能有效清除氧自由基,抑制氧化应激损伤[5-6]。核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)与氧化应激密切相关,参与白内障形成[7],通过抑制Nrf2信号通路可预防糖尿病大鼠白内障进展[8]。有研究报道,虾青素对糖尿病性白内障模型大鼠晶状体氧化应激损伤有缓解作用,也能减少紫外线诱发的晶状体上皮细胞凋亡[9-10]。Li等[11]研究证实,虾青素能通过调控Nrf2/Kelch样环氧氯丙烷相关蛋白-1(Kelch-like epichlorohydrin-associated protein 1,Keap1)通路抵抗赭曲霉素A诱发的小鼠肾脏氧化应激损伤;闫孟利等[12]证实,虾青素能通过激活Nrf2通路从而抑制H2O2诱导的Hela细胞凋亡;Kubo等[13]报道虾青素刺激Nrf2通路防止氧化应激损伤,改善吸烟所致的小鼠肺气肿。以上研究提示虾青素能通过刺激Nrf2信号通路活性缓解多种细胞的氧化应激损伤,但虾青素对于晶状体上皮细胞氧化应激损伤的作用机制尚鲜有报道。基于此,本研究拟探索虾青素对H2O2诱导人晶状体上皮细胞氧化应激损伤的调控作用及其作用机制。
1 材料与方法
1.1 材料
1.1.1实验细胞 永生型人晶状体上皮细胞系(HLEB-3)购自中国科学院上海细胞库。
1.1.2主要试剂及仪器 膜联蛋白V/碘化丙啶(Annexin V FITC/PI)凋亡试剂盒(德国美天旎公司);兔抗人Nrf2一抗(710574)、兔抗人血红素加氧酶-1(heme oxygenase-1,HO-1)一抗(PA5-77833)、兔抗人醌氧化还原酶1[NAD (P) H,quinine oxidoreductase 1,NQO1]一抗(39-3700)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和H3抗体(美国Invitrogen公司);山羊抗兔IgG二抗(ab205719)、BCA蛋白定量检测试剂盒、DEME/F12培养基、胎牛血清(fetal bovine serum,FBS)(英国Abcam公司);一氧化氮(NO)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)检测试剂盒(上海碧云天生物技术有限公司)。CytoFLEX流式细胞仪(美国Beckman Coulter公司);Multiskan GO酶标仪(美国Thermo Fisher Scientific公司);DYCP-31DN电泳仪(北京六一生物科技有限公司);Tanon Fine Do X6全自动化学发光图像分析系统(上海天能科技有限公司)。
1.2 方法
1.2.1细胞培养 将冻存的HLEB-3细胞解冻、复苏,重悬于含体积分数10%FBS和青链霉素双抗的DMEM培养基中,于37 ℃、体积分数5%CO2培养箱中培养,待细胞融合达到80%左右时进行传代。
1.2.2噻唑蓝法检测不同浓度H2O2处理细胞的抑制率 取对数期HLEB-3细胞,按5×104个/ml接种于96孔板,待细胞贴壁后更换为含0、50、100、200、500、750 μmol/L H2O2的新鲜完全培养液,每个浓度设置6个复孔,继续培养24 h。每孔加入20 μl新配制的噻唑蓝(methyl thiazolyl tetrazolium,MTT)溶液(5 mg/mL),继续培养4 h,弃上清液,每孔加入150 μl Formazan溶解液,将96孔板置于酶标仪中,检测480 nm波长处的吸光度(absorbamce,A)值,取6个孔A值的平均值,计算不同浓度H2O2处理细胞的抑制率,细胞抑制率=(1-各浓度H2O2处理组A值)/0 μmol/L H2O2组A值×100%。Graphpad软件计算细胞的半数抑制浓度(50%inhibiting concentration,IC50)。
1.2.3MTT法检测不同浓度虾青素处理细胞的存活率 将对数期HLEB-3细胞接种于96孔板,分别加入0、5、10、20和50 μmol/L虾青素,继续培养24 h。参照1.2.2部分方法检测各组细胞的存活率,细胞存活率=各浓度虾青素组A值/0 μmol/L虾青素处理组A值×100%。
1.2.4细胞分组和处理 将细胞按5×104个/ml接种于96孔板中,分为正常对照组、氧化应激组、10 μmol/L虾青素组和20 μmol/L虾青素组。其中氧化应激组细胞培养于含250 μmol/L H2O2的完全培养基中,10 μmol/L虾青素组和20 μmol/L虾青素组在氧化应激组条件下分别添加终浓度为10 μmol/L和20 μmol/L的虾青素,正常对照组用完全培养基培养。培养24 h后进行后续实验。
1.2.5流式细胞仪检测各组细胞凋亡率 取各组细胞,胰蛋白酶消化,预冷磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤2次,离心半径3 cm 1 000 r/min离心10 min后重悬于200 μl Binding Buffer中,加入5 μl Annexin V-FITC混匀,冰浴条件下避光反应15 min,继续加入300 μl Binding Buffer,加入5 μl PI后1 h内流式细胞仪上样检测细胞凋亡率。左下象限为活细胞,左上象限为死亡细胞,右上象限为晚期凋亡细胞,右下象限为早期凋亡细胞。细胞凋亡率=早期凋亡率+晚期凋亡率。实验独立重复3次。
1.2.6ELISA法检测各组细胞氧化应激指标 (1)SOD活性检测 收集细胞,吸净培养液,PBS洗涤,加入SOD样品制备液,吹打裂解细胞,离心半径10 cm,12 000 r/min离心3 min,取上清作为待测样品。BCA试剂盒测定样品的蛋白浓度,使用试剂盒中提供的检测缓冲液稀释样品,参照试剂盒说明书配制酶工作液,设置样品孔(待测样品、酶工作液、反应启动工作液)、空白对照1孔(检测缓冲液、酶工作液、反应启动工作液)、空白对照2孔(检测缓冲液、酶工作液)和空白对照3孔(待测样品、检测缓冲液、酶工作液),各孔37 ℃孵育30 min,使用酶标仪在450 nm处测定A值。抑制百分率=[(A空白对照1-A空白对照2)-(A样品-A空白对照3)]/(A空白对照1-A空白对照2)×100%,待测样品中SOD酶活力单位=抑制百分率/(1-抑制百分率)。(2)MDA含量检测 取各组裂解细胞上清液,根据试剂盒说明书配制工作液,将待测样本或标准品与试剂混匀,以裂解液作为空白对照,95 ℃水浴40 min,流水冷却,离心半径3 cm,3 000 r/min离心10 min,取上清,采用酶标仪检测530 nm波长处A值。MDA含量=(样本A值-空白对照A值)/(标准品A值-空白对照A值)×标准品浓度×2/待测样本浓度。(3)NO浓度检测 取各组裂解细胞上清液,在96孔板加入标准品及样品,在各孔中加入置于室温的Griess Reagent Ⅰ和Griess Reagent Ⅱ,采用酶标仪测量540 nm波长处A值。NO浓度=(样品A值-标准品A值)/标准曲线斜率。(4)GSH活性检测 取各组裂解细胞上清液,按照说明书将试剂与待测样本混合均匀,离心半径3 cm,4 000 r/min离心10 min,每管取1 ml上清液,进行显色反应;另按照说明书要求配制试剂,并将试剂与待测样本混合均匀,室温孵育15 min,于酶标仪412 nm处检测A值,GSH活性=(A非酶管-A酶管)/(A标准管-A空白管)×标准管浓度×稀释倍数×样本稀释倍数。每个实验结果独立重复3次。
1.2.7Western bolt法检测细胞内Nrf2信号通路相关蛋白表达 收集各组细胞,加入RIPA裂解液,冰上裂解30 min,离心半径3 cm,3 000 r/min离心10 min,取上清液即为细胞质蛋白;收集沉淀,加入200 μl核蛋白提取剂,高速涡旋30 s,离心半径3 cm,3 000 r/min离心10 min,取上清液即为核蛋白。按照BCA蛋白定量试剂盒检测蛋白浓度。取细胞质蛋白进行SDS-PAGE凝胶电泳并转印至PVDF膜上,用质量分数0.5%的脱脂奶粉室温封闭1 h,TBST充分洗涤后分别加入Nrf2(1∶1 000)、HO-1(1∶500)、NQO1(1∶1 000)、GAPDH(1∶2 000)一抗,4 ℃孵育过夜;TBST漂洗3次,每次10 min,加入相应二抗(1∶5 000),室温下孵育1 h;TBST漂洗3次,每次10 min,化学发光试剂(electrochemiluminescence,ECL)显色,采用Image J软件分析蛋白灰度。取核蛋白,加入Nrf2(1∶1 000)、H3(1∶2 000)一抗,检测Nrf2蛋白表达,步骤同上。细胞质蛋白以GAPDH为内参,细胞核蛋白以H3为内参,计算各目的蛋白相对表达量。每组实验独立重复3次。
1.2.8细胞转染和分组 取对数期HLEB-3细胞按1×106个/ml接种于6孔板内,分别将5 μg Nrf2-小干扰RNA(small interfering RNA,siRNA)(序列为5'-GCTTAGGCTTAGGCTTAGGC-3')或正常对照-siRNA(normal control-siRNA,NC-siRNA)(上海吉玛制药技术有限公司合成)加入6 μl Tuebofect和200 μl不含FBS的DMEM混合液中,混合均匀后加入6孔板内,于细胞培养箱中培养24 h。将转染后细胞分为NC-siRNA组、Nrf2-siRNA组、NC-siRNA+虾青素组、Nrf2-siRNA+虾青素组,其中NC-siRNA组和Nrf2-siRNA组培养于含终浓度250 μmol/L H2O2的培养基中,NC-siRNA+虾青素组和Nrf2-siRNA+虾青素组细胞分别培养于含终浓度10 μmol/L虾青素和250 μmol/L H2O2的培养基。培养24 h后采用流式细胞仪检测细胞凋亡率,采用相应试剂盒检测细胞中NO浓度、SOD及GSH活性和MDA含量。每组实验独立重复3次。
1.3 统计学方法

2 结果
2.1 不同浓度H2O2处理HLEB-3细胞抑制率比较
0、50、100、200、500、750 μmol/L H2O2对HLEB-3细胞的抑制率分别为(0.00±0.00)%、(10.38±2.01)%、(18.53±2.25)%、(39.18±3.49)%、(64.59±5.42)%、(87.94±7.43)%,随着H2O2浓度的增加,细胞抑制率随之增加,不同浓度H2O2对细胞抑制率总体比较差异有统计学意义(F=12.358,P<0.05)。H2O2对HLEB-3细胞的IC50为264.2 μmol/L(图1)。
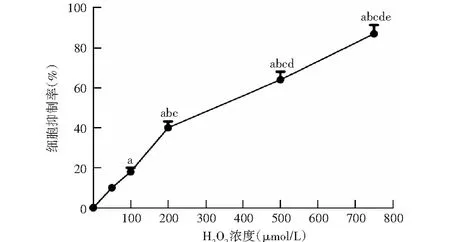
图1 不同浓度H2O2处理HLEB-3细胞抑制率比较 F=12.358,P<0.05.与0 μmol/L H2O2比较,aP<0.05;与50 μmol/L H2O2比较,bP<0.05;与100 μmol/L H2O2比较,cP<0.05;与200 μmol/L H2O2比较,dP<0.05;与500 μmol/L H2O2比较,eP<0.05(单因素方差分析,LSD-t检验,n=6)
2.2 不同浓度虾青素处理HLEB-3细胞存活率比较
0、5、10、20、50 μmol/L虾青素处理HLEB-3细胞后存活率分别为(100.00±0.00)%,(102.20±1.34)%、(109.50±3.60)%、(115.40±4.13)%、(93.60±2.59)%,提示5~20 μmol/L范围内虾青素对HLEB-3细胞无毒性作用,而50 μmol/L虾青素对HLEB-3细胞有明显毒性,后续选取10 μmol/L和20 μmol/L虾青素作为实验剂量。
2.3 各组细胞凋亡率比较
正常对照组、氧化应激组、10 μmol/L虾青素组和20 μmol/L虾青素组细胞凋亡率分别为(9.20±0.24)%、(38.50±2.38)%、(27.60±4.33)%和(14.90±1.23)%,各组间总体比较差异有统计学意义(F=18.344,P<0.001),两两比较差异均有统计学意义(均P<0.05)(图2)。
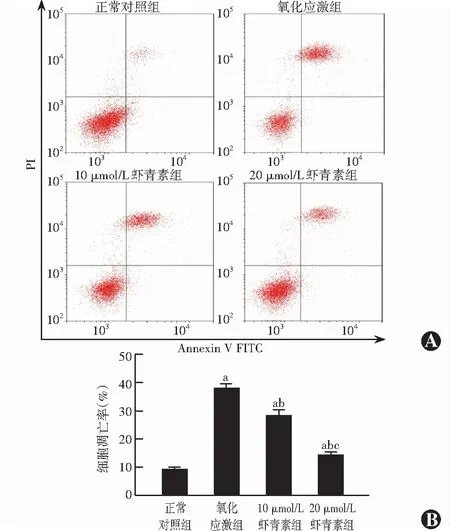
图2 流式细胞仪检测各组细胞凋亡率 A:各组细胞凋亡流式细胞图 氧化应激组细胞凋亡率明显高于其他3个组 B:各组细胞凋亡率比较 F=18.344,P<0.001.与正常对照组比较,aP<0.05;与氧化应激组比较,bP<0.05;与10 μmol/L虾青素组比较,cP<0.05(单因素方差分析,LSD-t检验,n=3)

表1 各组细胞中NO、MDA、SOD、GSH水平比较(x±s)Table 1 Comparison of NO,MDA,SOD and GSH contents among different groups (x±s)组别样本量NO(μmol/L)MDA(nmol/L)GSH(U/g)SOD(U/mg)正常对照组32.01±0.091.42±0.026.48±0.2518.52±2.05氧化应激组36.32±0.25a5.68±0.26a2.33±0.08a5.63±1.67a10 μmol/L虾青素组34.28±0.11ab3.82±0.13ab3.96±0.06ab10.33±1.51ab20 μmol/L虾青素组32.81±0.04abc2.11±0.02abc5.45±0.03abc15.85±2.02abcF值17.02429.52033.35424.052P值<0.001<0.001<0.001<0.001 注:与正常对照组比较,aP<0.05;与氧化应激组比较,bP<0.05;与10 μmol/L虾青素组比较,cP<0.05(单因素方差分析,LSD-t检验) NO:一氧化氮;MDA:丙二醛;GSH:谷胱甘肽过氧化物酶;SOD:超氧化物歧化酶 Note:Compared withnormal control group,aP<0.05;compared with oxidative stress group;bP<0.05,com-pared with 10 μmol/L astaxanthin group;cP<0.05 (One-way ANOVA,LSD-t test) NO:nitric oxide;MDA:malondialdehyde;GSH:glutathione peroxidase;SOD:superoxide dismutase
2.4 各组细胞氧化应激指标比较
各组NO浓度、MDA含量、GSH和SOD活性总体比较差异均有统计学意义(F=17.024、29.520、33.354、24.052,均P<0.001)。氧化应激组细胞中NO浓度、MDA含量较正常对照组、10 μmol/L虾青素组和20 μmol/L虾青素组升高,SOD、GSH活性较正常对照组、10 μmol/L虾青素组和20 μmol/L虾青素组降低,差异均有统计学意义(均P<0.05);10 μmol/L虾青素组中NO浓度、MDA含量高于20 μmol/L虾青素组和正常对照组,GSH、SOD活性低于20 μmol/L虾青素组和正常对照组,差异均有统计学意义(均P<0.05)(表1)。
2.5 各组细胞Nrf2信号通路相关蛋白表达比较
正常对照组、氧化应激组、10 μmol/L虾青素组和20 μmol/L虾青素组细胞质Nrf2蛋白条带灰度逐渐减弱,细胞核Nrf2和细胞质中HO-1及NQO1蛋白条带灰度逐渐增强(图3)。各组间细胞核Nrf2、细胞质Nrf2、HO-1和NQO1蛋白相对表达量总体比较,差异均有统计学意义(F=43.512、20.381、31.014、23.435,均P<0.001);各组间各蛋白相对表达量两两比较差异均有统计学意义(均P<0.05)(表2)。
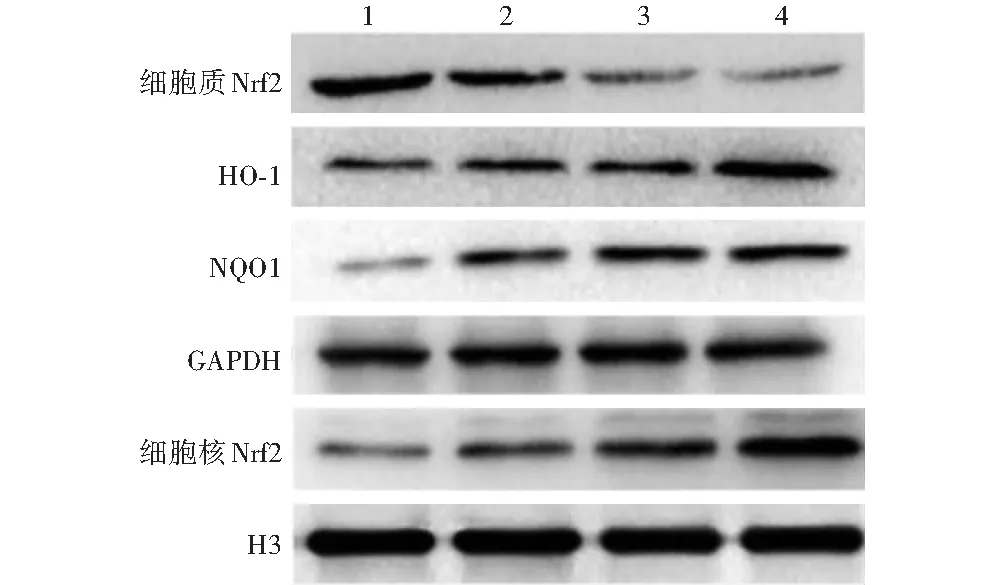
图3 各组HLEB-3细胞中细胞核Nrf2及细胞质Nrf2、HO-1和NQO1蛋白表达电泳图 正常对照组细胞质Nrf2蛋白条带灰度强于其他组,细胞核Nrf2、HO-1和NQO1蛋白条带灰度弱于其他组 1:正常对照组;2:氧化应激组;3:10 μmol/L虾青素组;4:20 μmol/L虾青素组 Nrf2:核因子E2相关因子2;HO-1:血红素加氧酶-1;NQO1:醌氧化还原酶

表2 各组HLEB-3细胞中Nrf2信号通路相关蛋白相对表达量比较(x±s)Table 2 Comparison of expression levels of Nrf2 signaling pathway-related proteins in HLEB-3 cells among different groups (x±s)组别样本量细胞质Nrf2细胞核Nrf2HO-1NQO1正常对照组31.03±0.170.23±0.080.48±0.060.11±0.02氧化应激组30.83±0.10a0.42±0.08a0.59±0.04a0.52±0.05a10 μmol/L虾青素组30.46±0.04ab0.60±0.10ab0.71±0.11ab0.82±0.10ab20 μmol/L虾青素组30.33±0.06abc0.88±0.12abc0.92±0.12abc1.03±0.13abcF值20.38143.51231.01423.435P值<0.001<0.001<0.001<0.001 注:与正常对照组比较,aP<0.05;与氧化应激组比较,bP<0.05;与10 μmol/L虾青素组比较,cP<0.05(单因素方差分析,LSD-t检验) Nrf2:核因子E2相关因子2;HO-1:血红素加氧酶-1;NQO1:醌氧化还原酶 Note:Compared with normal control group,aP<0.05;compared with oxidative stress group,bP<0.05;compared with 10 μmol/L astaxanthin group,cP<0.05 (One-way ANO-VA,LSD-ttest) Nrf2:nuclear factor E2 related factor 2;HO-1:heme oxygenase-1;NQO1:NAD (P) H,quinine oxidoreductase 1
2.6 各转染组细胞凋亡率比较
NC-siRNA组、Nrf2-siRNA组、NC-siRNA+虾青素组、Nrf2-siRNA+虾青素组细胞凋亡率分别为(37.50±2.31)%、(48.30±3.25)%、(25.60±1.38)%和(52.30±4.11)%,总体比较差异有统计学意义(F=12.946,P<0.001),其中Nrf2-siRNA组和Nrf2-siRNA+虾青素组细胞凋亡率高于NC-siRNA组和NC-siRNA+虾青素组,NC-siRNA组细胞凋亡率高于NC-siRNA+虾青素组,差异均有统计学意义(均P<0.05);Nrf2-siRNA+虾青素组与Nrf2-siRNA组细胞凋亡率差异无统计学意义(P>0.05)(图4)。
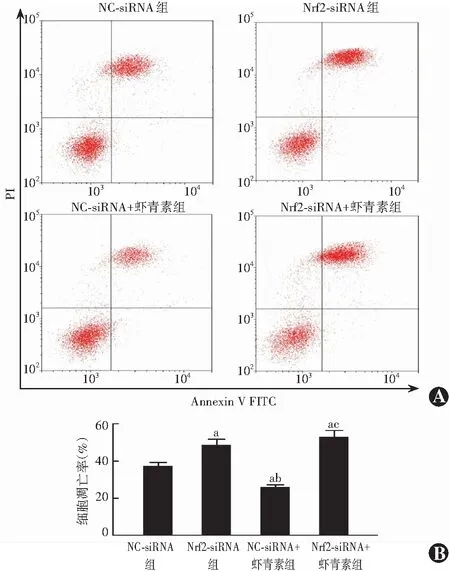
图4 流式细胞仪检测各转染组细胞凋亡率 A:各组细胞凋亡流式细胞图 Nrf2-siRNA组和Nrf2-siRNA+虾青素组细胞凋亡率高于其他组 B:各组细胞凋亡率比较 F=12.946,P<0.001. 与NC-siRNA组比较,aP<0.05;与Nrf2-siRNA组比较,bP<0.05;与NC-siRNA+虾青素组比较,cP<0.05(单因素方差分析,LSD-t检验,n=3)
2.7 各转染组细胞氧化应激反应指标比较
各组NO浓度、MDA含量、GSH和SOD活性总体比较差异均有统计学意义(F=5.021、10.341、9.367、16.588,均P<0.001),其中Nrf2-siRNA组细胞NO浓度、MDA含量高于NC-siRNA组,SOD、GSH活性低于NC-siRNA组,差异均有统计学意义(均P<0.05);NC-siRNA+虾青素组NO浓度、MDA含量低于NC-siRNA组和Nrf2-siRNA+虾青素组,SOD、GSH活性高于NC-siRNA组和Nrf2-siRNA+虾青素组,差异均有统计学意义(均P<0.05);Nrf2-siRNA+虾青素组与Nrf2-siRNA组细胞NO浓度、SOD和GSH活性及MDA含量比较差异均无统计学意义(均P>0.05)(表3)。
3 讨论
生理条件下,人晶状体内存在一定数量的自由基,同时也存在过氧化氢酶、SOD、GSH等一系列活性氧组成的抗氧化体系,使晶状体内活性氧自由基的产生和清除保持动态平衡。在外界诱因刺激下,晶状体内自由基生成增多,抗氧化体系受到抑制,可引发晶状体上皮细胞发生氧化应激损伤,诱发白内障[14-15]。白内障患者房水中H2O2浓度升高是介导早期晶状体氧化应激损伤的主要因素之一[16]。虾青素作为类胡萝卜素的一类强抗氧化剂,已被证实对白内障动物模型和晶状体上皮细胞有调控作用。Yang等[17]研究证实,虾青素能通过降低氧化损伤而延缓1型糖尿病大鼠代谢性白内障的发生和发展;Ishikawa等[18]证实,在糖皮质激素诱导的鸡胚胎代谢性白内障中,虾青素能阻止GSH的氧化,维持还原电位。本研究结果显示,H2O2能诱导HLEB-3细胞NO浓度、MDA含量升高,而抑制SOD、GSH等抗氧化酶的活性,使细胞发生氧化损伤,继而诱发凋亡和抑制生长,而虾青素能逆转H2O2诱导的氧化损伤,抑制细胞凋亡。

表3 氧化应激条件下各组HLEB-3细胞中NO、MDA、SOD、GSH水平比较(x±s)Table 3 Comparison of NO,MDA,SOD,GSH contents in HLEB-3 cells among various groups under different oxidative stress conditions (x±s)组别样本量NO(μmol/L)MDA(nmol/L)GSH(U/g)SOD(U/mg)NC-siRNA组36.49±0.216.01±0.152.18±0.115.44±0.85Nrf2-siRNA组38.56±0.38a7.91±0.22a1.02±0.03a3.04±0.52aNC-siRNA+虾青素组34.33±0.11ab4.03±0.26ab3.88±0.14ab11.21±1.34abNrf2-siRNA+虾青素组38.81±0.24ac7.52±0.16ac1.25±0.06ac3.12±0.11acF值5.02110.3419.36716.588P值<0.001<0.001<0.001<0.001 注:与NC-siRNA组比较,aP<0.05;与Nrf2-siRNA组比较,bP<0.05;与NC-siRNA+虾青素组比较,cP<0.05(单因素方差分析,LSD-t检验) Nrf2:核因子E2相关因子2;SOD:超氧化物歧化酶;GSH:谷胱甘肽过氧化物酶;MDA:丙二醛 Note:Compared with NC-siRNA group,aP<0.05;compared with Nrf2-siRNA group,bP<0.05;compared with NC-siRNA+astaxanthin group,cP<0.05 (One-way ANOVA,LSD-t test) Nrf2:nuclear factor E2 related factor 2;SOD:superoxide dismutase;GSH:glutathione peroxidase;MDA:ma-londialdehyde
Nrf2广泛表达于机体的各个组织,是重要的氧化还原敏感性转录因子,对缓解氧化应激损伤有重要作用。生理状态下,Nrf2被胞浆蛋白Keap1 Kelch样环氧氯丙烷相关蛋白-1锚定,以非活性的复合物形式存在于细胞质中;氧化应激状态下,Nrf2被激活,与Keap1解离,转位进入细胞核内,与DNA上一段特异序列抗氧化反应原件结合,介导其下游Ⅱ相解毒酶和抗氧化酶基因的转录活性,如HO-1、NQO1,增强细胞清除活性氧自由基的能力,降低氧化应激对细胞、组织的损伤[19]。朱丽华等[20]研究证实,Nrf2在人晶状体上皮细胞中的表达及核易位能增加抗氧化酶和抗凋亡蛋白的含量,降低促凋亡蛋白的含量,从而起到抗氧化损伤和抗凋亡的作用。本研究发现,在外源性H2O2的刺激下,HLEB-3细胞中Nrf2发生明显的核转移,且下游HO-1、NQO1蛋白表达增加;同时,沉默Nrf2基因后,HLEB-3细胞的NO浓度和MDA含量上调,而抗氧化酶SOD和GSH活性下调,细胞凋亡率升高。这一结果提示氧化应激状态下Nrf2在HLEB-3细胞内发生核转移并活化。在H2O2诱发的氧化应激环境下,虾青素能刺激HLEB-3细胞发生Nrf2的核转移,继而激发HO-1、NQO1基因转录,而沉默Nrf2的表达后,可逆转虾青素对HLEB-3细胞的这些作用,提示虾青素对H2O2诱发HLEB-3细胞氧化应激引发的细胞凋亡的调控作用可能是通过激活Nrf2通路实现的。
综上所述,本研究证实虾青素能提高晶状体上皮细胞抗H2O2诱导的氧化应激损伤能力,这一作用可能是通过活化Nrf2相关信号通路实现的。本研究参照以往文献并通过预实验仅选取了2个不同剂量虾青素进行了研究,未验证更多不同剂量的效果,且尚未进行在体动物实验验证,未来仍需纳入更多虾青素剂量及开展在体动物实验进一步探索。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明李勇:实验设计及操作、论文撰写;刘钊臣:统计分析、研究指导及论文修改;彭华琮:数据整理和分析

