烟草镰刀菌根腐病抗性鉴定方法研究
李雪君 郭敬 孙计平 孙焕 李芳芳 平文丽 李建华 俎焕新 李旭辉 侯咏 耿胜娜

摘 要:为获得不同烟草品种镰刀菌根腐病抗性的鉴定方法,采用镰刀菌粗毒素幼芽接种、孢子悬浮液培养、带菌菌谷接种、离体叶片菌饼接种、草酸局部注射等5种方法对4个品种(小黄金1025、中烟100、长脖黄、664-01)的镰刀菌抗病性进行了研究。结果表明,镰刀菌毒素液胁迫法可以鉴定品种的抗感程度,适宜体系毒素浓度为8%,处理时间6 d;镰刀菌孢子悬浮液接种法可以鉴定品种的抗感程度,适宜体系孢子液浓度为107个/mL,处理时间4 d;带菌菌谷接种也可以鉴定品种的抗感程度,适宜体系菌谷比例为20%,处理时间9 d;离体叶片用菌饼和草酸液处理,能区分品种的抗感性,但不能区分品种的抗感程度。研究结果认为孢子悬浮液接种法和带菌菌谷接种与其他3种方法相比可以准确评价品种对镰刀菌根腐病的抗感性。
关键词:烟草;镰刀菌根腐病;毒素;孢子液;菌饼;抗病性
中图分类号:S435.72 文献标识码:A 文章编号:1007-5119(2023)02-0043-09
Abstract: To obtain suitable identifying methods of tobacco root rot resistance in different tobacco varieties(Xiaohuangjin1025, Zhongyan100, Changbohuang, 664-01), the inoculation crude toxin of tobacco seedlings, spore suspension culture, inoculation of grain culture with fungi, inoculation mycelial cake of detached leaf and local injection of oxalic acid were investigated. The results showed that crude toxin stress could identify the resistance degree of tobacco varieties, and the suitable system was treated within 6 d at 8% toxin concentration. The inoculation spore suspension could identify the degree of resistance of different varieties and the suitable system was treated within 4 d and with 107 spores per mL. The inoculation of grain culture with fungi could also identify the degree of resistance of tobacco varieties, and the suitable system was treated within 9 d at the toxin concentration of 20% pathogenic fungus grain culture. The treatment of detached leaf with mycelial cake oxalic acid could distinguish the resistance of varieties, but could not differentiate the degree of resistance. The results showed that the spore suspension inoculation method and the fungal wheat culture inoculation method could accurately evaluate the resistance of varieties to Fusarium root rot compared with the other three methods.
Keywords: tobacco; Fusarium root rot; toxin; spore liquid; mycelial cake; disease resistance
煙草是我国重要的经济作物,播种面积在200万hm2以上[1]。烟草病害对烟叶产量和质量都会产生严重影响[2-3]。近年来,随着烟叶生产耕作模式的变化,大片连方种植使轮作倒茬十分困难,导致根茎类病害逐年加重[4-5],其中烟草镰刀菌(Fusarium)根腐病[2,6-7]发展极为迅速,在河南[6,8]、山东[9]、福建[10]、安徽[11]等地均有发生,特别是在黄淮烟区,镰刀菌根腐病已经上升为主要病害,重茬烟田发病率高达30%[12-13],严重地块甚至绝收。引起镰刀菌根腐病的菌源有多种,如尖孢镰刀菌(F. oxysporum)、茄病镰刀菌(F. solani)、木贼镰刀菌(F. equiseti)、层出镰刀菌(F. proliferatum)等[14],不同地方报道的主要病原菌有所差异,河南[14]、湖北[15]、云南[16]烟区的主要致病菌均为尖孢镰刀菌,在河南烟区该致病菌占81.25%[14]。由于真菌对杀菌剂抗性的不断增强和环境因子的影响[17-18],化学防治、生物防治收效甚微,选育和应用抗病品种是控制烟草镰刀菌根腐病的首选措施。在抗病品种的培育过程中,镰刀菌根腐抗病种质、后代材料的筛选需要准确有效的抗性鉴定方法。
目前,对品种镰刀菌根腐病抗性的鉴定方法主要有菌谷接种法、孢子悬浮液蘸根法、毒素法[19-20]等,但是尚未有鉴定方法的系统比较,缺乏全国统一标准,也没有明确的抗病感病对照。不同鉴定方法采取不同的抗感对照[11,15,19],很难确定材料的真实抗性水平。从统一抗感对照入手,比较不同的接种鉴定方法,对育种材料的筛选和鉴定有着非常重要的意义。
本文以优势菌种尖孢镰刀菌为研究菌种,利用5种接种方法对尖孢镰刀菌接种鉴定并进行对比,对4个初步筛选的抗感材料进行接种鉴定,旨在探索出一套快速、简便鉴定镰刀菌根腐病抗性的方法,为镰刀菌根腐病抗性烟草品种的选育及抗感对照的选取提供参考。
1 材料与方法
1.1 试验材料
供试烟草品种包括中烟100、长脖黄、小黄金1025、664-01,均由河南省农业科学院烟草所种质资源库提供。
1.2 病原菌的分离与鉴定
1.2.1 病原菌的分离 根据组织分离法,选取有镰刀菌根腐症状的病株,剪取烟苗根部病健交接处3 mm左右的组织块,使用70%酒精消毒30 s,3% NaClO溶液消毒30 s,无菌水冲洗3次,按压在含青霉素和硫酸链霉素的PDA平板上,在25 ℃光照培养箱中培养。
1.2.2 形态学鉴定 观察菌落形态及色素产生情况,并使用光学显微镜观察孢子形态。
1.2.3 分子生物学鉴定 采用CTAB法提取镰刀菌基因组DNA,使用真菌ITS-rDNA通用引物ITS1/ITS4:5'-TCCGTAGGTGAACCTGCGG-3',5'-TCCTCCGCTTATTGATATGC-3'进行PCR扩增,扩增产物送往上海生工生物工程有限公司测序,测序结果登陆NCBI进行BLAST比对分析,选择匹配值前100序列中的不同菌株序列作为参考序列。多序列比对使用Clustal W,采用默认值,基于泊松模型、均匀模式、成对缺失的邻接法(Neighbor-Joining)和1000次botstrap重复,利用MEGA X软件构建系统发育树,小于50的引导值被隐藏。
1.2.4 致病性测定 参考邱睿等[19]的方法,将带菌麦粒培养物接种到小黄金1025,于接种后10、20 d观察植株发病情况。接种10 d后按照1.2.1的方法分离病原菌,并按照1.2.2和1.2.3的方法进行形态学鉴定和分子生物学鉴定,鉴定结果一致则说明该病原菌为致病菌。
1.3 接种病原菌的制备
1.3.1 镰刀菌粗毒素的制备 尖孢镰刀菌在PDA平板上培养7 d后,在菌落边缘打取直径6 mm的菌饼,在装液量100/250 mL的PD培养液接种2块,28 ℃、180 r/min摇培3 d后,使用8层纱布过滤,6500 r/min离心20 min,保留上清液作为毒素原液,置于4 ℃冰箱备用。
1.3.2 孢子悬浮液的制备 尖孢镰刀菌培养液的制备同1.3.1,培养液经8层纱布过滤后,使用血球计数板调节孢子浓度分别为1×105、1×106、1×107个/mL。
1.3.3 带菌麦粒培养物的制备 参照邱睿等[19]的方法,在活化7 d的尖孢镰刀菌平板上打取直径6 mm的菌饼,挑取2块接入装有含1/3煮熟麦粒培养基的培养瓶中,25 ℃光照培养7 d,每12 h摇晃培养瓶保证菌丝均匀生长。
1.4 烟草品种抗性鉴定
1.4.1 萌发期毒素胁迫培养 烟草种子经70%酒精消毒30 s,1% NaClO溶液消毒30 s,无菌水冲洗5次后,在温度28 ℃光周期为8 h/d的光照培养箱中萌发3 d至露白。在铺有无菌滤纸的培养皿中分别加入5 mL 4%、8%、12%、16%、20%的毒素液,对照加入5 mL无菌水,每皿放入20粒正常露白种子,每个处理重复3次,在28 ℃、光周期为8 h/d条件培养3~5 d后,测定种子死亡率及存活种子根长抑制率。
种子死亡率=(3次毒素处理死亡平均值/每皿点种总数)×100%
根长抑制率=(对照品种根长-毒素处理品种根长)/对照品种根长×100%
1.4.2 镰刀菌孢子悬浮液接种鉴定 挑选长势一致的5叶期烟苗,分别在装入45 mL左右(以不没过烟苗茎部为宜)105、106、107个/mL孢子悬浮液的50 mL离心管中培养,每个处理重复3次,每个重复处理10株烟苗,置于28 ℃、光周期8 h/d的培养箱中,培养3 d后根据GB/T 23222—2008《烟草病虫害分级及调查方法》调查发病情况,计算病情指数。
1.4.3 带菌麦粒接种鉴定 带菌麦粒培养物与无菌基质按10%、20%的比例混合,选取长至4~5片真叶的苗栽种到混合基质中,每个处理10株烟苗,将等比例未接菌的麦粒培养基與无菌基质混合作为对照,试验重复3次,光周期为8 h/d条件下培养9 d,观察并统计发病情况。
1.4.4 离体叶片接种镰刀菌 挑选大小均匀的叶片,使用无菌注射器针头在叶片上制造伤口,将尖孢镰刀菌菌饼按压在伤口上,用湿润的无菌脱脂棉包裹住叶柄,在28 ℃光周期为8/16 h的培养箱中培养9 d后,观察叶片是否出现病斑。
1.4.5 草酸处理模拟镰刀菌试验 参考刘胜毅等[21]的草酸浸叶法适当调整,使用40 mmol/L浓度的草酸溶液注射叶片,注射6 d后观察并统计叶片坏死的结果。
1.5 烟草品种抗性评价
病情调查与抗性评价参考黑胫病分级标准按照GB/T 23222—2008规定的标准进行。以株为单位分级调查。根据调查结果计算并统计烟株病情指数。病情指数=∑(各级病株数×该病级值)/(调查总株数×最高病级值)×100。按照GB/T 23224—2008的规定进行抗性标准评价。高抗或免疫(I),病情指数为0;抗病(R),病情指数为0.1~20.0;中抗(MR),病情指数为20.1~40.0;中感(MS),病情指数为40.1~60.0;感病(S),病情指数为60.1~80.0;高感(HS),病情指数为80.1~100.0。
1.6 数据分析
利用Excel 2007软件对试验数据进行处理,采用DPS软件对不同鉴定方法之间的相关数据进行分析。
2 结 果
2.1 镰刀菌种类鉴定
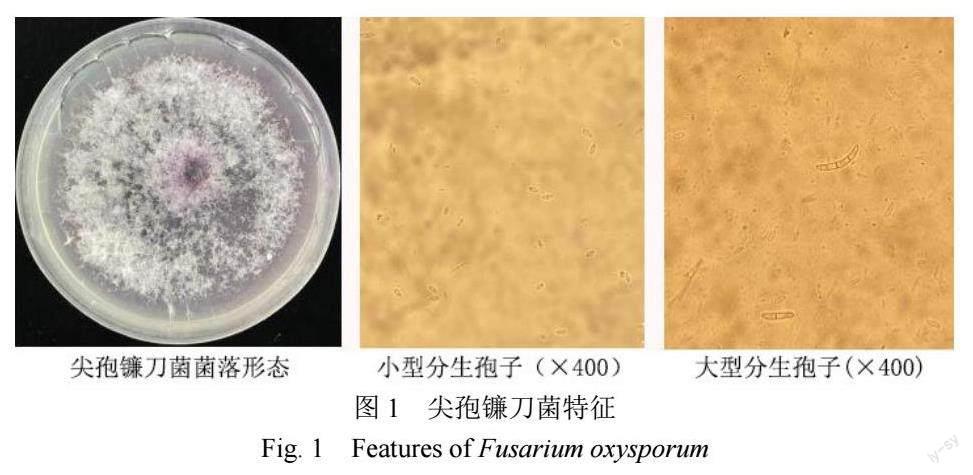
2.1.1 形态学鉴定 菌落在PDA培养基上呈淡紫色(图1),小型分生孢子椭圆形,单孢或偶有1~2个隔膜,大型分生孢子镰刀状,3~5个隔膜。
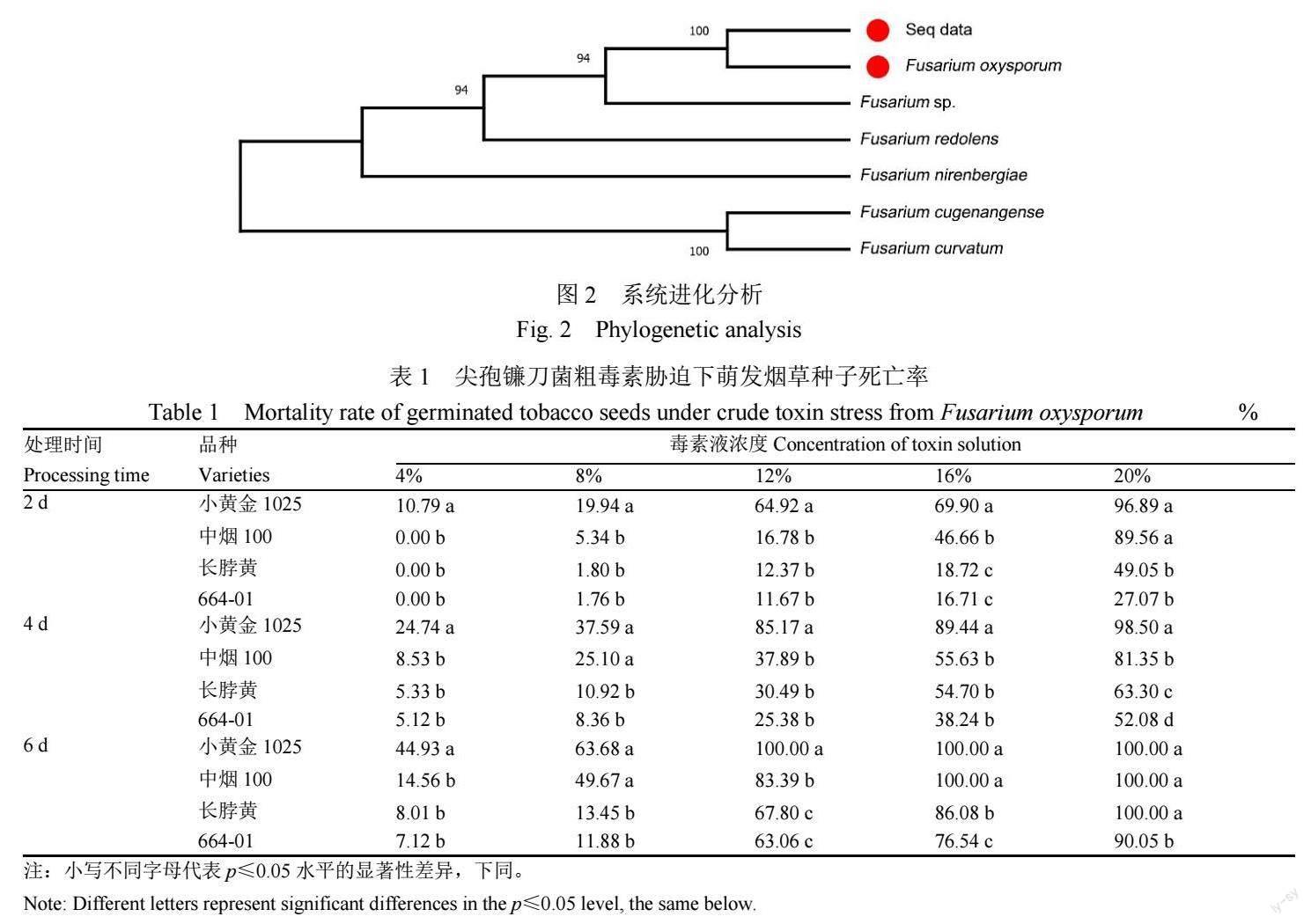
2.1.2 分子生物学鉴定 用真菌ITS-rDNA通用引物ITS1/ITS4进行PCR扩增后得到的DNA片段大小约为550 bp。由生物公司进行测序,测序结果(Seq data)经NCBI网站BLAST分析比对,利用MEGA-X软件构建多基因系统发育树,结果表明,Seq data与尖孢镰刀菌Fusarium oxysporum在同一发育分支,且序列相似性高达100%(图2),因此确定此菌种为镰刀菌属尖孢镰刀菌。
2.1.3 致病性测定 小黄金1025接种尖孢镰刀菌10 d后,与对照相比长势明显变弱,根部变黄发黑,须根变少,叶片由下至上变黄、枯萎;接种20 d后,烟株枯死(图3)。对病原菌分离纯化后,使用电子显微镜观察孢子形态,符合图1中尖孢镰刀菌特征;送上海生工生物工程有限公司测序后比对结果与2.1.2相符,说明供试菌株具有致病性。
2.2 烟草品种抗性鉴定
2.2.1 镰刀菌毒素液胁迫 对萌发烟草种子采用不同浓度尖孢镰刀菌毒素处理发现(表1、图4),4种供试烟草品种对镰刀菌根腐病的抗性有明显差异,随着毒素处理浓度的提高,4个品种表现出相应程度的发病现象,烟草幼芽主根变黄变黑,叶片萎蔫变黄,死亡率随之升高。
4%毒素接种后2 d,除小黄金1025发病外,其余3个品种均未发病;接种至6 d时,小黄金1025死亡率为44.93%,中烟100死亡率为14.56%,长脖黄和664-01死亡率为8.01%和7.12%,抗感材料死亡率差异不明显。初步认为4%毒素处理用于抗性鉴定不是最佳选择。毒素处理6 d后,12%、16%、20%的3个处理种子死亡率均≥60%,抗感材料因毒素浓度过大而死亡率过高,故12%、16%、20%也不适用于抗性鉴定。
8%尖孢镰刀菌毒素胁迫6 d后,小黄金1025和中烟100幼芽死亡率分别为63.68%和49.67%,容易感病;长脖黄和664-01,死亡率分别为13.45%和11.88%,抗性较好,因此认为烟草品种受8%毒素处理后的抗病感病程度有显著差异,比较适合镰刀菌抗性鉴定。对发病较轻的长脖黄和664-01的胚根长度进行测量后发现(图5),使用8%尖孢镰刀菌毒素胁迫处理长脖黄,种子萌发后胚根生长受到明显抑制,抑制率为62.89%;664-01根长抑制率為18.96%,胚根生长受毒素影响较小。
2.2.2 镰刀菌孢子悬浮液接种鉴定 尖孢镰刀菌孢子悬浮液处理烟苗发现,供试品种对尖孢镰刀菌的抗性有明显差异(表2、图6)。而且随着孢子悬浮液浓度的提高,烟苗发病程度越来越高,表现为叶片萎蔫、枯萎,根部变黄、变褐、腐烂等。
用浓度为105、106个/mL尖孢镰刀菌孢子悬浮液处理烟苗4 d后,抗感品种的病情指数均<60,不适合抗性鉴定。浓度为1×107个/mL的孢子悬浮液处理3 d后,烟苗发病程度差异显著。小黄金1025和中烟100感尖孢镰刀菌,病情指数分别为62.96、66.67,长脖黄对尖孢镰刀菌中抗,664-01表现为抗病。
2.2.3 带菌菌谷接种鉴定 对4个品种进行带菌麦粒接种,分别设置10%、20%两个比例。在10%浓度处理下,与对照相比,4个品种均无明显发病情况(表3、图7);在20%浓度处理下,小黄金1025和中烟100根部出现腐烂(图8),依据GB/T 23224—2008 《烟草品种抗病性鉴定》标准,烟草品种的抗性测定结果表明,小黄金1025、中烟100表现感病;长脖黄表现为中抗;664-01表现为抗(表3、图7)。
2.2.4 离体叶片镰刀菌菌饼接种 如图9所示,在烟草离体叶片接种尖孢镰刀菌菌饼9 d后,因为有菌饼的覆盖,所有材料均有淡黄色枯斑,小黄金1025枯斑出现明显扩散,中烟100病斑也有扩散痕迹,长脖黄和664-01没有病斑扩散。说明长脖黄和664-01对该病菌有抵抗性,小黄金1025和中烟100对尖孢镰刀菌易感。
2.2.5 离体叶片草酸注射 通过向叶片注射40 mmol/L的草酸,根据病斑大小(图10)可以得出,小黄金1025叶片坏死最严重,其次是中烟100,可以初步认为是感病品种;长脖黄的叶片受损坏死最少,664-01次之,表现出较好的抗性。初步认为利用草酸模拟,可以从一定程度上区分不同品种对镰刀菌的抗感性。
2.2.6 尖孢镰刀菌5种接种方法比较 从表4可以看出,第1种处理方法毒素胁迫所需时间最短,省去了培养苗的时间,一共16 d,其余几种方法都是用5叶期的幼苗,培养苗的时间一致,试验处理所需时间差异不大,但培养苗的时间是毒素胁迫的4倍,明显长于第1种方法。
从处理后抗性鉴定的效果上来看,以上5种方法均能区分出品种的抗、感性,前3种方法能区分出抗感程度,后2种方法不能区分出抗感程度。前3种处理方法较复杂,后2种处理方法直接处理离体叶片,处理方法比较简单,尤其是最后一种,省去了病菌的培养,处理最为简单。
3 讨 论
烟草品系的抗性鉴定与评价是抗病育种最为关键的一环。接种体系简单高效、接种结果稳定可靠对烟草抗病材料的鉴定与筛选非常重要。
本研究对镰刀菌毒素胁迫和孢子悬浮液接种鉴定这两种方法进行了不同浓度和处理时间的研究。镰刀菌毒素胁迫试验中,同一品种经不同浓度尖孢镰刀菌毒素液处理后受损程度不同,随毒素浓度提高,受损加重;不同品种对相同浓度毒素液敏感程度也不同,这与赵杰等[21]的研究结果一致,初步说明用镰刀菌毒素进行抗性鉴定的方法是可行的。从发病情况来看,采用8%的浓度处理6 d能区分出供试抗感品种。从种子胚根生长状态看,2个抗病品种的抗病机理不相同,在同样发病较轻的情况下,长脖黄胚根受毒素抑制较大,664-01胚根受抑制比较小,几乎不影响其生长。因此,这2个抗性材料的抗病机理上应该存在一定差异,有待进一步研究。
孢子悬浮液接种试验中,1×105、1×106个/mL尖孢镰刀菌孢子悬浮液处理烟苗不能明显区分抗感品种,1×107个/mL孢子悬浮液处理3 d后可以显著区分,小黄金1025和中烟100为感病品种,长脖黄和664-01为抗病品种,这与刘利佳[20]通过大型分生孢子接种的结果一致。批量制备孢子悬浮液过程同大型分生孢子相比,耗时短并且操作简单,在生产上高效便捷。
本研究接种菌谷的鉴定结果与邱睿等[19]的报道不完全一致,小黄金1025为感病品种,这个基本一致;中烟100本研究鉴定结果为感病,文献[19]中为中抗,根据图片来看,推测原因可能是接种时期和接菌量不一致导致的,邱睿等的研究中接种时苗龄较大,接菌量比较小,所以发病程度偏轻。
离体叶片接种法在烟草黑胫病和青枯病鉴定方面已有报道[22-23],还未见于镰刀菌根腐病的研究中。本研究通过离体叶片接种菌饼发现,长脖黄和664-01对尖孢镰刀菌具有抗性,小黄金1025和中烟100表现为易感。
核盘菌、灰霉菌属于子囊菌门,都可以分泌草酸,在致病过程中起到重要作用,寄主抗草酸能力越强,抗病能力也越高[24-25]。尖孢镰刀菌有性态时期也属于子囊菌门,但是草酸对镰刀菌的致病机理还鲜有报道。本研究采用草酸注射法发现,感病品种小黄金1025和中烟100出现病斑扩散,抗病品种则没有出现病斑。说明用该种方法,可以快捷地鉴定出品种多镰刀菌的抗感能力。至于抗感程度和抗病机理,目前尚在研究中。
在本研究中多種方法接种鉴定认为,长脖黄为“中抗-抗”尖孢镰刀菌,与资料中的鉴定结果“中感”差异较大,至于具体原因,尚不明确。不同品种在大田接种尖孢镰刀菌接菌后的实际发病情况,本研究在尝试后没有得到抗感性鉴定结果,因为在大田中,镰刀菌根腐病和黑胫病往往是混合发生,大田土壤中黑胫病病菌很难分离出去。尖孢镰刀菌在苗期接种鉴定,优点是能确定生长基质或营养液的病菌纯度,确保发病症状是该种病菌引起的。几种鉴定方法是否与大田后期发病相一致,还需要进一步研究。
本研究利用的镰刀菌根腐病2个感病品种小黄金1025、中烟100和2个抗病品种长脖黄、664-01,经过多种方法多次鉴定,抗感性结果一致性较高,初步认为可以作为烟草镰刀菌根腐病抗性鉴定的抗感对照品种。值得重视的是,这4个品种,对烟草镰刀菌根腐病的抗感性与黑胫病的抗感性差异较大,对黑胫病的抗感性分别是:小黄金1025感病[26],中烟100抗病[27],长脖黄感病[28],664-01抗病。因大田发病镰刀菌根腐病和黑胫病经常混合发生,建议大田鉴定镰刀菌根腐病时,最好用中烟100作为感病对照,664-01作为抗病对照,可以减少黑胫病病菌对镰刀菌鉴定结果的影响。
4 结 论
本研究采取5种方法对烟草品种进行镰刀菌根腐病抗性鉴定,得出的结果大致相同,小黄金1025和中烟100为感病品种,长脖黄和664-01为抗病品种。为降低大田黑胫病对镰刀菌根腐病的影响,本研究认为可选择中烟100作为感病对照、664-01作为抗病对照。
8%尖孢镰刀菌毒素液处理烟草种子6 d可以鉴定烟草种子的抗感水平,该方法操作简单,不受季节影响,所需时间短,适合大批量材料的筛选。1×107个/mL孢子悬浮液培养烟苗3 d适合筛选烟草抗感品种,该方法准确度较高,感病品种发病较快、较明显,处理时间短。20%麦粒培养物培养10 d可以鉴定烟苗抗感水平,该方法能准确、直观地观察出烟苗发病情况,但与孢子悬浮液接种法相比受温湿度影响较大,所需时间长,操作较繁琐。叶片接菌饼法和草酸模拟注射法不能区分烟草品种抗感程度,可用来初步鉴定品种抗感性,两种方法均不受季节限制,操作简单便捷。因此,从鉴定结果准确直观来比较,认为孢子悬浮液接种法和带菌菌谷接种法最适合用于烟草品种镰刀菌根腐病抗性鉴定。
参考文献
[1]董晓清,高飞. 烟草种植移栽自动化应用分析[J]. 种子科技,2022,40(21):127-129.
DONG X Q, GAO F. Analysis on the application of tobacco planting and transplanting automation[J]. Seed Scicence & Technology, 2022, 40(21): 127-129.
[2]黄瑞环,芶剑渝,韩小斌,等. 烟草主要病害拮抗菌的筛选鉴定及除草活性分析[J]. 烟草科技,2019,52(12):17-22.
HUANG R H, GOU J Y, HAN X B, et al. Screening and identification of antagonistic Trichoderma sp. herbicidal activity against main tobacco diseases[J]. Tobacco Science & Technology, 2019, 52(12): 17-22.
[3]YUAN S, WANG L, WU K, et al. Evaluation of Bacillus-fortified organic fertilizer for controlling tobacco bacterial wilt in greenhouse and field experiments[J]. Applied Soil Ecology, 2014, 75: 86-94.
[4]CHEN S, QI G, LUO T, et al. Continuous-cropping tobacco caused variance of chemical properties and structure of bacterial network in soils[J]. Land Degradation & Development, 2018, 29: 4106-4120.
[5]WANG S, CHENG J, LI T, et al. Response of soil fungal communities to continuous cropping of flue-cured tobacco[J]. Scientific Reports, 2020, 10(1): e19911.
[6]涂雨瑤,王雪芬,周博,等. 河南烟区烟草根腐病病原菌分离鉴定[C]//植物病理科技创新与绿色防控——中国植物病理学会2021年学术年会论文集. 北京:中国农业科学技术出版社,2021:164.
TU Y Y, WANG X F, ZHOU B, et al. Isolation and identification of tobacco root rot pathogenic bacteria in Henan tobacco area[C]// Proceedings of Annual Meeting of Chinese Society for Plant Pathology. Beijing: China Agricultural Science and Technology Press, 2021: 164.
[7]ZHONG Q, XIAO Y S, HE B, et al. First report of Fusarium commune causing stem rot of tobacco (Nicotiana tabacum) in Hunan province, China[J]. Plant Dis, 2020, 105(5): 1568.
[8]李小杰,李琦,刘畅,等. 河南烟区烟草根茎类病害调查及病原鉴定[J]. 烟草科技,2022,55(1):41-47.
LI X J, LI Q, LIU C, et al. Pathogen identification of tobacco rhizomatic diseases in tobacco growing areas of Henan Province[J]. Tobacco Science & Technology, 2022, 55(1): 41-47.
[9]赵杰. 山东省烟草镰刀菌根腐病病原及生物学特性的研究[D]. 北京:中国农业科学院,2013.
ZHAO J. Identification and study on biological characteristics of the pathogen of Fusarium causing tobacco root-rot in Shandong Province[D]. Beijing: Chinese Academy of Agricultural Science Master Dissertation, 2013.
[10]陈芷. 福建省四种烟草根茎病害诊断及其病原学研究[D]. 福州:福建农林大学,2012.
CHEN Z. Etilogy and diagnosis of tobacco root and stem disease in Fujian, China[D]. Fuzhou: Fujian Agricultural and Forestry University, 2012.
[11]于庆涛,姚廷山. 烟草镰刀菌根腐病研究进展[J]. 安徽农业科学,2018,46(17):34-36.
YU Q T, YAO Y S. Advances in tobacco root rot caused by Fusarium[J]. Journal of Anhui Agricultural Sciences, 2018, 46(17): 34-36.
[12]姚晨虓,李小杰,刘畅,等. 3株拮抗烟草尖孢镰刀菌的木霉菌筛选鉴定及促生防病效果评价[J]. 中国烟草学报,2022,28(4):96-105.
YAO C X, LI X J, LIU C, et al. Screening and identification of three strains of Trichoderma spp. antagonizing Fusarium oxysporum and evaluation of their effects on promoting growth and disease control[J]. Acta Tabacaria Sinica, 2022, 28(4): 96-105.
[13]刘利佳,李芳芳,何雷,等. 烟草镰刀菌根腐病病原菌的鉴定及其对5种杀菌剂的敏感性分析[J]. 河南农业科学,2021,50(7):101-109.
LIU L J, LI F F, HE L, et al. Pathogen identification of tobacco Fusarium root rot and its sensitivity to five fungicides[J]. Journal of Henan Agricultural Sciences, 2021, 50(7): 101-109.
[14]邱睿,白静科,李成军,等. 河南烟草镰刀菌的分子鉴定及致病性分析[J]. 中国烟草学报,2018,24(2):129-134.
QIU R, BAI J K, LI C J, et al. Molecular identification and pathogenicity analysis of tobacco Fusarium spp. in Henan[J]. Acta Tabacaria Sinica, 2018, 24(2): 129-134.
[15]陈高航. 烟草根腐病病原鉴定及其生物学特性观察[D]. 武汉:华中农业大学,2013.
CHEN G H. The identification of tobacco root rot pathogen and its biological characteristics[D]. Wuhan: Huazhong Agricultural University, 2013.
[16]盖晓彤,代快,户艳霞,等. 云南省烟草镰刀菌根腐病菌遗传多样性分析[J]. 中国烟草学报,2022,28(5):113-120.
GAI X T, DAI K, HU Y X, et al. Genetic diversity of Fusarium oxysporum isolates causing tobacco root rot in Yunnan[J]. Acta Tabacaria Sinica, 2022, 28(5): 113-120.
[17]DRAKE K, BAKAHHER N, GOEPFERT S, et al. Multiple disease resistance loci affect soilborne disease resistance in tobacco (Nicotiana tabacum)[J]. Phytopathology, 2017, 107(9): 1055-1061.
[18]ZHANG Y, XUANN G, YAN X, et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco (Nicotiana tabacum L.) line Beinhart 1000-1[J]. The Crop Journal, 2018, 6(3): 282-290.
[19]邱睿,李芳芳,徐敏,等. 煙草品种对镰刀菌根腐病的抗性鉴定[J]. 中国烟草学报,2019,25(4):59-63.
QIU R, LI F F, XU M, et al. Evaluation of resistance to Fusarium root rot of selected tobacco varieties[J]. Acta Tabacaria Sinica, 2019, 25(4): 59-63.
[20]刘利佳. 烟草抗感镰刀菌根腐病鉴定方法及其防治研究[D]. 郑州:河南农业大学,2021.
LIU L J. Study on identification method of tobacco resistance to Fusarium root rot and its control[D]. Zhengzhou: HenanAgricultural University, 2021.
[21]赵杰,王静,李乃会,等. 烟草镰刀菌根腐病病菌致病粗毒素的研究[J]. 植物保护,2013,39(3):61-66.
ZHAO J, WANG J, LI N H, et al. A study on the pathogenic crude toxin of the tobacco root rot extracted from Fusarium sp.[J]. Plant Protection, 2013, 39(3): 61-66.
[22]曾莉,朱孟沼,刘树芳,等. 筛选放线菌活性产物防治烟草黑胫病的初步研究[J]. 植物保护学报,2006(2):221-222.
ZENG L, ZHU M Z, LIU S F, et al. Screening of the active metabolites of actinomycetes for control tobacco black shank[J]. Acta Phytophylacicas Sinica, 2006(2): 221-222.
[23]肖永生,黎定军,袁俊鹏,等. 对烟草青枯病苗期抗性鉴定接种方法的探讨[J]. 湖南农业科学,2000(3):39-40.
XIAO Y S, LI D J, YUAN J P, et al. Discussion on inoculation methods for the identification of tobacco wilt resistance at the seedling stage[J]. Hunan Agricultural Sciences, 2000(3): 39-40.
[24]刘胜毅,周必文,余琦,等. 草酸法筛选油菜抗菌核病材料的效果及其影响因素[J]. 植物保护学报,1998(1):56-60.
LIU S Y, ZHOU B W, YU Q, et al. Application of oxalic acid for screening resistance oilseed rape to Sclerotinia sclerotiorun and its affecting factors[J]. Journal of Plant Protection, 1998(1): 56-60.
[25]吴晓青,吕玉平,任何,等. 木霉对草酸耐受和消除作用的初步分析[J]. 微生物学通报,2016,43(9):1988-1998.
WU X Q, LYU Y P, REN H, et al. Tolerance and elimination of oxolic acid by Trichoderma spp.[J]. Microbiology China, 2016, 43(9): 1988-1998.
[26]丁燕芳,平文丽,孙计平,等. 烟草黑胫病抗性鉴定方法比较及其相关性分析[J]. 湖北农业科学,2017,56(18):3477-3480.
DING Y F, PING W L, SUN J P, et al. Comparison of methods to identify resistance to tobacco black shank disease and their correlation analysis[J]. Hubei Agricultural Sciences, 2017, 56(18): 3477-3480.
[27]賈兴华,王元英,佟道儒,等. 烤烟新品种中烟100(CF965)的选育及其应用评价[J]. 中国烟草学报,2006(2):20-25.
JIA X H, WANG Y Y, TONG D R, et al. Development of a new flue-cured tobacco variety Zhongyan100(CF965) and its application evaluation[J]. Acta Tabacaria Sinica, 2006(2): 20-25.
[28]向世鹏,胡日生,周向平,等. 烟草种质资源黑胫病抗性鉴定及亲缘关系SSR分析[J]. 华北农学报,2016,31(S1):156-161.
XIANG S P, HU R S, ZHOU X P, et al. Identification of resistance to black shank disease of tobacco gerplasm resources and analysis of genetic relationship of SSR[J]. Acta Agriculturae Boreali-Sinica: 2016, 31(S1): 156-161.

