暹罗芽孢杆菌挥发性物质拮抗下烟草赤星病菌转录组分析
李艺池 梁金昌 韦承建 王东坤 王卫民 陈勇华 宋光龙 胡希好 程德杰 任广伟 王晓强


摘 要:暹罗芽孢杆菌(Bacillus siamensis)LZ88是一株对多种病原真菌具有较强拮抗能力的生防细菌,产生的两种挥发性有机化合物(VOCs)2-甲基丁酸和3-甲基丁酸对链格孢菌具有显著的抑制作用。为进一步研究其拮抗机制,本研究通过2-甲基丁酸和3-甲基丁酸混合物与链格孢菌的平板对扣试验观察其拮抗作用,采用RNA-Seq技术对挥发性混合物拮抗下链格孢菌的转录组进行研究,并对部分差异表达显著的基因进行了qRT-PCR验证。结果表明,2种挥发性有机化合物混合处理能显著抑制链格孢菌的生长,菌丝表现出皱缩、塌陷的现象;通过差异表达分析共获得3461个差异表达基因(DEGs),其中1714个上调表达,1747个下调表达。对获得的DEGs进行功能注释及富集分析发现,挥发性有机化合物主要是通过影响链格孢菌的甘油磷脂代谢、MAPK信号通路以及聚酮类化合物的合成来抑制链格孢菌的生长发育。本研究揭示了2种挥发性化合物对链格孢菌的抑菌机制,为生防菌代谢产物的拮抗机制分析提供了新的思路。
关键词:暹罗芽孢杆菌;链格孢菌;挥发性有机化合物;转录组分析
中图分类号:S435.72 文献标识码:A 文章編号:1007-5119(2023)02-0027-08
Abstract: Bacillus siamensis LZ88 is a biocontrol bacterium with strong antagonistic ability against a variety of pathogenic fungi. Previous study indicated that volatile organic compounds (VOCs), 2-methylbutyric acid and 3-methylbutyric acid, produced by B. siamensis LZ88 showed significant inhibitory effects on Alternaria alternata. In the present study, the mechanism of 2-methylbutyric acid and 3-methylbutyric acid on A. alternate were further explored. Additionally, RNA-Seq was used to study the transcriptome of two volatile mixtures on A. alternata, and some significantly differentially expressed genes were verified by qRT-PCR. The results showed that the mixed treatment of the two VOCs could significantly inhibit the growth of A. alternata, and the hyphae were shrinkage and collapse. Through differential expression analysis, a total of 3461 differentially expressed genes (DEGs) were obtained, of which 1714 genes were up-regulated and 1747 genes were down-regulated. Functional annotation and enrichment analysis of the obtained DEGs revealed that various biological functions of A. alternata were affected by VOCs, including glycerophospholipid metabolism, MAPK signaling pathway and the synthesis of polyketides. The results give new insight into the inhibition mechanism of biocontrol bacteria metabolites products to A. alternata.
Keywords: Bacillus siamensis; Alternaria alternata; volatile organic compounds; transcriptome analysis
烟草赤星病是在烟叶成熟后期由半知菌亚门链格孢属真菌(Alternaria spp.)引起的一种重要的叶部真菌性病害,具有潜育期短、流行速度快等特点[1],是我国烟草生产上威胁最大的病害之一,直接影响烟叶的产量和品质。目前,烟草生产上对赤星病的防治主要以化学防治为主,但是长期大量使用化学药剂会导致病原菌产生抗药性,并造成烟叶农药残留问题,影响烟叶品质[2-3]。生物防治能有效避免或减少对生物和环境造成的不利影响,在烟草病虫害的防控中具有极大的应用前景。
芽孢杆菌是一种常见的生防细菌,并被广泛应用于植物病害的防控。芽孢杆菌可以产生多种抗菌物质,包括非挥发性化合物和挥发性化合物。其中,挥发性有机化合物(VOCs)主要包括酯类、烷烃类、醇类、萜类等[4],可以抑制病原菌的生长,或诱导植物产生系统抗性[5-6]。目前,利用芽孢杆菌挥发性化合物抑菌病原菌的研究主要以描述病原菌的菌丝、孢子变化和细胞形态为主。例如,特基拉芽孢杆菌XK29产生的挥发物2-甲基丁酸显著抑制甘薯长喙壳菌菌丝生长和孢子萌发,降低其产孢能力,导致菌丝折叠弯曲并形成不连续的空腔等[7],但鲜有关于挥发性化合物抑制病原真菌生长的分子机制的报道。
本课题组前期研究发现暹罗芽孢杆菌(Bacillus siamensis)LZ88对多种病原真菌都具有显著的拮抗活性,通过对其挥发性有机化合物进行研究,发现2-甲基丁酸和3-甲基丁酸具有抗真菌活性,能够抑制链格孢菌的生长[8],但其拮抗机制尚不清楚。因此,本研究对2-甲基丁酸和3-甲基丁酸处理后的链格孢菌进行转录组分析,探究两种挥发性化合物对链格孢菌的抑菌机制,以期为利用暹羅芽孢杆菌挥发性化合物防控链格孢菌提供理论依据,并为相关病害的防控提供新思路。
1 材料与方法
1.1 材料
供试病原菌:链格孢菌(A. alternata)由本实验室从烟草赤星病发病烟叶上分离鉴定并保存。将链格孢菌在PDA培养基上28 ℃活化培养。
供试培养基:马铃薯葡萄糖琼脂培养基(PDA)和马铃薯葡萄糖肉汤培养基(PDB)购自海博生物技术有限公司。
供试试剂:2-甲基丁酸(纯度:98%;CAS:116-53-0)和3-甲基丁酸(纯度≥99.0%;CAS:503-74-2)购自北京索莱宝生物科技有限公司;Trizol试剂购自Invitrogen公司;Yeasen Hifair?Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)购自翌圣生物科技有限公司;SparkJade 2×SYBR Green qPCR Mix(With ROX)购自思科捷生物技术有限公司。
1.2 方法
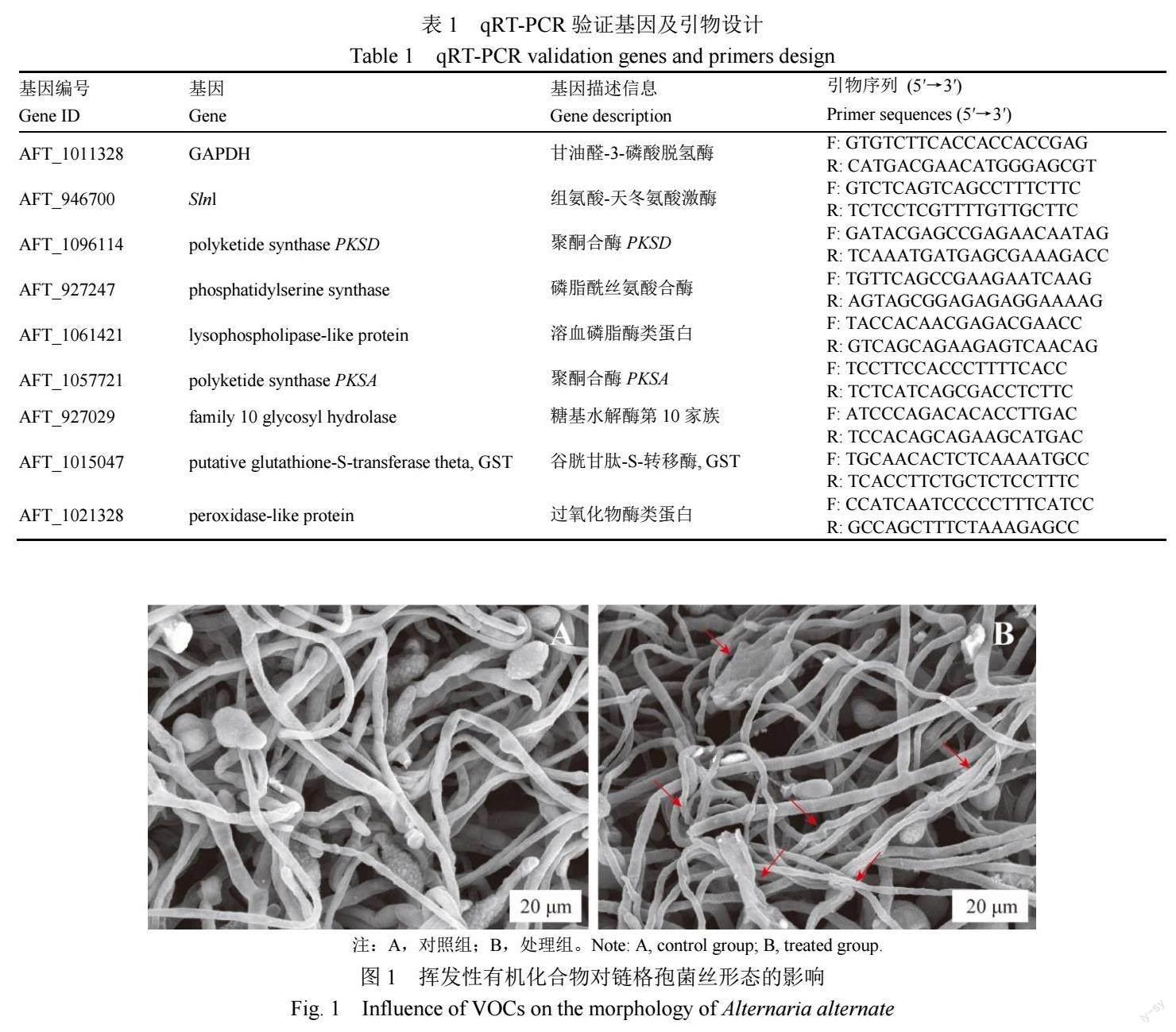
1.2.1 2-甲基丁酸和3-甲基丁酸混合物对链格孢菌生长的影响 根据前期的试验结果[8],提前将2-甲基丁酸和3-甲基丁酸纯品用无水乙醇分别配置成83.10和104.19 mg/mL的溶液。处理组分别吸取10 μL配置好的2-甲基丁酸和3-甲基丁酸溶液添加至直径6 mm的滤纸片上,放在上层PDA培养基中心,取直径约5 mm的新鲜链格孢菌菌饼接种在下层PDA培养基中心,将两个培养皿对扣培养。对照组只在下层PDA培养基中心接种链格孢菌菌饼。处理组和对照组各重复3次,于28 ℃培养7 d后,测定抑菌效果。收集各组菌丝体,用扫描电子显微镜(SEM)拍照观察不同处理组菌丝形态。
1.2.2 转录组样品准备 在150 mL无菌PDB液体培养基中接入4个链格孢菌菌饼,180 r/min、28 ℃振荡培养2 d后,处理组加入2-甲基丁酸(终浓度0.066 mg/mL)和3-甲基丁酸(终浓度0.058 mg/mL)各15 μL,对照组不做任何处理。对照组和处理组各3个重复,180 r/min、28 ℃继续振荡培养4 d,用无菌滤膜过滤出菌丝,再用无菌水清洗3次,抽滤去掉水分后用液氮速冻,置于–80 ℃保存,用于提取链格孢菌的总RNA。
1.2.3 RNA提取与测序文库构建 链格孢菌总RNA的提取使用Trizol法。分别提取处理组和对照组的RNA,并通过Nanodrop 2000检测总RNA的浓度和纯度,琼脂糖凝胶电泳检测RNA的完整性,Agilent 2100测定RIN值。将总RNA送至上海美吉生物医药科技有限公司进行测序(Illumina HiSeq 2500测序平台)。转录组数据上传至NCBI(https://www.ncbi.nlm.nih.gov/)数据库,登录号为PRJNA900390。
1.2.4 测序数据处理 对过滤得到的高质量clean reads进行拼接组装,获得unigenes库。通过Blast将筛选到的unigene序列与NR、Swiss-prot、Pfam、GO、COG和KEGG等公共数据库进行比对,获得注释信息。利用FPKM(Fragments Per Kilobases per
Millionreads)公式计算unigene的表达量,DESeq2软件筛选差异表达基因(Differentially expressed genes,DEGs),以差异倍数[|log2(Fold change)|]>1和错误发现率(false discovery rate, FDR)<0.05作为筛选的标准。通过Goatools和KOBAS对筛选出的差异表达基因分别进行GO功能富集分析和KEGG通路分析。
1.2.5 qRT-PCR验证 将链格孢菌的总RNA利用Yeasen HifairⅢ 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)反转录成cDNA。以GAPDH为内参基因,选取8 个与链格孢菌生长有关的DEGs进行qRT-PCR反应,以验证转录组测序结果的准确性。引物序列见表1,反应体系参考SparkJade 2×SYBR Green qPCR Mix(With ROX)试剂盒,利用ABI SetpOne? Real-Time PCR System进行PCR扩增,具体程序如下:94 ℃ 2 min;94 ℃ 5 s,60 ℃ 30 s,共40个循环。结果根据2?ΔΔCT法进行数据分析。
2 结 果
2.1 2-甲基丁酸和3-甲基丁酸混合物对链格孢菌生长的影响
如图1所示,通过SEM观察到对照组菌丝茂密,粗细较均匀,表面光滑,处理组的菌丝体损伤严重,菌丝粗细不均匀,出现明显的皱缩、扭曲等现象。此外,与对照组相比,处理组样品中孢子变形和塌陷,未附着分生孢子的菌丝出现破裂、收缩和扭曲,表明2-甲基丁酸和3-甲基丁酸的混合物抑制了链格孢菌丝的生长。
2.2 测序结果的评估
根据VOCs对链格孢菌生长的影响效果,选取对照组和处理组各3个样本进行转录组测序。如表2所示,获得的raw reads序列数量在23 477 010~55 234 710之间,过滤掉低质量的序列reads后,获得的clean reads序列的数量在23 476 806~55 234 282之间;满足Q30标准的碱基数均达到95%以上,碱基错误率均值约为0.0232%,表明测序质量良好,可以为后续的分析提供可靠的原始数据。根据PCA分析结果(图2),PC1解释78.13%的变量,对照组和处理组分别聚成一簇,对照组和处理组间具有明显差异。
2.3 基因表达差异
与对照组相比,经VOCs处理后的链格孢菌中有3461个差异表达基因(DEGs),其中上调表达的基因有1714个,下调表达的基因有1747个(图3)。对差异表达基因进行COG(Cluster of Orthologous Groups of proteins)注释,共有3255个DEGs注释到COG数据库,包含1635个上调表达基因,1620个下调表达基因。在上调表达基因中翻译、核糖体结构与生物合成(J),翻译后修饰、蛋白质折叠、分子伴侣(O),氨基酸运输与代谢(E),细胞内运输、分泌与囊泡运输(U)这4类最多,占到78.72%;而细胞内运输、分泌与囊泡运输(U),碳水化合物运输与代谢(G),翻译后修饰、蛋白质折叠、分子伴侣(O)以及转录(K)这4类在下调基因中所占比例较高,达到85.31%(图4)。
2.4 富集分析
2.4.1 差异表达基因GO功能富集分析 对下调的DEGs进行GO富集分析发现(图5),细胞组分中细胞结构体、膜组成部分和膜固有成分富集基因数较多,而生物过程中脂质代谢过程富集最显著。对上调的DEGs进行GO富集分析发现细胞氨基酸生物合成过程、核糖核蛋白复合体组装和有机酸分解代谢过程3个功能最显著富集。
2.4.2 差异表达基因的KEGG富集分析 对1714个上调和1747个下调的DEGs分别进行KEGG富集分析(图6-7),发现有937个上调的DEGs定位到112条KEGG通路中。显著富集的通路有核糖体,缬氨酸、亮氨酸和异亮氨酸降解,RNA转运,其中富集基因数目最多的是核糖体通路。另外有391个下调的DEGs定位到97条KEGG通路中,显著富集的有甘油磷脂代谢、醚脂代谢、MAPK信号通路,富集基因数目最多的是甘油磷脂代谢通路。
2.5 与链格孢菌生长相关代谢通路的差异表达基因分析
結合COG功能注释、GO富集以及KEGG富集,从所有的差异表达基因中筛选出与链格孢菌生长相关的差异表达基因(p<0.01),下调的基因主要参与甘油磷脂代谢、MAPK信号通路及聚酮类物质的合成,上调的基因主要参与谷胱甘肽代谢、淀粉和蔗糖代谢等过程(表3)。
2.6 qRT-PCR验证
为了检验转录组测序结果的准确性,从筛选出的差异表达基因中随机挑选8个差异显著的基因进行qRT-PCR验证,其中包括5个下调表达基因和3个上调表达基因。结果表明,所选基因的表达水平与转录组结果趋势一致(图8),说明转录组测序的结果是可靠的。
3 讨 论
微生物在其生长代谢过程中会产生多种非挥发性和挥发性次级代谢产物[9]。在自然环境状态下,挥发性有机化合物是以多种化合物混合的形式产生。因此,本研究通过模拟自然环境状态,将暹罗芽孢杆菌LZ88[8]产生的挥发性有机化合物2-甲基丁酸和3-甲基丁酸混合后处理链格孢菌,利用转录组学进一步分析了2-甲基丁酸和3-甲基丁酸混合物对链格孢菌的抑制作用机制,发现VOCs通过调控链格孢菌的甘油磷脂代谢途径、MAPK信号通路以及聚酮类物质的合成等抑制菌丝的生长繁殖。
甘油磷脂是真核生物中生物膜的重要组成部分,参与细胞膜对蛋白质的识别和信号传导,与菌丝生长发育密切相关。线粒体膜由磷脂双分子层组成,参与调节线粒体的形态及线粒体功能发挥的过程[10],为生命提供能量[11]。在本研究中甘油磷脂代谢途径中编码磷脂酰丝氨酸合酶(AFT_927247)、磷脂酰丝氨酸脱羧酶(AFT_189401)、磷脂酰乙醇胺N-甲基转移酶(AFT_789367)、FabD/溶血磷脂酶类蛋白(AFT_1009916)、溶血磷脂酶类蛋白(AFT_1061421)的基因显著下调,线粒体内外膜的磷脂生物合成受阻。研究发现酿酒酵母中,PE(磷脂酰乙醇胺)和PS(磷脂酰丝氨酸)的生物合成丧失会导致线粒体缺陷,从而使小突变体的形成增加[12];白色念珠菌磷脂酰丝氨酸(PS)合酶突变体cho1Δ/Δ缺乏PS,磷脂酰乙醇胺降低,在一定程度上影响了线粒体呼吸功能,突变体表现出丝状生长缺陷[13]。因此,本研究中VOCs可能通过抑制磷脂的合成,使线粒体内外膜不能行使正常的功能,进而影响链格孢菌菌丝的正常生长。
MAPK信号通路是调控许多病原真菌生长、发育和致病性胞外信号转导的重要途径[14]。在本研究中MAPK信号通路中细胞壁完整性途径(cell wall intergrity, CWI)的基因Bck1(AFT_927542)和Fks2(AFT_1005247)显著下调,表明VOCs处理干扰了链格孢菌细胞壁完整性途径中的级联组分,阻碍了细胞壁的合成,对菌丝细胞壁完整性造成影响。此外,MAPK信号通路中高渗透压途径(High osmolarity pathway,HOG)相关的Sln1(AFT_946700)、Ssk1(AFT_186722)和Sko1显著下调,表明VOCs处理影响菌丝对外界压力做出适应性反应。这与张楠等[15]在胶孢炭疽菌中发现的HOG途径上游感受器Sho1同源基因CgSho1缺失,造成突变菌株营养生长缓慢、产孢量下降、菌丝稀疏等特征是一致的。因此,链格孢菌经VOCs处理后可能通过抑制MAPK信号通路从而影响其菌丝细胞壁的完整性并对压力做出适应性反应,造成菌丝生长的缺陷。
真菌聚酮类化合物(polyketides,PKs)主要由真菌聚酮合酶合成,被认为是病原体毒素和致病因子的来源[16]。例如,来自于曲霉菌的聚酮类化合物aflatoxin B1是侵染花生、玉米、水稻、大豆等多种作物的毒力因子[17];镰刀属真菌产生的zearalenone是侵染玉米的重要毒力因子,主要通过聚酮化合物途径合成[18]。链格孢菌中含有大量的聚酮合酶基因,包括PKSA(AFT_1057721)、PKSB(AFT_176278)、PKSC(AFT_1012953)、PKSD(AFT_1096114)、PKSH(AFT_976935)等,参与合成芳香族和复杂的还原型聚酮类化合物,包括alternaric acid、alternariol、macrosporin、zinnolide、 zinniol等[19-21]。本研究中,聚酮合酶基因显著下调,说明VOCs处理后其表达受到抑制,聚酮类物质的生物合成受阻,从而降低链格孢菌的毒性,保护烟株免受链格孢菌的胁迫。
4 结 论
本研究表明,暹罗芽孢杆菌产生的挥发性有机化合物2-甲基丁酸和3-甲基丁酸可以显著抑制链格孢菌丝的生长;与对照组相比,经VOCs处理后的链格孢菌中有3461个差异表达基因;结合COG功能注释、GO富集以及KEGG富集分析发现,链格孢菌生长受阻与甘油酯代谢途径、MAPK信号通路及聚酮类物质的合成有关,但具体机制还需进一步深入研究。
参考文献
[1]张中义,冷怀琼,张志铭,等. 植物病原真菌学[M]. 成都:四川科學技术出版社,1988.
ZHANG Z Y, LENG H Q, ZHANG Z M, et al. Plant pathogenic mycology[M]. Chengdu: Sichuan Science and Technology Press, 1988.
[2]HOU Y, MA X, WAN W, et al. Comparative genomics of pathogens causing brown spot disease of tobacco: Alternaria longipes and Alternaria alternata[J]. Plos One, 2016, 11(5): e0155258.
[3]JING C, ZHAO J, HAN X, et al. Essential oil of Syringa oblata Lindl. as a potential biocontrol agent against tobacco brown spot caused by Alternaria alternata[J]. Crop Protection, 2018, 104: 41-46.
[4]孙力. 贝莱斯芽孢杆菌CanL-30挥发性有机物活性研究及菌剂研制[D]. 武汉:华中农业大学,2020.
SUN L. Bioactivities of the volatile organic compounds of Bacillus velezensis CanL-30 and formulation of a wettable powder[D]. Wuhan: Huazhong Agricultural University, 2020.
[5]ZAMIOUDIS C, KORTELAND J, VAN PELT J A, et al. Rhizobacterial volatiles and photosynthesis-related signals coordinate MYB72 expression in Arabidopsis roots during onset of induced systemic resistance and iron-deficiency responses[J]. Plant Journal, 2012, 84(2): 309-322.
[6]GAO Z, ZHANG B, LIU H, et al. Identification of endophytic Bacillus velezensis ZSY-1 strain and antifungal activity of its volatile compounds against Alternaria solani and Botrytis cinerea[J]. Biological Control, 2017, 105: 27-39.
[7]李腾杰,梁孙妍,郭健衡,等. 特基拉芽孢杆菌XK29挥发物2-甲基丁酸对甘薯长喙壳菌的抑制作用研究[J]. 微生物学报,2022,62(12):5018-5028.
LI T J, LIANG S Y, GUO J H, et al. Inhibitory effects of volatile 2-methylbutyric acid produced by Bacillus tequilensis XK29 on Ceratocystis fimbriata[J]. Acta Microbiologica Sinica, 2022, 62(12): 5018-5028.
[8]WANG D K, LI Y C, YUAN Y, et al. Identification of non-volatile and volatile organic compounds produced by Bacillus siamensis LZ88 and their antifungal activity against Alternaria alternata[J]. Biological Control, 2022, 169: 1049-9644.
[9]MORATH S, HUNG R, BENNETT J W. Fungal volatile organic compounds: A review with emphasison their biotechnological potential[J]. Fungal Biology Reviews, 2012, 26(2-3): 73-83.
[10]BAUSEWEIN T, MILLS D J, LANGER J D, et al. Cryo-EM structure of the TOM core complex from Neurospora Crassa[J]. Cell, 2017, 170(4): 693-700.
[11]GUO R, ZONG S, WU M, et al. Architecture of human mitochondrial respiratory megacomplex Ⅰ2Ⅲ2Ⅳ2[J]. Cell, 2017, 170(6): 1247-1257.
[12]BIRNER R, BURGERMEISTER M, SCHNEITER R, et al. Roles of phosphatidylethanolamine and of its several biosynthetic pathways in Saccharomyces cerevisiae[J]. Molecular Biology of the Cell, 2001, 12(4): 997-1007.
[13]CHEN Y L, MONTEDONICO A E, KAUFFMAN S, et al. Phosphatidylserine synthase and phosphatidylserine decarboxylase are essential for cell wall integrity and virulence in Candida albicans[J]. Molecular Microbiology, 2010, 75(5): 1112-1132.
[14]王笑連. 杨树炭疽病菌CgMk1 MAPK及上游受体蛋白的功能分析[D]. 北京:北京林业大学,2021.
WANG X L. Functional analysis of CgMk1 MAPK and the upstream receptors in Colletotrichum gloeosporioides[D]. Beijing: Beijing Forestry University, 2021.
[15]张楠,柳志强,吴曼莉,等. 胶孢炭疽菌CgSho1基因的克隆与功能分析[J]. 植物病理学报,2017,47(1):40-49.
ZHANG N, LIU Z Q, WU M L, et al. Gene cloning and functional analysis of CgSho1 in Colletotrichum gloeosporioides[J]. Acta Phytopathologica Sinica, 2017, 47(1): 40-49.
[16]MINAMI A, UGAI T, OZAKI T, et al. Predicting the chemical space of fungal polyketides by phylogeny-based bioinformatics analysis of polyketide synthase-nonribosomal peptide synthetase and its modification enzymes[J]. Scientific Reports, 2020, 10(1): 13556.
[17]RUSHING B R, SELIM M I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods[J]. Food and Chemical Toxicology, 2019, 124: 81-100.
[18]RAI A, DAS M, TRIPATHI A. Occurrence and toxicity of a fusarium mycotoxin, zearalenone[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(16): 2710-2729.
[19]COURTIAL J, HELESBEUX J J, OUDART H, et al. Characterization of NRPS and PKS genes involved in the biosynthesis of SMs in Alternaria dauci including the phytotoxic polyketide aldaulactone[J]. Scientific Reports, 2022, 12(1): 8155.
[20]FUJII I. Functional analysis of fungal polyketide biosynthesis genes[J]. The Journal of Antibiotics, 2010, 63: 207-218.
[21]UGAI T, MINAMI A, GOMI K, et al. Genome mining approach for harnessing the cryptic gene cluster in Alternaria solani: production of PKS-NRPS hybrid metabolite, didymellamide B[J]. Tetrahedron Letters, 2016, 57: 2793-2796.

