益肾泻浊方抑制裸角质层同源物2活性干预慢性肾衰竭的机制研究
顾鸣佳,高磊平,魏晴雪,朱莺,包能,张航,朱介宾
(1.南京中医药大学常熟附属医院,江苏 常熟 215500;2.江南大学附属医院,江苏 无锡 214000)
慢性肾衰竭(Chronic renal failure,CRF)是各类慢性肾脏疾病的最终转归,为我国目前所面临的一大公共卫生问题[1]。CRF的典型特征是肾纤维化[2],主要病理改变包括肾小管萎缩,肾间质炎性细胞浸润及细胞外基质(Extracellular matrix, ECM)沉积[3]。到目前为止,该病的发病机制尚未完全阐明,有效治疗手段匮乏。CRF属中医“虚劳”范畴,总体病因病机为脾肾两虚,浊瘀阻滞[4],项目组据此以孟河邹氏益肾泻浊法为指导思想[5]创制协定方,在临床上取得了不错的疗效,其主要药物包括黄芪、菟丝子、丹参、桃仁、红花、制大黄等。
CRF的病变关键是肾纤维化,以肌成纤维细胞的形成和细胞外基质的分泌为主要特征。氧化应激[6]、炎症反应[7]和间质细胞形成[8]等病理反应是导致肾纤维化的直接原因,但调控上述病变的分子机制仍不明确。裸角质层同源物2(Naked cuticle homolog 2, NKD2)是果蝇裸表皮的哺乳动物直系同源体,位于染色体5p15.3,其C-端高度无序,N-端区域则包含大部分功能域,如酰胺化区、蓬乱蛋白结合区等[9]。NKD2在肿瘤领域被研究的较为深入,其常通过拮抗TGF-β等信号通路抑制肿瘤的生长和转移[10]。2020年底,Nature杂志首次在CRF领域关注到NKD2,指出人类肾纤维化主要归因于肌成纤维细胞的形成,而NKD2则是其特异性标记物[11],该发现为深入阐明CRF的发病机制和药物的作用原理指明了新的方向。据于此,我们拟从整体动物层面验证益肾泻浊方治CRF的疗效,并以NKD2为切入点初步探索其起效的分子机制。
1 材料与方法
1.1 动物
45只雄性SPF级8周龄BALB/c小鼠,体质量21~25 g,购自常州卡文斯实验动物有限公司。动物许可证号:SCXK(苏)2016-0010。在南京中医药大学实验动物中心动物房饲养。小鼠适应环境1周(每日自由进食饮水),温度(21.0±2.0)℃,湿度(55.0±5.0)%,每日12 h光照,12 h避光。本实验通过南京中医药大学动物实验伦理会审查,伦理编号:A220307。
1.2 药物与试剂
益肾泻浊方(生黄芪15 g,党参15 g,炒白术10 g,茯苓10 g,菟丝子15 g,石斛30 g,川芎10 g,红花10 g,制大黄6 g,丹参30 g,焦山楂15 g,莪术10 g)中药购自江苏省中医院药房。按配伍比例称取上述生药,用1 200 mL蒸馏水浸泡60 min,煎煮60 min,滤过收集煎煮液;剩余药渣用1 200 mL蒸馏水2次煎煮60 min,并按前法收集煎煮液。合并2次药液,4 ℃温度下以4 000×g速率离心10 min,取上清液浓缩成12 g·kg-1水煎剂。氯沙坦分散片(麦克林,货号:L910459);抗体Fibronectin/FN1(Cell Signaling Technology公司,货号:26836);抗体Collagen I(Abcam公司,货号:ab138492);抗体Lamin B1(Cell Signaling Technology公司,货号:17416);抗体NKD2(Cell Signaling Technology公司,货号:2596);抗体α-SMA(Cell Signaling Technology公司,货号:19245);抗体GAPDH(Affinity公司,货号:AF7021);苏木素-伊红(HE) 染液(碧云天生物技术公司,批号:C0105S);BCA蛋白浓度测定试剂盒(碧云天生物技术公司,批号:P0012S);RIPA强裂解液(碧云天生物技术公司,批号:P0013B);IL-1β ELISA检测试剂盒(上海茁彩生物科技有限公司,批号:ZC-37974);IL-6 ELISA检测试剂盒(上海茁彩生物科技有限公司,批号:ZC-37988);TNF-α ELISA检测试剂盒(上海茁彩生物科技有限公司,批号:ZC-39024);血尿素氮(BUN) 测试盒(上海茁彩生物科技有限公司,批号:ZC-S0758);血肌酐(SCr)检测试剂盒(上海茁彩生物科技有限公司,批号:ZC-A1191)。
1.3 分组及模型制备
45只小鼠随机分为假手术组(Sham)、模型组(UUO)、低剂量复方组(7-YXR)、高剂量复方组(14-YXR)和阳性药物组(10-Los),每组9只。除假手术组外,其余组均采用单侧输尿管梗阻法(UUO)构建CRF小鼠模型[12]。假手术组和模型组以0.5%羧甲基纤维素钠灌胃,低剂量复方组按7 g·kg-1中药灌胃,高剂量复方组则按14 g·kg-1中药灌胃,阳性药物组以10 mg·kg-1氯沙坦溶液灌胃[13]。各组小鼠在造模前24 h、造模前2 h各给药1次,造模后每天给药1次,疗程15 d。
1.4 标本收集
末次给药结束后,将小鼠禁食(不禁水)12 h,予戊巴比妥按5 mL·kg-1剂量腹腔注射麻醉。处死后,摘眼球取血,随后分离肾脏,一部分保存在4%多聚甲醛中,剩余部分保存于-80 ℃冰箱中,用于提取蛋白质进行Western blot分析。血液样本在室温下静置1 h后,以900g速率离心15 min,上层血清保存于-80 ℃冰箱中,用于生化指标检测。
1.5 检测指标及方法
1.5.1 HE染色 将放于4%多聚甲醛中肾脏组织进行脱水和石蜡包埋,使用轮转式切片机将蜡块切成4 μm的冠状切片备用。切片依次用二甲苯脱蜡,不同浓度乙醇脱水,苏木素染色,分化液分化,伊红胞浆染色,不同浓度乙醇脱水,二甲苯透明,中性树脂封片。显微镜镜检,图像采集分析。
1.5.2 肾小管损伤评分和肾纤维化区域量化 肾组织用4%多聚甲醛固定过夜,并包埋在石蜡中。石蜡包埋的肾脏切成薄片(厚度约4 μm),并在分级醇中脱水,然后用苏木素-伊红(HE)或Masson染色。根据肾小管扩张和坏死程度评估肾小管损伤,以肾皮质-髓质区损伤百分比进行分级[14],评分范围为0~4。具体方法如下:0分,无;1分,<25%;2分,25%~50%;3分,50%~70%;4分,>75%;对肾纤维化区域进行Masson染色,染色后细胞核、胶原纤维及蛋白呈蓝色,细胞浆、肌肉、红细胞呈红色。使用Image Pro Plus 6.0软件计算颜色像素计数百分比,将纤维化区域进行量化[15]。
1.5.3 肾脏Collagen α1免疫组化染色 将4 μm石蜡包埋的肾切片玻片进行脱蜡,再水化,然后用Tris-EDTA缓冲液(1%,w/v)加热以进行抗原回收。在5% BSA中封闭1 h后,将组织切片与Collagen α1在4 ℃过夜。用DAB溶液显示阳性信号。使用奥林巴斯IX3-SVR显微镜(日本东京奥林巴斯)计算阳性细胞定量。
1.5.4 各项血清指标检测 使用酶联免疫分析法(Enzyme linked immunosorbent assay,ELISA)试剂盒测定血清中IL-1β、IL-6和TNF-α的水平;使用试剂盒检测BUN和SCr水平。
1.5.5 Western Blot检测肾脏Collagen α1、FN1、α-SMA及NKD2蛋白表达量 将肾脏组织用PBS溶液清洗2遍,加入含1%PMSF和2%磷酸酶抑制剂的RIPA裂解液,使用高通量组织匀浆机进行低温研磨。匀浆在4 ℃和12 000 r·min-1下离心20 min,然后吸取上清液。根据生产说明书,使用BCA试剂盒测定上清液的蛋白质浓度。后通过12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离每个样品中等量的蛋白质,并转移到聚偏二氟乙烯(PVDF)膜上。在与一抗和二抗孵育并洗涤后,使用Tanon凝胶成像系统检测蛋白质条带,并使用Image J软件分析蛋白条带的灰度值。
1.5.6 免疫荧光检测肾脏Collagen α1和NKD2表达 将肾脏组织用5%BSA固定、渗透和封闭,然后在4 ℃下与一级抗体孵育过夜,并在25 ℃下与二级抗体在黑暗中孵育1 h,然后用DAPI进一步染色10 min。使用荧光显微镜观察和分析图像。
1.6 统计学方法

2 结果
2.1 各组小鼠肾脏形态和质量
与正常组相比,模型组小鼠肾脏组织出现水肿、颜色变浅、体积增大,肾脏质量指数显著增加(P<0.01);与模型组相比,药物组均缓解了小鼠肾脏水肿,且显著降低了肾脏质量指数(P<0.01)(图1)。

注:与Sham组相比,##P<0.01;与UUO组相比,图1 各组小鼠肾脏形态和质量变化Fig.1 Changes in kidney morphology and weight of mice in each group
2.2 各组小鼠肾脏病理
HE染色、Masson染色和免疫组化显示:与正常组相比,模型组小鼠肾小管扩张、肾小管上皮细胞丢失、胶原沉积且纤维化显著,而治疗则不同程度的缓解上述病理改变。见图2。

图2 各组小鼠肾脏病理情况Fig.2 Renal pathology of mice in each group
2.3 各组小鼠肾小管损伤评分、肾纤维化区域及Collagen α1表达量
与正常组相比,模型组小鼠肾脏存在显著的肾小管损伤(P<0.01),低剂量复方组与模型组相比,肾小管损伤评分差异无统计学意义,而高剂量复方组小鼠肾小管损伤评分显著低于模型组(P<0.01)。此外,模型组小鼠肾纤维化水平和Collagen α1免疫组化表达量显著增加(P<0.01);与模型组相比,低剂量复方组显著降低了纤维化水平和Collagen α1免疫组化表达量(P<0.05),且高剂量复方组比低剂量组的药效更显著(P<0.01)。见图3。

注:与Sham组相比,##P<0.01;与UUO组相比,图3 各组小鼠肾小管损伤评分、肾纤维化区域及Collagen α1表达量比较Fig.3 Comparison of renal tubule injury score, renal fibrosis area, and Collagen α1 expression in mice of each group
2.4 各组小鼠BUN和SCr水平
与正常组相比,模型组小鼠BUN和SCr水平均明显升高(P<0.01)。与模型组相比,药物组小鼠BUN和SCr水平均显著降低(P<0.01)。见图4。

注:与Sham组相比,##P<0.01;与UUO组相比,图4 各组小鼠BUN和SCr水平比较Fig.4 Comparison of BUN and Scr levels of mice in each group
2.5 各组小鼠血清IL-6、IL-1β和TNF-α水平
与正常组相比,模型组小鼠血清IL-6、IL-1β以及TNF-α水平均明显升高(P<0.01)。药物组小鼠与模型组相比,血清IL-6、IL-1β以及TNF-α水平均显著降低(P<0.01)。见图5。
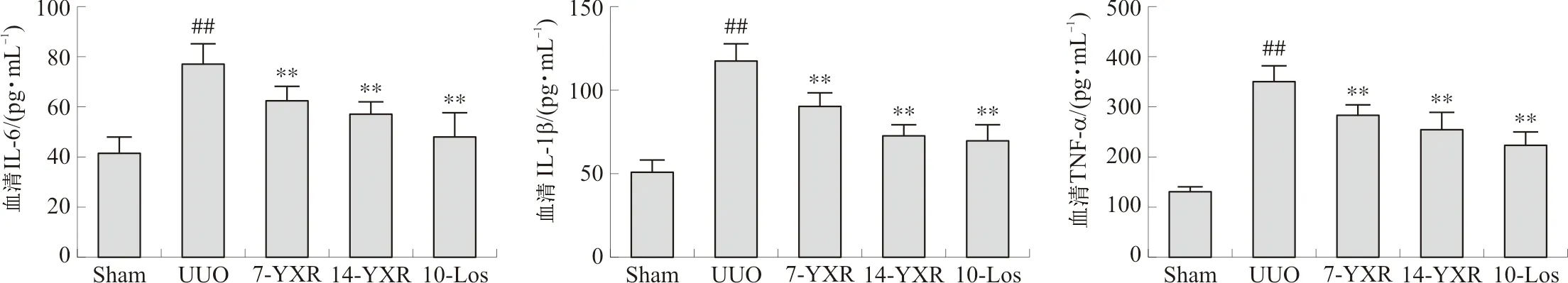
注:与Sham组相比,##P<0.01;与UUO组相比,图5 各组小鼠血清IL-6、IL-1β和TNF-α水平比较Fig.5 Comparison of IL-6, IL-1β and TNF-α levels of mice in each group
2.6 各组小鼠肾脏Collagen α1、FN1、α-SMA及NKD2蛋白表达量
与正常组比较,模型组小鼠肾脏的Collagen α1、FN1、α-SMA及NKD2蛋白表达量均显著升高(P<0.01)。药物组小鼠与模型组相比,Collagen α1、FN1、α-SMA及NKD2蛋白表达量均显著降低(P<0.01)。见图6。

注:与Sham组相比,##P<0.01;与UUO组相比,图6 各组小鼠肾脏Collagen α1、FN1、α-SMA及NKD2蛋白表达量比较Fig.6 Comparison of renal Collagen α1, FN1, α-SMA and NKD2 protein expression in mice of each group
2.7 各组小鼠肾脏Collagen α1与NKD2表达
与对照组相比,模型组Collagen α1和NKD2的免疫荧光定量显著高于对照组(P<0.01),药物治疗后能降低2组免疫荧光定量(P<0.01),且高剂量组效果明显。见图7。
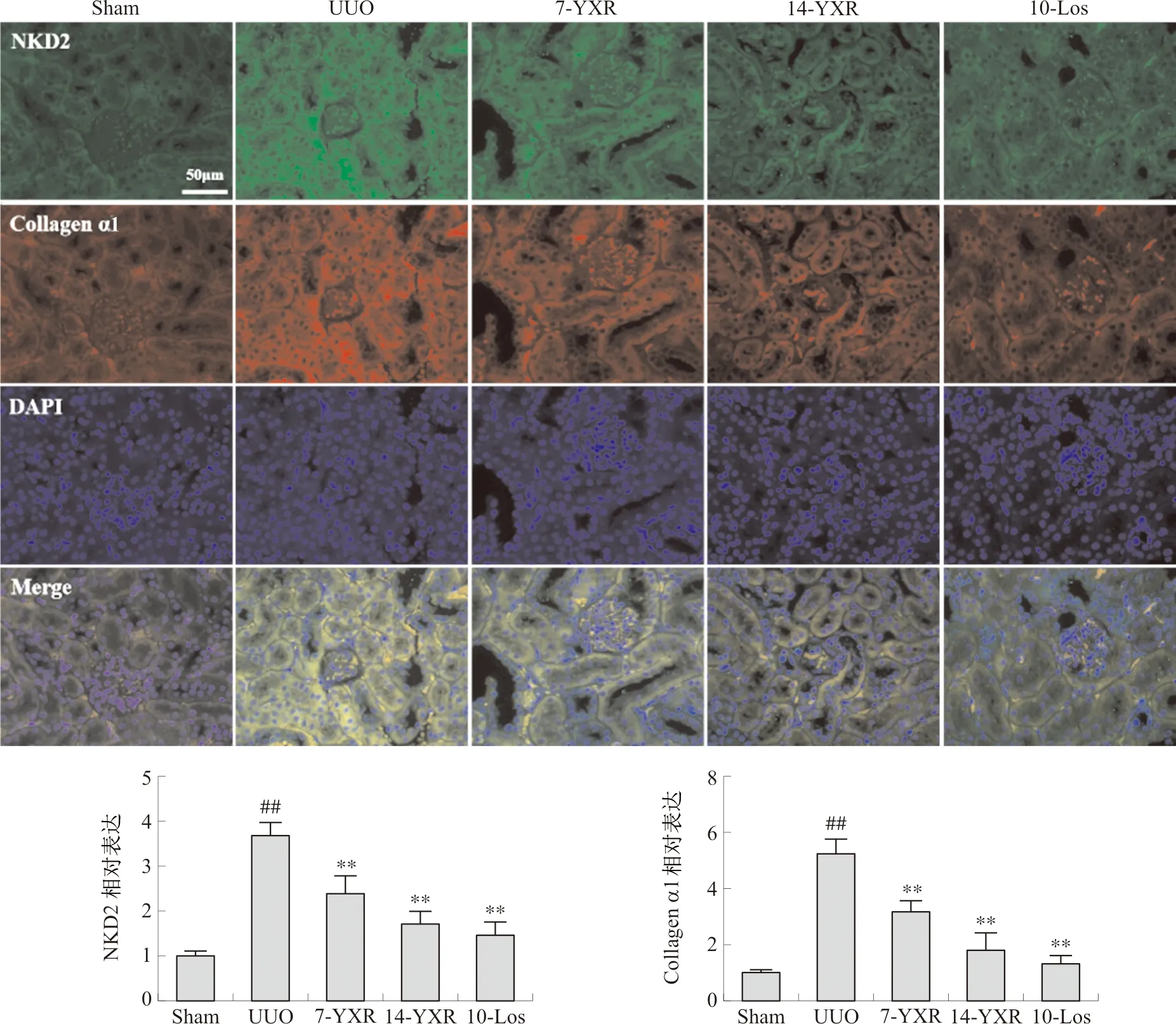
注:与Sham组相比,##P<0.01;与UUO组相比,图7 各组小鼠肾脏Collagen α1和NKD2免疫荧光结果比较Fig.7 Comparison of renal Collagen α1 and NKD2 immunofluorescence results
3 讨论
研究发现,益肾泻浊方可以显著增加CRF小鼠体质量,改善肾脏病理,并能降低BUN、SCr水平而改善其肾功能;同时明显降低小鼠血清炎症水平,有效抑制其肾脏内NKD2的表达,从而减少细胞外基质沉积缓解肾纤维化。
CRF属中医“虚劳”范畴,主要病机为脾肾两虚,浊瘀阻滞。本病常因先天禀赋不足或后天失于调养,导致肾脏精气虚衰,失却主水之能,久之浊毒、瘀血阻滞,而成本病。治疗当以补脾益肾,化瘀泻浊为法。方中黄芪、党参、白术性味甘温,主入脾经以补气健脾;茯苓性平味淡,补脾兼以渗利;菟丝子性味甘平,长于清补肾阴肾阳,以治其本;“久病则入络”,故配伍川芎、丹参、红花、莪术等一众活血之品以化瘀通络,改善肾脏血供;制大黄直达阳明胃腑,功擅通腑泻浊,将积聚于体内的毒素通过肠道排出体外。本方融补脾、益肾、化瘀、泻浊诸法于一炉,因而能取得良好的临床疗效。
本研究中,我们运用CRF小鼠模型验证了该方的有效性。项目组首先以单侧输尿管梗阻法(UUO)成功构建了CRF模型,治疗组予益肾泻浊方灌胃治疗15 d后,小鼠的肾小管损伤评分及肾纤维化区域明显少于模型组,提示其能有效改善CRF小鼠肾脏病理;并且治疗组小鼠的BUN、SCr指标明显降低,证实该方能有效延缓其肾功能恶化。炎症反应贯穿于CRF发病的全过程[16],当肾足细胞受到损伤后,会释放大量细胞因子如IL-6、TNF-α等,促使血液中的白细胞、淋巴细胞等向肾间质、系膜区浸润,并释放一系列炎症介质引起肾纤维化[17]。我们的结果显示,治疗组的小鼠血清IL-6、IL-1β和TNF-α水平显著降低,表明其炎症反应受到有效抑制。
肾纤维化是CRF发病的标志性过程,而ECM在肾间质的沉积则是其主要病理改变。ECM是由多种不溶性大分子按一定比例形成的动态网络结构,主要来源于肌成纤维细胞(特异性分泌α-SMA),包括纤维蛋白和多糖蛋白两大类[18]。纤维蛋白又分为以胶原蛋白(Collagen)为代表的结构蛋白和以纤维连接蛋白(FN)为代表的黏合蛋白[19]。我们的实验发现,治疗组给药15 d后,CRF小鼠肾脏的α-SMA、Collagen α1和FN1沉积显著减少,肾纤维化范围亦明显缩小,进一步证实了益肾泻浊方治疗CRF的疗效。
为进一步探索益肾泻浊方起效的分子机制,我们检测了小鼠肾脏NKD2的蛋白水平及免疫荧光定量。NKD2特异性地表达于小鼠肾脏血小板衍生生长因子受体(PDGFR)所分化的肌成纤维细胞上。在人类肾脏PDGFR β+细胞中,NKD2可用于标记高表达ECM的肌成纤维细胞,为后者的特异性基因。NKD2又可通过调控TGF-β通路影响ECM的产生[20],对人PDGFR β细胞株进行慢病毒转染引起NKD2过表达后,与TGF-β相互作用可以增加ECM分泌,而敲除NKD2基因后,肾纤维化的标志物如Collagen、FN等表达明显受其影响[11]。我们的结果显示,CRF小鼠肾脏的NKD2表达明显增多,而予益肾泻浊方治疗后其水平明显下降,提示该方可能通过抑制NKD2的活性而使ECM生成减少,从而改善肾纤维化。

