氟康唑调控NLRP3炎性小体通路对隐球菌性脑膜炎小鼠脑小胶质细胞激活的影响
付 群,李长新,王 佳,宋 昕
隐球菌性脑膜炎(cryptococcal meningitis)是由严重的真菌感染而引发的疾病,通过血源性扩散从原发性肺病灶扩散至大脑,该疾病常见于细胞介导的免疫功能低下人群,具有极高的发病率和死亡率,因此,α详细了解其治疗药物对该疾病的治疗机制十分必要[1-3]。NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性小体可通过响应微生物感染和细胞损伤,激活含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase-1),并介导促炎细胞因子白介素-1β(interleukin-1β,IL-1β)的分泌,是先天免疫系统的重要组成部分,其异常激活与炎症性疾病密切有关[4]。有研究表明,新生隐球菌可依赖于钾离子外流和吞噬溶酶体膜的渗漏激活炎性小体,而抑制NLRP3炎性小体的激活可有效改善隐球菌性脑膜炎造成的脑损伤[5]。氟康唑(fluconazole)是一种唑类药物,具有有效的抗真菌活性,能够高效率穿过血脑屏障,已被用于治疗隐球菌性脑膜炎[6]。目前,关于氟康唑的研究多与临床相关,而关于其对隐球性菌脑膜炎的治疗机制是否与NLRP3炎性小体有关尚未明确。因此,本研究通过构建隐球菌性脑膜炎小鼠模型,探究氟康唑是否可通过调控NLRP3炎性小体通路影响隐球菌性脑膜炎小鼠脑小胶质细胞的激活。
1 材料与方法
1.1 实验动物 健康的雄性C57BL/6小鼠100只,体质量15~22 g,购自华中科技大学动物实验中心,许可证号:SCXK(鄂)2016—0009,于12 h/12 h正常明暗交替、相对湿度40%~70%的环境中适应性饲养7 d,期间自由采食、饮水。动物实验符合国家伦理准则及实验室动物护理及使用方针,且实验过程中严格进行质量控制。
1.2 细菌培养 于沙保斜面培养基中接种隐球菌菌株后,在35 ℃、5% CO2培养箱培养3 d,生理盐水冲洗后将悬浮液调整为4.8×105cfu/mL。
1.3 主要试剂及仪器 隐球菌菌株购自上海医学真菌实验室;肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)酶联免疫吸附试验(ELISA)检测试剂盒(货号:CSB-EQ023955MO-1、CSB-E04639m-1、E-EL-M0046km)购自上海恒斐生物科技有限公司;氟康唑标准品(纯度:99%,规格:5 g,货号:K0040)购自上海宝曼生物科技有限公司;注射用两性霉素B(规格:每支25 mg,国药准字H13020284)购自华北制药股份有限公司;苏木精-伊红(HE)染色试剂盒(货号:G1120-100)购自北京索莱宝科技有限公司;四甲基偶氮唑蓝(MTT)检测试剂盒、免疫组化试剂盒购自上海嵘崴达实业有限公司(货号:4890-025-K、11719386001);二喹啉甲酸(BCA)蛋白检测试剂盒、免疫荧光试剂盒、DMEM/F12培养基、兔抗鼠离子钙结合衔接分子1(ionized calcium binding adapter molecule 1,Iba1)购自北京百奥莱博科技有限公司(货号:ALH371-QIP、KFS019、SNM544-UEO、K18238-XID);兔抗鼠甘油醛-3-磷酸脱氢酶(GAPDH)、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗抗体均购自亚科因(武汉)生物技术有限公司(货号:A01021、A21020);兔抗鼠Rab5购自上海恒斐生物科技有限公司(货号:Rab5 Antibody);兔抗鼠Caspase-1购自武汉博欧特生物科技有限公司(货号:orb621674);NLRP3购自上海碧云天生物技术有限公司(货号:AF2155);蛋白提取试剂盒购自武汉纯度生物科技有限公司(货号:CD-13559-ML);新型隐球菌购自北京北纳创联生物技术研究院(编号:BNCC225501);蛋白凝胶成像仪购自美国Bio-Rad公司;荧光显微镜购自奥林巴斯。
1.4 方法
1.4.1 动物模型制备及分组给药 将50 g氟康唑溶于500 mL生理盐水中配制成100 mL含0.4 g氟康唑的注射液。将实验小鼠随机分为假手术组(sham组)、隐球菌性脑膜炎模型组(CM组)、两性霉素B组(AmB组)、氟康唑低剂量组(FCZ-L组)、氟康唑高剂量组(FCZ-H组),每组20只[7]。除对照组外其余小鼠用10 mL/kg戊巴比妥钠麻醉、消毒后切开颅顶皮肤暴露颅骨,沿中线后3 mm、侧面1 mm部位注射2 μL隐球菌悬液后缝合(针头插入3 mm,持续10 min)[8];sham组仅穿刺不注射。造模成功后AmB组鞘内注射0.7 mg/kg 两性霉素B,FCZ-L组与FCZ-H组分别注射20 mg/kg、40 mg/kg氟康唑,sham组及CM组注射等量生理盐水,为期2周,记录小鼠死亡情况。
1.4.2 ELISA法检测脑脊液中炎性因子的表达水平 实验结束后随机取5只小鼠暴露寰枕膜,1 mL注射器针尖刺入蛛网膜下隙抽取脑脊液(0.5 mL),根据ELISA检测试剂盒说明书检测TNF-α、IL-6、IL-10表达水平。
1.4.3 HE染色观察脑组织病理学变化 小鼠颈椎脱臼处死后取出脑组织,在4%多聚甲醛固定后用石蜡包埋后切片(4 μm),二甲苯(10 min)脱蜡,依次使用100%、95%、85%、70%的乙醇处理5 min后进行HE染色(苏木精染色5 min,0.5%伊红染色2 min),脱水,封片,显微镜观察。
1.4.4 免疫组化法检测Iba1表达 将石蜡切片脱水后缓冲液冲洗,3% H2O2除去内源性过氧化物酶后(10 min)加100 μL 90%的牛血清清蛋白(孵育20 min),再加入一抗过夜,加二抗30 min、磷酸缓冲盐溶液(PBS)冲洗后加入ABC复合物、二氨基联苯胺(DBA)显色观察5 min(棕色即为阳性),软件Image-Pro Plus对阳性染色光密度均值进行计算。
1.4.5 小胶质细胞分离纯化 另取5只小鼠颈椎脱臼处死后将剥离脑膜的脑组织在胰酶中悬浮消化后吹打均匀移入离心管中,经网筛过滤后分装离心(4 000 r/min离心10 min),去上清,经DMEM/F12培养基重悬后接种于细胞培养瓶中(1×106个/mL),恒温摇床37 ℃、250 r/min连续摇动,所得新细胞悬浮液移入新培养瓶37 ℃、5% CO2培养箱培养1 h,除去未贴壁细胞即为纯化小胶质细胞。
1.4.6 MTT法检测脑小胶质细胞的细胞活力 将纯化后细胞稀释为1×105个/mL接种100 μL于96孔板中培养24 h后,根据试剂盒说明书使用MTT法检测细胞活力,在490 nm处测定吸光度OD值,计算小胶质细胞的细胞存活率:细胞存活率(%)=(OD处理组/OD对照组)×100%。
1.4.7 免疫荧光检测Rab5表达 所得小胶质细胞用PBS(0.01 mol/L)冲洗3次(每次5 min),胰酶消化,DMEM/F12培养基重悬调整至细胞密度4×105个/mL。细胞爬片、4%多聚甲醛固定(15 min)后置于Triton X-100(0.5%)10 min,再放入牛血清清蛋白(2%)1 h,添加一抗(1∶500),过夜,PBS(0.01 mol/L)冲洗,加入二抗(1∶100)2 h,PBS冲洗,荧光显微镜观察并用软件Image-Pro Plus对平均荧光强度进行分析。
1.4.8 蛋白免疫印迹法(Western Blot)检测蛋白表达 用苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)裂解细胞,冰浴30 min后12 000 r/min离心10 min获取上清液,用BCA试剂盒检测总蛋白含量。加入蛋白进行10%聚丙烯酰胺凝胶(SDS-PAGE)电泳后低温转膜,脱脂奶粉(5%)进行1 h封闭,洗膜3次,加入GAPDH、Caspase-1、NLRP3(1∶1 000)一抗后4 ℃孵育过夜,再加入二抗(1∶5 000)孵育2 h,蛋白凝胶成像仪进行Caspase-1、NLRP3定量分析。
2 结 果
2.1 各组小鼠死亡率比较 2周后,sham组、CM组、AmB组、FCZ-L组、FCZ-H组小鼠死亡率分别为5%、35%、5%、10%、5%。与sham组比较,CM组小鼠死亡率升高(P<0.05);与CM组比较,AmB组、FCZ-L组、FCZ-H组小鼠死亡率明显降低(P<0.05)。详见图1。

CM组与sham组比较,*P<0.05;与CM组比较,#P<0.05。
2.2 各组小鼠脑脊液中TNF-α、IL-6和IL-10水平比较 与sham组比较,CM组TNF-α、IL-6水平明显增加(P<0.05),而IL-10水平明显降低(P<0.05);与CM组比较,AmB组、FCZ-L组、FCZ-H组TNF-α、IL-6水平明显降低(P<0.05),而IL-10水平明显增加(P<0.05)。详见表1。

表1 各组小鼠脑脊液中TNF-α、IL-6和IL-10水平比较 单位:pg/mL
2.3 各组小鼠脑组织病理学检测结果 sham组脑组织正常,未见炎症症状及坏死现象;CM组脑组织中炎症细胞大量渗出,出现血管充血、坏死灶及隐球菌生物;与CM组比较,AmB组、FCZ-L组、FCZ-H组小鼠脑组织中炎症细胞、坏死灶及隐球菌生物明显减少。详见图2。
2.4 各组小鼠脑小胶质细胞活化标志物Iba1表达比较 在细胞核与细胞质中均存在Iba1阳性表达,与sham组比较,CM组小胶质细胞活化标志物Iba1阳性表达明显增加(P<0.05);与CM组比较,AmB组、FCZ-L组、FCZ-H组Iba1阳性表达明显降低(P<0.05)。详见图3及表2。

表2 各组脑小胶质细胞活化标志物Iba1表达比较 单位:%

图3 免疫组化检测各组小鼠脑小胶质细胞活化标志物Iba1表达(×400)
2.5 各组小鼠脑小胶质细胞存活率比较 与sham组比较,CM组小胶质细胞存活率明显增加(P<0.05);与CM组比较,AmB组、FCZ-L组、FCZ-H组细胞存活率明显降低(P<0.05)。详见表3。

表3 各组小鼠脑小胶质细胞存活率比较 单位:%
2.6 各组小鼠脑小胶质细胞吞噬标志物Rab5表达比较 免疫荧光检测结果发现,与sham组比较,CM组Rab5阳性表达明显降低(P<0.05);与CM组比较,AmB组、FCZ-L组、FCZ-H组Rab5阳性表达明显增加(P<0.05)。详见图4及表4。

表4 各组Rab5阳性表达率比较 单位:%
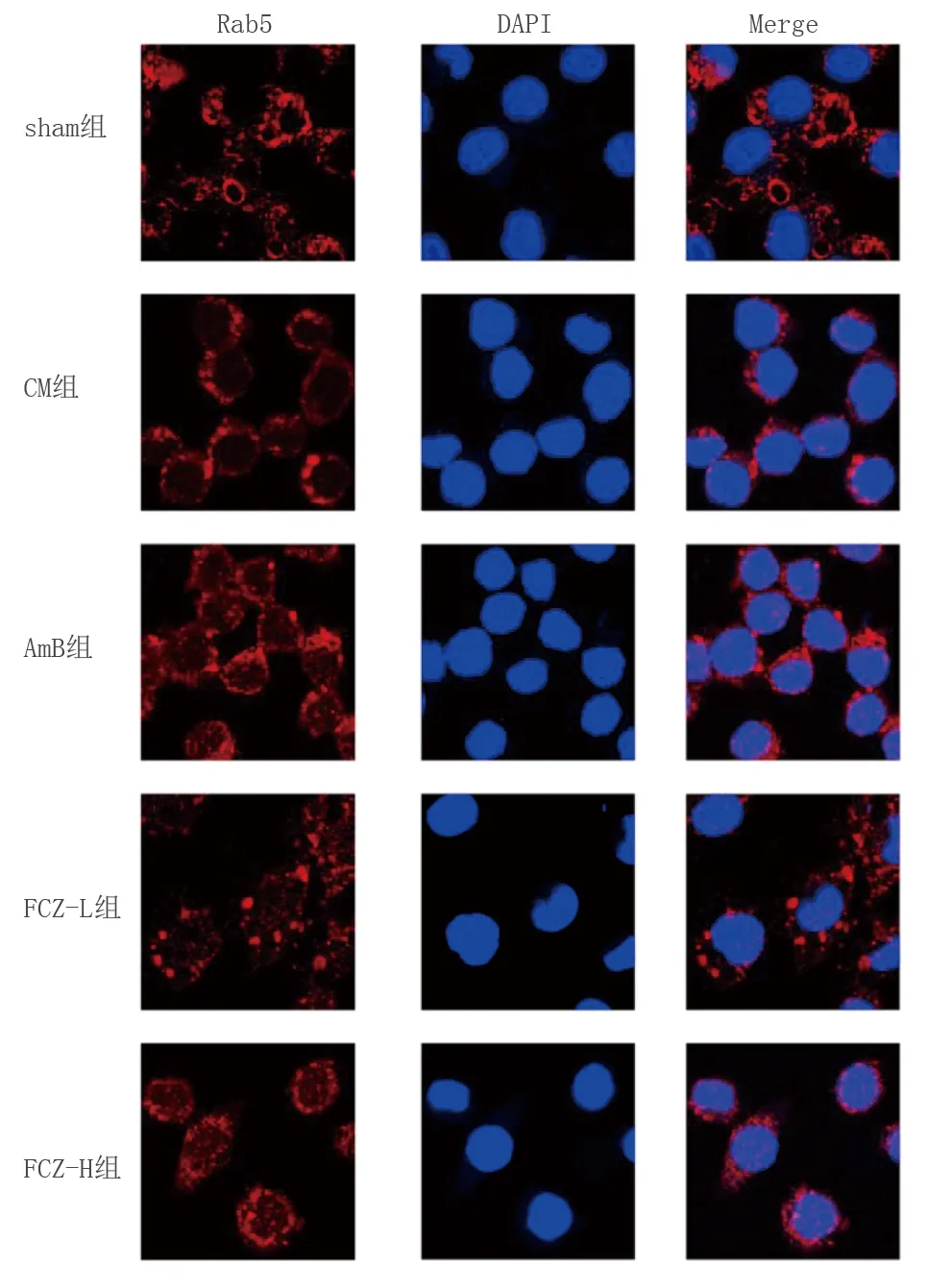
图4 免疫荧光检测各组脑小胶质细胞吞噬标志物Rab5表达(×400)
2.7 各组NLRP3炎性小体通路相关蛋白表达比较 与sham组比较,CM组小胶质细胞内NLRP3炎性小体通路相关蛋白Caspase-1、NLRP3表达明显增加(P<0.05);与CM组比较,AmB组、FCZ-L组、FCZ-H组Caspase-1、NLRP3表达明显降低(P<0.05)。详见表5及图5。

表5 各组NLRP3炎性小体通路相关蛋白表达比较

图5 各组NLRP3炎性小体通路相关蛋白表达条带图
3 讨 论
隐球菌性脑膜炎是慢性中枢神经系统感染的常见原因之一,具有极高的致死性,1年内的死亡率为70%,而在全球范围内占艾滋病相关死亡的15%[9-10]。临床上隐球菌性脑膜炎的治疗方法是使用药物抑制隐球菌从而达到治疗目的。
氟康唑由于能够高效率穿过血脑屏障起到抗真菌作用,在体内和体外均能够有效抑制隐球菌,因此已被用于治疗隐球菌性脑膜炎[11-12]。两性霉素B同样在隐球菌性脑膜炎治疗中具有抗菌作用,研究表明两性霉素B与氟康唑联合使用能有效减少病人脑脊液中隐球菌数量以及炎症反应的发生,改善病人预后情况[13]。中枢神经系统中最为重要的免疫细胞是小胶质细胞,其在机体损伤时会由静止状态转变为激活状态,聚集到损伤部位引起炎症反应,因此,可作为大脑的监测器[8]。Iba1作为小胶质细胞的标志物,在小胶质细胞活化后其表达明显增加[14-15]。Rab5作为小胶质细胞/巨噬细胞吞噬的标志物,是Ras家族成员之一,位于早期内体并在早期内体和胞吞泡融合过程中起重要调控作用[8]。隐球菌可导致早期吞噬体标志物Rab5的过早清除,从而降低Rab5表达水平[16]。隐球菌性脑膜炎小鼠模型中小胶质细胞处于激活状态,Iba1表达水平明显增加,而Rab5表达水平则明显降低[17]。两性霉素B能通过抑制核因子κB(nuclear factor kappa-B,NF-κB)通路的激活来抑制脑组织损伤,从而对隐球菌性脑膜炎起到治疗作用[8]。本研究结果发现,氟康唑能够明显降低隐球菌性脑膜炎小鼠死亡率、细胞存活率、脑组织损伤程度、Iba1表达,增加Rab5阳性表达,表明氟康唑能够有效抑制隐球菌性脑膜炎小鼠小胶质细胞活化,以此缓解脑组织损伤,从而在隐球菌性脑膜炎中具有有效治疗作用。
炎性小体的激活是一个重要的炎症途径,炎性小体可表达于中枢神经系统中的小胶质细胞,参与中枢神经系统的炎症反应,而NLRP3炎性小体在中枢神经系统中分布最广,可经由微生物感染及细胞损伤活化,并通过剪切激活Caspase-1,从而介导促炎细胞因子的分泌,是宿主针对真菌、病毒、细菌感染的免疫防御的关键所在,NLRP3炎性小体的异常激活可导致炎症性疾病的发生[4,18-19]。TNF-α、IL-6是免疫系统中典型的促炎因子,而IL-10是抗炎细胞因子,三者对炎症反应的发生起重要调节作用。有研究表明,在脑膜炎大鼠小胶质细胞中NLRP3、Caspase-1表达水平明显增加[20]。而本研究发现,氟康唑可明显降低隐球菌性脑膜炎小鼠脑脊液中TNF-α、IL-6水平及小胶质细胞中Caspase-1、NLRP3表达,增加脑脊液中IL-10水平。表明氟康唑可有效抑制隐球菌性脑膜炎小鼠脑小胶质细胞中NLRP3炎性小体通路的激活,从而抑制炎症反应的过度激活,提示氟康唑抑制隐球菌性脑膜炎小鼠脑小胶质细胞的活化可能与该通路有关。
综上所述,氟康唑对隐球菌性脑膜炎的治疗可能与其抑制NLRP3炎性小体通路的激活来抑制小胶质细胞活化有关,本研究对氟康唑在隐球菌性脑膜炎中的治疗机制的研究具有重要参考价值,但关于氟康唑在隐球菌性脑膜炎治疗过程中的最佳剂量还需进一步研究。

