人参皂苷Rg1对高糖受损内皮祖细胞生物学功能和分泌血管生成相关生长因子的影响
蔡 婷,梁文菲,李莹莹,肖 慧,杨千培,胡爱琳,柳 维,熊 武
糖尿病是一种由多种病因引起持续慢性高血糖的代谢性疾病,其血管病变与高糖导致的内皮细胞过早衰老和/或内皮祖细胞(endothelial progenitors cells,EPCs)功能失调有关。EPCs是一种骨髓来源的血管干细胞,能分化成内皮细胞,具有修复内皮和促进血管生成的作用[1]。持续高血糖会导致机体EPCs数量减少,同时造成血管生成功能受损,从而推动糖尿病血管并发症的发生发展[2]。据此,恢复体内EPCs的数量和功能,促进损伤内皮细胞的修复和血管新生,是防治糖尿病血管并发症的关键。人参皂苷Rg1是中药人参的主要生物活性成分,有研究表明,人参皂苷Rg1能通过减轻胰岛素抵抗发挥降血糖的作用,可以用于缓解糖尿病及其血管并发症。目前研究证实人参皂苷Rg1能通过促进EPCs增殖发挥促进血管再生的作用[3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)[4-5]、基质细胞衍生因子-1α(stromal derived factor-1α,SDF-1α)[6]、血管生成素-1(angiopoietin-1,Ang-1)[7]、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)[8-9]是与血管生成相关的生长因子。然而人参皂苷Rg1对高糖诱导损伤的EPCs生物学功能修复及对分泌VEGF、SDF-1α、Ang-1、MMP-2的影响鲜有报道。故本研究将通过分离人EPCs,探讨人参皂苷Rg1干预下对高糖诱导损伤EPCs生物学功能及分泌VEGF、SDF-1α、Ang-1、MMP-2的影响。
1 材料与方法
1.1 药物与试剂 人参皂苷Rg1(纯度≥98%,上海源叶生物科技有限公司,货号:B21057);EGMTM-2MV培养基(美国Lonza公司,货号:CC-3162);青霉素-链霉素双抗溶液(南京凯基生物科技有限公司,货号:KGY002);DMEM/F12培养基、磷酸缓冲盐溶液(PBS)缓冲液(美国Hyclone公司,货号:SH30023.01B、SH30256.01B);胎牛血清(美国GIBCO公司,货号:10270-106);胰酶(美国GIBCO公司,货号:15050-057);乙酰化低密度脂蛋白(Dil-Ac-LDL)购自北京博蕾德生物科技有限公司(浓度:10 mg/L);荆豆凝集素(FITC-UEA-I)购自美国Sigma公司(货号:L-9006);Anti-CD31抗体、山羊抗兔IgG(FITC)(英国Abcam公司,货号:ab28364、ab6717);细胞计数试剂盒(cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司(货号:C0037);Matrigel基质凝胶(美国Becton Dickson公司);VEGF、SDF-1α、Ang-1、MMP-2的酶联免疫吸附试验(ELISA)试剂盒购自上海江莱生物科技有限公司(货号:JL18341、JL13740、JL10166、JL13552)。
1.2 仪器与器材 超净工作台(苏州净化设备有限公司,型号:SW-CJ-1FD);荧光显微镜[同舟同德(北京)仪器仪表有限公司,型号:Olympus-BX51];二氧化碳(CO2)细胞培养箱(日本SANYO公司,型号:XD-101);96孔板(美国Corning公司,型号:3590);酶联免疫检测仪(美国Thermo Fisher公司,型号:5111918);生物倒置显微镜(日本OLYMPUS公司,型号:BX51);台式低速离心机、4 ℃离心机(德国Eppendorf公司,型号:5804、5415R);振荡器(上海沪西分析仪器厂,型号:WH-2)。
1.3 实验方法
1.3.1 EPCs的分离培养与鉴定 取得足月健康新生儿的脐带血(在获得产妇及其家属同意并签署知情同意书的情况下进行标本采集,已获得本院伦理委员会批准,批准文号:HN-LL-KY-2020-013-01),经密度梯度离心后获得单个核细胞,在EGMTM-2MV培养基中进行计数。调整细胞浓度后将细胞悬液接种于预先包被纤维连接蛋白的6孔板中,置于37 ℃、5%CO2培养箱中培养。待细胞融合率达到90%后,采用胰酶消化按1∶3进行传代。
参考胰酶消化法、免疫磁珠分选法[10]、FITC-UEA-I和Dil-Ac-LDL双荧光染色法[11-12],推测能够同时摄取Dil-Ac-LDL与结合FITC-UEA-I的细胞则被认为是正在分化的EPCs,与EPCs的生长形态相符,并具备EPCs的表面标志和功能特征。因此,本研究基于EPCs能够同时摄取Dil-Ac-LDL并结合FITC-UEA-I则被认为是正在分化的EPCs的原理,以及参考CD31作为EPCs的主要表面标志物也在鉴定中作为参考指标。采用CD31免疫磁珠分选法、FITC-UEA-1联合Dil-Ac-LDL双荧光染色法共同鉴定EPCs。
1.3.2 EPCs分组及处理 使用含30 mmol/L浓度葡萄糖的培养基培养5 d来制备高糖受损EPCs模型。将高糖受损EPCs随机分为实验组、模型组,实验组用最佳质量浓度的人参皂苷Rg1处理,模型组用等体积的PBS处理模型组。正常组EPCs用普通培养基培养5 d后再用等体积PBS处理。
1.3.3 人参皂苷Rg1对高糖受损EPCs生物学功能的影响
1.3.3.1 人参皂苷Rg1处理高糖受损EPCs最佳浓度的选择 于96孔板中接种增殖活跃的EPCs,分别使用0 mg/L、5 mg/L、10 mg/L、20 mg/L、40 mg/L、80 mg/L的人参皂苷Rg1进行干预。用胰蛋白酶消化贴壁EPCs,使其脱落,对细胞悬液进行计数后,将EPCs铺在24孔板上,置于37 ℃,5%CO2孵育箱中培养9 h后,将EPCs接种在大鼠纤维连接蛋白包被的培养板中,37 ℃培养30 min,用随机200倍视野对贴壁EPCs进行计数,四甲基偶氮唑蓝(MTT)法检测EPCs存活率,以确定人参皂苷Rg1促进EPCs增殖的最佳浓度。
1.3.3.2 增殖能力检测 取对数生长期EPCs,胰酶消化,离心,计数,并调整细胞悬液浓度。将EPCs按照每孔1×105个细胞分于96孔板中,置于37 ℃、5%CO2培养箱中培养24 h。待细胞贴壁生长后,收集指数生长期EPCs,于96孔板中配制100 μL的细胞悬液,并将培养板置于37 ℃、5% CO2的培养箱中预培养24 h。实验组使用最佳浓度人参皂苷Rg1进行干预,模型组和正常组加入等体积PBS,并向每孔中加入CCK-8溶液10 μL,孵育4 h后,使用酶标仪测定各组在450 nm处的吸光度(OD)。
1.3.3.3 黏附能力检测 取贴壁细胞用胰蛋白酶消化,将处理后的细胞离心重悬,将制成的悬液置于500 μL培养液中并计数。取EPCs平铺于24孔板中,置于37 ℃、5%CO2的恒温箱中孵育1 h,实验组用40 mg/L人参皂苷Rg1干预,模型组和正常组用等体积PBS干预,各培养8 h后,将接种了干预后EPCs的大鼠纤维连接蛋白培养板放在37 ℃环境中培养30 min,在显微镜下用200倍视野随机观察、计数。
1.3.3.4 成血管能力检测 将Matrigel基质胶过夜溶解,次日用M200无血清及生长因子补充物的培养基1∶1稀释Matrigel基质胶并加入12孔板中,在37 ℃孵箱中放置30 min。将增殖期的EPCs用胰酶处理后,重悬离心并调整重悬液密度,将重悬液转入12孔板中培养,取贴壁细胞,实验组用40 mg/L人参皂苷Rg1干预,模型组和正常组采用等体积PBS干预,然后置于37 ℃培养箱中培育24 h,在显微镜下随机选取4个视野观察、拍照,计算小管形成长度并取平均值。
1.3.3.5 迁移能力检测 用黑色马克笔在6孔板背后用横划线进行标记,横穿过每个孔,每孔间隔1 cm之间划一横、两竖线,保证每个孔上至少有5条线通过。在每个孔中分别加入约5×105个处于增殖生长期的EPCs,用无菌200 μL枪头在预移植培养1 d后的培养细胞孔底部孔板中央分别划一横、两竖线痕迹,用PBS液体洗去底部脱落的EPCs。在37 ℃、5%CO2培养箱中预培养分别含有40 mg/L人参皂苷Rg1和PBS液体处理过的两种无血清M199完全培养基。在倒置显微镜(×200)下摄像,记为0时,利用显微标尺选择两个不同视野,分别测量0 h、48 h的划痕创伤面积和边距,以迁移宽度表示细胞迁移能力。
1.3.3.6 血管生成相关生长因子检测 实验组采用40 mg/L的人参皂苷Rg1干预48 h,模型组、正常组均采用相等含量PBS上清液进行干预48 h。将抗体细胞液和上清液先后进行二次收集,再先后加入标准稀释液、缓冲液,进行抗体稀释并综合检测各种抗体后进行振荡,室温培养1.5 h,将磷酸辣根酶和过氧化物水解酶合成标记后的链霉亲和素抗体进行稀释,振荡后在室温培养条件下进行培养30 min,最后加入细胞终止液和显色底物硼酸三甲酯(TMB),在15 min之内,使用酶标仪测定各组上清液中VEGF、SDF-1α、Ang-1、MMP-2在450 nm处的OD值。根据标准物的浓度与OD值计算出标准曲线的回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度(pg/mL)。

2 结 果
2.1 EPCs的分离和培养 EPCs培养7 d后,细胞呈集落分布的鹅卵石样。详见图1。
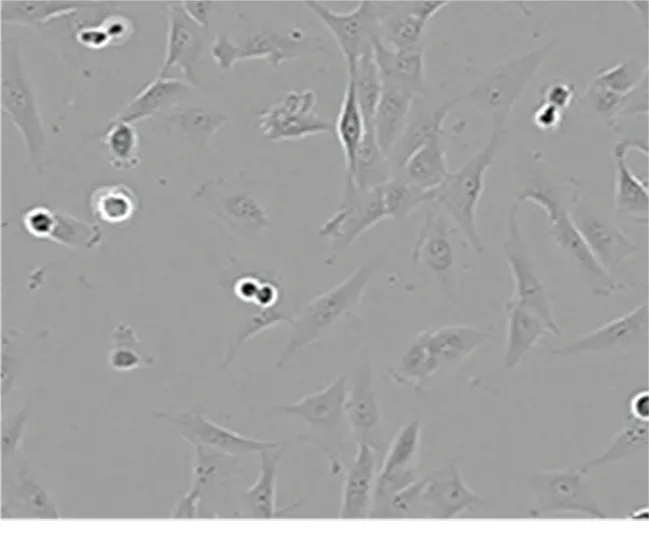
图1 EPCs培养第7天形态图(×200)
2.2 EPCs的鉴定 EPCs被CD31免疫荧光抗体标记后细胞膜呈绿色,EPCs摄取DAPI后细胞核呈蓝色改变,融合图像显示EPCs细胞膜呈绿色荧光改变,细胞核呈蓝色荧光改变(见图2)。EPCs结合FITC-UEA-I呈绿色荧光标记改变,EPCs摄取Dil-Ac-LDL呈红色荧光标记改变,双荧光染色后呈橙黄色改变(见图3)。
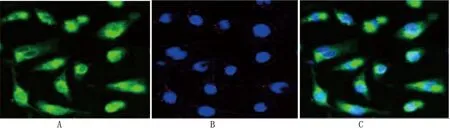
图2 CD31抗体联合DAPI核染鉴定结果(荧光镜,×400)

图3 荧光染色鉴定结果(荧光镜,×400)
2.3 人参皂苷Rg1对高糖诱导损伤EPCs增殖的影响 随着人参皂苷Rg1浓度的增加,EPCs细胞增殖活力逐渐增高。当人参皂苷Rg1浓度为40 mg/L时,EPCs细胞增殖活力最高,而在80 mg/L后,随着人参皂苷Rg1浓度的逐渐增高,EPCs细胞增殖活力随之降低(见图4),基于此,本实验选择促进EPCs增殖的最佳质量浓度40 mg/L人参皂苷Rg1进行后续实验。
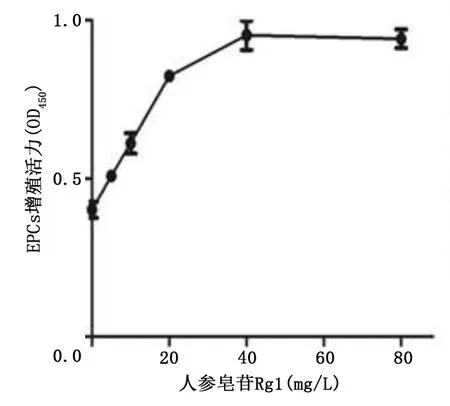
图4 不同浓度人参皂苷Rg1对高糖诱导损伤EPCs增殖活力的影响
2.4 人参皂苷Rg1对高糖诱导损伤EPCs增殖、黏附、成管及迁移能力的影响 与正常组相比,模型组中高糖诱导损伤EPCs增殖能力、黏附能力、成管能力明显减弱,差异均有统计学意义(P<0.01);与模型组相比,实验组在40 mg/L人参皂苷Rg1干预后,其增殖、黏附、成管、迁移的功能明显增强,差异均有统计学意义(P<0.01)。详见图5~图7和表1。

表1 人参皂苷Rg1对高糖环境下EPCs生物学功能的影响

图5 人参皂苷Rg1对高糖受损的EPCs黏附生物学功能的影响(×200)
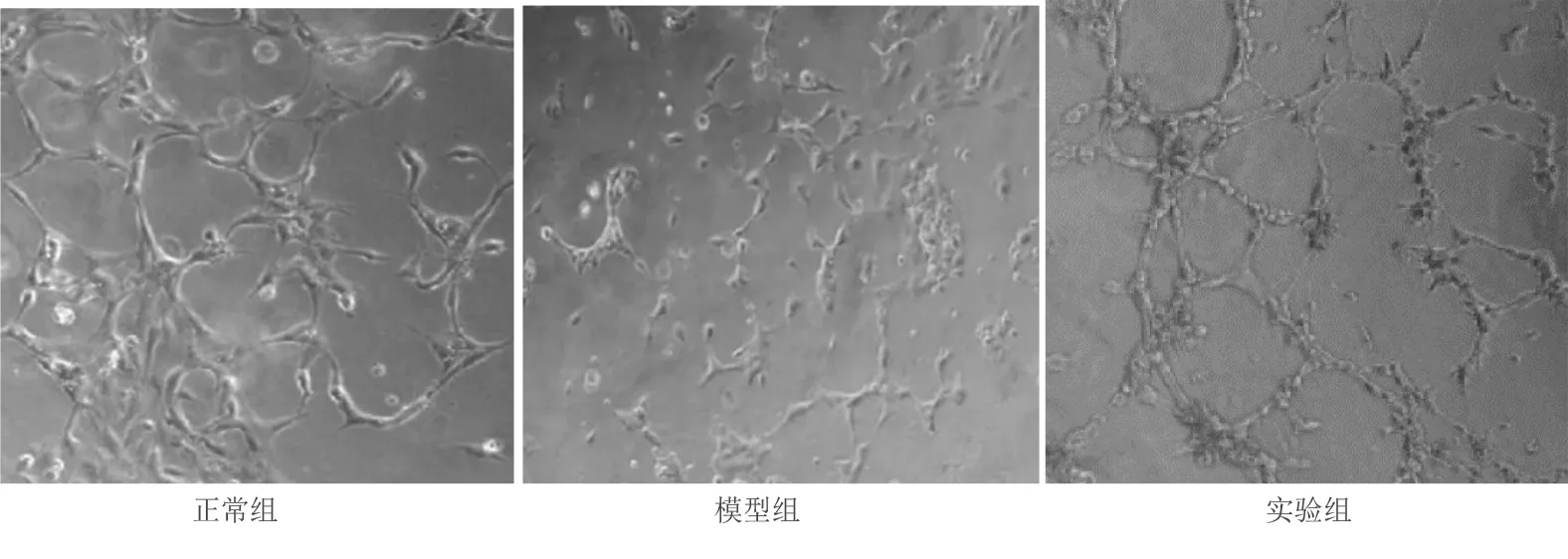
图6 人参皂苷Rg1对高糖受损的EPCs成管生物学功能的影响(×200)
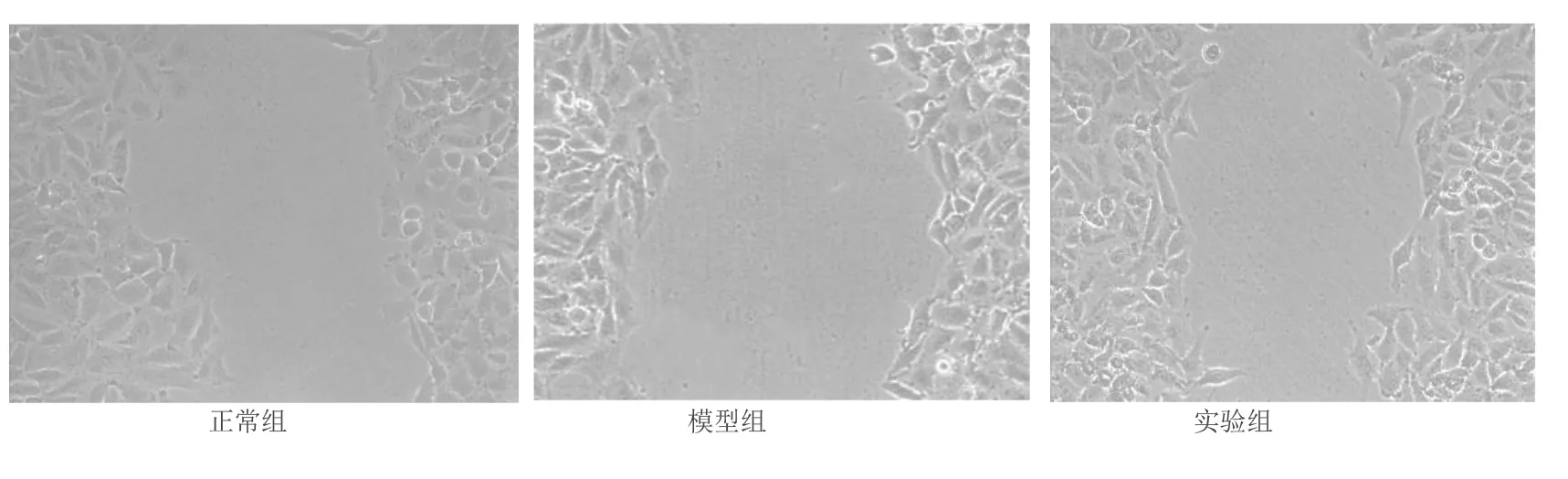
图7 人参皂苷Rg1对高糖受损的EPCs迁移的影响(×200)
2.5 人参皂苷Rg1对高糖环境下EPCs分泌血管生成相关生长因子的影响 与正常组比较,模型组EPCs分泌VEGF、SDF-1α、Ang-1明显减少,而MMP-2的分泌增加,差异均有统计学意义(P<0.05);与模型组相比,实验组在40 mg/L人参皂苷Rg1干预后,EPCs分泌VEGF、SDF-1α、Ang-1明显增加,而MMP-2的分泌减少,差异均有统计学意义(P<0.05)。详见表2。

表2 人参皂苷Rg1对高糖环境下EPCs分泌血管生成相关生长因子的影响 单位:pg/mL
3 讨 论
糖尿病是一种具有长期持续血糖升高特征的多病因代谢紊乱性疾病,严重影响着人类的健康。糖尿病的高血糖状态将直接导致内皮细胞功能障碍并影响缺血组织血管新生,出现各种与血管新生相关的并发症[13]。而EPCs是一种能够分化为成熟内皮细胞的专能干细胞,在缺血等造成血管损伤的环境中,EPCs从骨髓迁移到缺血部位,合并到新形成的毛细血管中,并刺激代偿性血管生成[14]。EPCs移植已经成为治疗缺血性疾病的一种实验性疗法。目前研究表明,EPCs在血管生成和维持血管内稳态中起重要作用[14-15]。然而糖尿病所致的高糖环境将直接导致循环EPCs减少和功能受损[16]。糖尿病状态下的高血糖主要通过诱导细胞内活性氧积累,从而减少EPCs数量,损害EPCs功能,而降低细胞内活性氧水平可能成为恢复糖尿病EPCs功能的有效途径。糖尿病病人即使血糖水平得到控制且平稳后,体内EPCs数量减少和功能受损仍然持续存在,这为临床上糖尿病血管并发症的防治带来了挑战。
人参皂苷Rg1作为中药人参的主要活性成分之一,可通过抑制凋亡相关蛋白[17]、下调炎症介质[18]和抗氧化等多种机制发挥降血糖及减轻胰岛素抵抗作用,因此,人参皂苷Rg1可以用于缓解糖尿病及治疗糖尿病血管相关并发症。另有研究证实人参皂苷Rg1可促进EPCs增殖和血管生成,从而促进糖尿病大鼠足溃疡愈合[19-20]。与本研究发现的人参皂苷Rg1能改善高糖受损EPCs的生物学功能相吻合。人参皂苷Rg1可明显提高高糖诱导损伤EPCs的迁移、成管、增殖及黏附功能,提示人参皂苷Rg1可以明显改善高糖诱导损伤EPCs的生物学功能障碍。蒋文捷等[3]的研究发现,人参皂苷Rg1能保护过氧化氢诱导损伤的大鼠骨髓来源的EPCs,其机制可能与蛋白激酶B(Akt)介导的信号通路发挥抗氧化应激作用相关。由此,人参皂苷Rg1发挥保护内皮生物学功能的作用可能与抑制其氧化应激相关。
VEGF是一种促血管内皮细胞生长的细胞因子,具有高度特异性。王丽萍等[4]研究证实,高糖作用下人EPCs的活力明显下降及VEGF表达量明显减少。魏英等[5]研究发现,人参总皂苷有促进血管新生从而改善急性心肌梗死大鼠心功能的作用,其机制可能与上调心肌组织VEGF基因表达密切相关。SDF-1α是属于趋化因子蛋白家族的小分子的细胞因子,能够促进EPCs迁移从而促进体内EPCs介导血管生成[6]。Ang-1作为一种具有强大血管生成活性的碱性蛋白质,主要存在于正常血浆及实体瘤组织。方涛等[7]研究证实负载Ang-1的纳米微粒心肌局部注射可使心肌梗死区域血管增生。MMP-2是一种分泌到细胞外基质的明胶酶,在糖尿病视网膜病变早期,即新生血管发生之前,能促使视网膜毛细血管内皮细胞凋亡[8-9]。可见促进EPCs分泌VEGF、SDF-1α、Ang-1,抑制EPCs分泌MMP-2,可成为促进血管新生、抑制高糖环境所致慢性难愈性创面愈合的有效治疗方式之一。本研究发现,高糖环境下EPCs中VEGF、SDF-1α、Ang-1的表达水平明显下降,MMP-2的表达水平升高,而予以人参皂苷Rg1干预后能明显提高高糖受损EPCs关于VEGF、SDF-1α、Ang-1的表达,降低MMP-2的表达,提示人参皂苷Rg1可通过调节VEGF、SDF-1α、Ang-1、MMP-2的表达改善高糖受损EPCs生物学功能。然而本实验仅是离体细胞实验,未模拟体内具体环境,仍然存在一定的局限性,人参皂苷Rg1改善高糖受损EPCs生物学功能和调节VEGF、SDF-1α、Ang-1、MMP-2分泌的具体机制有待在体内外水平进一步探索。

