2005—2021 中药有效成分新药注册申请的回顾性分析与研发策略探讨
周 刚,周跃华*,韩 宁,李天泉
1. 国家药品监督管理局 药品审评中心,北京 100022
2. 国家知识产权局,北京 100088
3. 重庆康洲大数据有限公司,重庆 401336
中药有效成分新药(new Chinese herbal active ingredient drugs,NCHAIDs)在原《药品注册管理办法》(2002、2005、2007 年)中是中药注册分类的一个单独类别。2020 年,国家市场监管总局颁布的新《药品注册管理办法》(国家市场监督管理总局令第27 号)将中药注册分类调整为中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药4 类[1]。同年国家药品监督管理局发布《中药注册分类及申报资料要求》,将中药有效成分及其制剂归入中药创新药1.2 类“从单一植物、动物、矿物中提取得到的提取物及其制剂”,不再将有效成分及其制剂单独作为一类[2]。NCHAIDs 有着不同于中药复方新药的特点,是最容易讲清楚、说明白中药作用机制和走向世界的中药创新药。本文通过对2005—2021 年NCHAIDs 的注册申请及审评情况进行系统的回顾分析,并就其研发策略进行探讨,供同行参考。
1 数据来源与方法
1.1 数据来源
NCHAIDs 相关信息源自国家药品监督管理局药品审评中心网站的公开信息、国家知识产权局中国专利全文库(China Patent Full-Text Database,CNTXT)、药智网和米内网等商业数据库。
1.2 数据范围及数据处理
本文以同时符合以下条件的中药新药为分析对象:(1)2005 年5 月1 日—2021 年12 月30 日受理;(2)审评已完成,有明确审评结论;(3)境内申请人提出的新药临床试验申请(investigational new drug,IND)及新药上市申请(new drug application,NDA);(4)注册分类为中药1 类新药(2020 年7 月1 日前受理并进入药审中心),或中药创新药1.2 类(2020 年7 月1 日—2021 年12 月31日受理),即新的中药有效成分及其制剂;(5)相同结构中药有效成分及其制剂由不同申请人背对背研究后各自分别申请的,分别按不同品种计算;(6)同一品种同时申请多个规格的,按1 个品种计。采用Excel 2016 进行统计。
2 数据统计结果
2.1 申请人地区分布
NCHAIDs 申请人(药品上市许可人)所在地区的申请品种数如下:江苏省9 个、解放军总后勤部卫生部7 个、北京市7 个、上海市4 个、云南省3个、山东省3 个、四川省和贵州省各2 个以及浙江省、广东省、重庆市、安徽省、河北省、吉林省、青海省各1 个(合计44 个)。
2.2 剂型分布
2005—2021 年IND 中药有效成分制剂的剂型分布如下:注射剂18 个(批准8 个)、胶囊剂10 个(批准6 个)、片剂9 个(批准4 个)、滴丸剂2 个(批准1 个),合计39 个。IND 中药有效成分制剂涉及的剂型较为集中,注射剂占比最高。18 个注射剂中有12 个为2008 年以前申请IND 的品种。国家食品药品监督管理局颁布《中药、天然药物注射剂基本技术要求》(国食药监注 [2007] 743 号)后,再次对注射给药途径的合理性提出明确要求,此后,中药注射剂的申请数量明显减少[3]。此外,5 个NDA的NCHAIDs 中4 个为注射剂,未获准上市生产,另一个胶囊剂获得上市许可。
2.3 功能主治及适应证分布
2005—2021 年受理且已审结的44 个中药有效成分制剂(包括IND 和NDA)申请的功能主治(同时涉及多个适应证的,按主要适应证计)相对集中在精神神经、肿瘤、心血管疾病,分别为14、9、8个,3 者合计占比约70%。申请NDA 的5 个NCHAIDs 中,3 个用于脑梗死、1 个用于冠心病心绞痛、1 个用于肿瘤。
申请IND 的39 个NCHAIDs 中,肿瘤8 个,冠心病心绞痛7 个,中风、脑梗死6 个,肺炎、流感发热3 个,血管性痴呆3 个,糖尿病2 个,急性肾衰2 个,乙肝急性发作1 个,其他适应证(包括创伤性休克、肺纤维化、高尿酸血症、绝经后骨质疏松、类风湿性关节炎、抑郁症等)7 个。获准进行临床试验的19 个品种中,肿瘤3 个、冠心病心绞痛4 个,中风、脑梗死3 个,肺炎、流感发热2 个,血管性痴呆2 个,糖尿病12 个,乙肝急性发作1个,其他适应证3 个。
本文对39 个IND 的NCHAIDs 功能主治与所用药材(以提取物为原料的,按制备提取物所用药材计)的功能主治进行比较,按照二者的相关程度分为密切相关、一般相关、不相关3 类。密切相关:新药制剂的功能主治与药材功能主治存在相同表述;一般相关:制剂功能主治与药材功能主治表述相似,根据中医药理论推测有相关性;不相关:制剂功能主治与药材功能主治无相似表述,二者无相关性。从表1 可知,IND 的NCHAIDs 中,功能主治与药材的相关性越高,其批准率越高。

表1 2005—2021 年IND 的NCHAIDs 的批准率与药材功能主治间的相关性Table 1 Correlation between approval rate of IND of NCHAIDs from 2005 to 2021 and functions of traditional Chinese medicine
2.4 有效成分用药材情况
2005—2021 年申请IND 及NDA 的44 个NCHAIDs 共涉及药材30 种(以提取物为原料的,按制备提取物所用药材计)。其中,大多为有效成分明确的常用中药,出现频率较高的药材有丹参、黄芪、银杏叶、人参、连翘等。NCHAIDs 涉及的30 种药材中,能实现规模化种植的有18 种。其他为未能实现规模化种植的野生药材。其中,列入《国家重点保护野生植物名录》的有3 种。考虑到NCHAIDs 的生产需要消耗大量药材资源,应开展野生药材资源评估工作,关注濒危药材及野生药材的资源可持续利用问题。NCHAIDs 原则上不应以国家重点保护野生动植物为原料,上市生产应以人工栽培药材入药。
2.5 有效成分的结构类型
44 个NCHAIDs(IND 及NDA)涉及36 种不同的化合物结构,具体见表2。表2 中其他结构类型包括生物碱、联苄、酚苷等。此外,NDA 有皂苷、黄酮各2 个、内酯1 个。
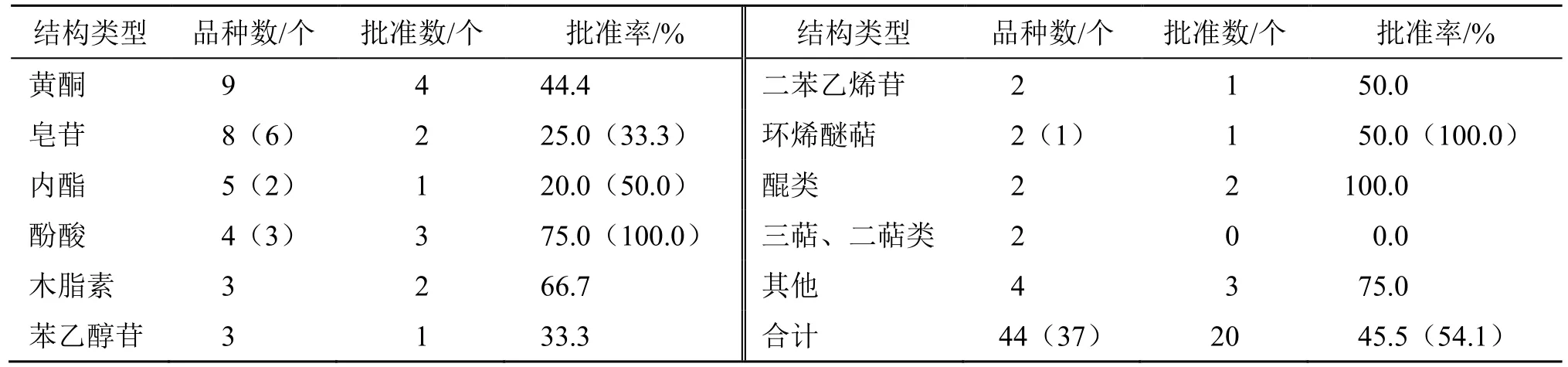
表2 2005—2021 年中药NCHAIDs 的结构类型及批准情况Table 2 Structure types and approval of NCHAIDs from 2005 to 2021
2.6 生物利用度
生物利用度是NCHAIDs 给药途径和剂型选择的重要依据。21 个制备成口服固体制剂的NCHAIDs中,除4 个未能获得公开数据外,其余17 个有效成分口服固体制剂的生物利用度见表3(大鼠、犬的生物利用度不同时,按生物利用度高的数据计)。其中,生物利用度小于1%获批IND 的新药结构为苯乙醇苷类;生物利用度为1%~20%的2 个获批新药中,分别为皂苷和醌类成分(生物利用度为9.7%)。苷类成分原型的吸收利用往往较差,而代谢产物相对较好。如某黄酮苷类NCHAIDs 原型成分的生物利用度小于1%,但加上代谢产物后的生物利用度提高为28%。除未考察代谢产物的苷类成分外,生物利用度相对较高的品种与生物利用度较低的品种相比,批准率有增加的趋势。

表3 2005—2021 年申请IND 中药NCHAIDs 口服固体制剂的生物利用度情况Table 3 Bioavailability of oral solid preparations of IND of NCHAIDs from 2005 to 2021
此外,部分有效成分制剂的生物利用度在2 种动物(大鼠、犬或猴)间,或不同性别动物间的差异较大。如某生物碱的生物利用度为犬6.8%、大鼠57.0%。某萜类成分的生物利用度为雌性大鼠30%、雄性大鼠小于2%。提示某些有效成分的吸收利用存在明显的种属或性别差异。这些品种及生物利用度较低的品种如获准开展临床试验,应结合动物药动学研究结果有针对性地加强人体药动学研究。
2.7 日用剂量分布
44 个NCHAIDs 中,有42 个根据前期研究初步提出了临床拟用剂量,见表4。从有效成分的日用剂量与给药途径的关联看,有效成分口服给药的日用剂量较大,注射给药的日用剂量相对较低。日用剂量超过500 mg 的品种均为口服制剂。
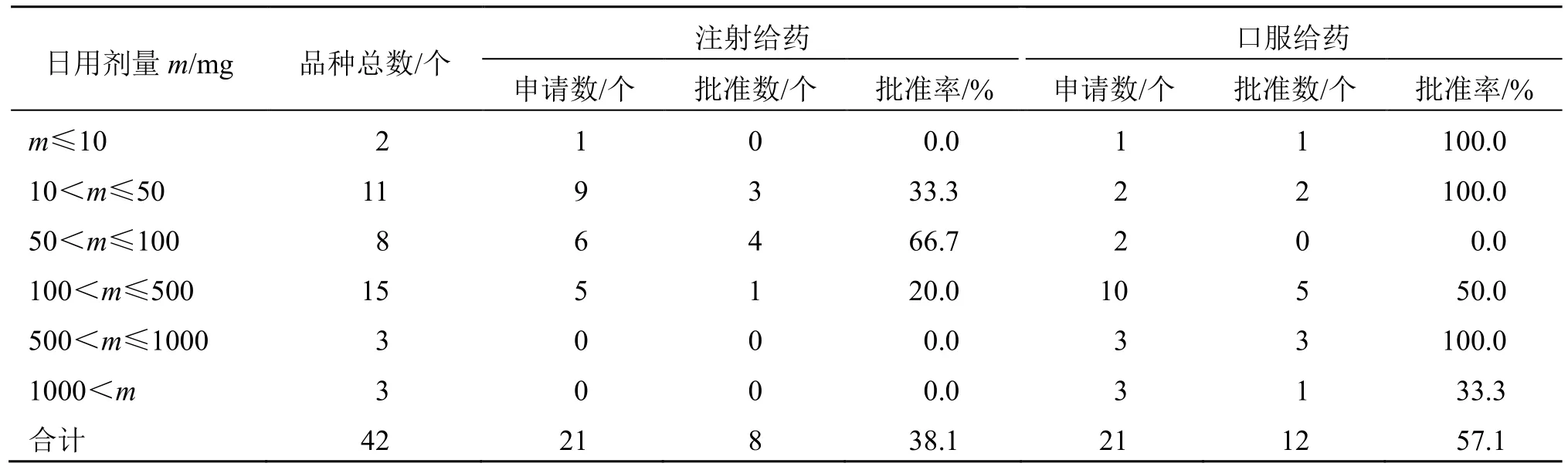
表4 2005—2021 年NCHAIDs 的日用剂量情况Table 4 Daily dose of NCHAIDs from 2005 to 2021
2.8 开展临床试验情况
2005—2021 年已审结的39 个IND 有效成分制剂中有19 个品种获批。假设中药NCHAIDs 自IND 获批至申请NDA 的时间段为临床试验所用时间(T):T≤3 年的有3 个品种(2 个已登记临床);3 年<T≤5 年的有9 个(均登记临床);5 年<T≤10 年有3 个(均登记临床);T>10 年有4 个(2 个登记临床)。有3 个尚未进行临床试验登记(其中2 个品种已超过3 年,1 个品种虽未登记但已完成上市申请)。
国家药品监督管理局药品审评中心网站“药物临床试验登记与信息公示平台”[6]显示(截至2022年6 月30 日):已登记临床试验的16 个品种中,I期临床试验已完成5 个,招募中5 个;II 期临床试验已完成1 个,招募中3 个;临床试验阶段不明招募中的2 个。
16 个已登记临床试验品种的平均临床试验所用时间(T平均)约7 年,且均未开展III 期临床试验。而同期NDA 获批中药复方新药的T平均为4.3年,约87%的临床试验用时在6 年以内。中药NCHAIDs 临床试验用时相对较长。5 个已完成I 期临床试验的有效成分的T平均约为7 年,其中,2 个品种已用约10 年,3 个已用约5 年;未完成I 期临床试验的5 个品种T平均约4 年。此外,有1 个品种已完成II 期临床试验,已用时12 年;3 个II 期临床试验正在进行中品种的T平均约9 年。
2.9 知识产权情况
CNTXT 收录了全部公开的中国专利文献。本文采用申请人结合关键词(中药有效成分)进行检索,检索文献始于CNTXT 最早收录的文献,止于2022 年10 月14 日公开的专利文献,NCHAIDs 的有效专利数量(专利申请被授权后仍处于有效状态的专利)见表5。

表5 2005—2021 年NCHAIDs 的有效专利数量Table 5 Number of valid patents of NCHAIDs from 2005 to 2021
从中药NCHAIDs 拥有的有效专利数量来看,44 个NCHAIDs 中,仅23 个新药品种拥有有效专利,占比约52.3%(其中以个人作为申请人的药品专利不在统计范围)。其中结构专利占比最低,仅11.4%。用途专利占29.5%。主要原因是大部分中药有效成分为已知成分且用途也被公众所熟悉,无法满足现有专利法关于新颖性和创造性的要求,因此难以获得专利保护。其中也有专利工作较好,如某新药,有效专利总数16 个,其中,结构专利3 个,用途专利7 个,工艺、组合物或制剂专利各3 个。
3 讨论
3.1 NCHAIDs 研发应加强基础研究
目前申请注册的NCHAIDs 的基础研究普遍较为薄弱,尤其是药物发现阶段的基础研究不够充分。尽管相应药材有长期人用历史,与天然产物相比,从药材中发现有效成分的几率可能相对较高,但一种药材往往含有几百或更多的成分,从中找出最适合开发成NCHAIDs 的某一种成分是非常具有挑战性的科学研究。NCHAIDs 的研发规律与天然药物及小分子化学药更为相近,不能完全根据药材的临床经验来推测其有效性。如何实现药材中的微量成分的高效分离、快速识别及高效活性筛选,都是需要解决的问题。新药发现阶段的研究非常重要,有效成分一旦确定,在很大程度上决定了今后新药的安全性、有效性。应加强基础研究,充分利用现代科学技术进步带来的新手段、新技术、新方法,如基于靶点的高通量筛选[7]、高内涵筛选[8]、钓靶技术[9]、分子对接技术[10]、网络药理学[11-12]、细胞膜色谱[13]、人工智能[14]、微流控芯片[15]、基因芯片[16]等。
3.2 NCHAIDs 研发应重视成药性研究
有些NCHAIDs 在研发中缺少成药性研究。仅从药材中发现活性成分后就匆匆立项,未考虑到有效成分虽有活性但未必适合开发成新药。从技术要求看,NCHAIDs 与小分子化学药已基本趋同。尽管从药材中发现的多数活性成分具有一定药效,但很多情况下药效作用强度较弱,或药代性质、安全性等方面存在缺陷,临床应用价值不大[17]。尤其是常用中药材,其中含量较高的成分早已被反复研究,成药性往往较差,不宜盲目开发。新药研发的投资大、周期长、风险高,应在研发立项及关键节点就成药性进行综合评估,合理控制研发风险。
3.3 NCHAIDs 研发应关注药物吸收利用
较强的生物活性与良好的药代性质是NCHAIDs 应具备的特征。NCHAIDs 是最有希望成功使用新剂型、新辅料、新技术的中药注册分类。应加强NCHAIDs 的药动学研究,鼓励采用现代制剂技术和合适辅料改善其生物利用度。应根据有效成分特点、生物药剂学分类及药代行为合理选择制剂技术及辅料。已有相关研究可为NCHAIDs 的研究提供思路和借鉴。Ma 等[18]采用高相对分子质量羟丙基甲基纤维素等辅料制备穿心莲内酯的固体分散体,其最大血药浓度(Cmax)、药-时曲线下面积(area under curve,AUC)分别提高了6.0、4.7倍。Gera 等[19]以聚乙烯吡咯烷酮为稳定剂制备了柚皮素纳米混悬剂,其Cmax及AUC 分别提高2.0、1.8 倍,改善了溶出度和口服生物利用度。Aboutaleb等[20]将长春新碱硫酸盐与聚阴离子右旋糖酐硫酸钠结合到棕榈酸脂质纳米粒中制成长春新碱的固体脂质纳米粒,与药物溶液相比,其血浆及组织中药物浓度提高,停留时间延长。Zhang 等[21]以聚乙二醇及二硬脂酰磷脂酰乙醇胺制成硫酸长春新碱纳米制剂,显著延长其半衰期、增大AUC。Wei等[22]以羟丙基甲基纤维素为沉淀抑制剂制备了过饱和水飞蓟宾自乳化给药系统,在给药剂量为533 mg/kg 时,水飞蓟宾过饱和自乳化给药系统比不含羟丙基甲基纤维素的自乳化给药系统相比,AUC增加约3 倍。
3.4 NCHAIDs 研发应关注资源与成本
以药材为起始原料且得率及用法用量明确的34 个NCHAIDs 中,口服制剂每日消耗的饮片量最高约2000 g,注射剂每日消耗的饮片量最高为740 g。以野生药材为原料的NCHAIDs 应特别关注药材资源能否可持续利用及对生态环境的影响。根据“中药材天地网”2022 年1 月不同药材产地、不同药材市场的平均价格计算,日服饮片量最多的NCHAIDs每日给药剂量所需的药材平均成本约为180 元。定向培育有效成分含量高的药用植物品种、改进工艺提高有效成分的提取得率,或采用合成生物学技术获得有效成分,或以有效成分为先导化合物,进行结构改造,研发新的化学药等,都可能是解决资源或成本问题的方法。
3.5 NCHAIDs 研发应重视知识产权保护
随着知识产权在保证研发投入回报及创新发展中作用的日益凸显,NCHAIDs 研发应建立知识产权保护的“护城河”,对于产品的有效专利予以充分重视。对于新研发的中药有效成分结构,可先争取获得结构专利作为基础专利,然后再从制剂、组合物、制备工艺、用途等方面进行全方位专利布局,获得多维度保护。对于已知有效成分的中药新药,即便不能获得结构专利,也可以进一步研究剂型、组合物、用途等专利,建立多重外围专利保护网。
4 结语
本文通过对2005—2021 年中药有效成分IND、NDA 的审评审批情况和临床试验登记情况进行分析和研究,结果显示:(1)据不完全统计,2005—2021 年NCHAIDs 申请临床试验的39 个品种中有19 个获得批准,批准率为48.7%。IND 获批品种中有16 个已进行临床试验登记。5 个NDA 品种中,4 个注射剂未获批准,另1 个胶囊剂获准上市生产。(2)NCHAIDs 申请的适应证相对集中在精神神经、心血管、肿瘤;临床定位与药材相关的有效成分获得IND 批准的比例相对较高。(3)有效成分的结构类型较多,黄酮、皂苷、内酯等的占比较高。(4)NCHAIDs 临床试验用时较长。16 个已完成临床试验登记品种的T平均约为7 年,有1 个品种完成了II期临床试验,5个完成了I期临床试验。(5)NCHAIDs拥有有效专利数量较少。44 个NCHAIDs 中,仅23个新药品种拥有有效专利,占比约52.3%。其中结构专利仅占11.4%。用途专利占29.5%。
中药新药的研究与评价应以患者为中心,以临床价值为导向。NCHAIDs 研发应加强基础研究,重点加强新药的成药性研究,控制研发风险。重视有效成分的药动学研究,采用新剂型、新技术增加药物吸收利用。关注NCHAIDs 用药材资源与制造成本等问题。本文对以往NCHAIDs 注册申请及审评情况的回顾分析,为今后NCHAIDs 的科学审评积累经验,为NCHAIDs 的研发提供有益参考。
本文仅为作者观点,不代表任何组织或机构。
利益冲突所有作者均声明不存在利益冲突

