仿制与原研卡培他滨的真实世界研究Δ
陈 喆,石亚飞,杨 珺,刘 敏,戚姝娅,朱志翔,李国辉#
(1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院药剂科,北京 100021; 2.国家癌症中心/国家肿瘤临床医学研究中心/河北中国医学科学院肿瘤医院药剂科,河北 廊坊 065001)
卡培他滨为氟尿嘧啶的前体药物,在体内经羧酸酯酶、胞苷脱氨酶和胸苷磷酸化酶等多种酶的作用,代谢为5-氟尿嘧啶(5-FU)发挥抗肿瘤作用。由于肿瘤组织中胸苷磷酸化酶浓度高于正常组织,因此,卡培他滨具有被动靶向作用[1-2]。2001年卡培他滨原研药在我国上市,其国内专利于2013年12月到期。2013年12月起,国内卡培他滨仿制药陆续上市。为实现对原研药的临床替代、降低整体药品价格水平,我国自2015年起开展仿制药质量和疗效一致性评价。2020年起,国内陆续有多个厂家的卡培他滨通过一致性评价。2018年,国家医疗保障局成立,负责指导药品集采规则制定和集采平台建立。2021年1月,国务院办公厅发布《国务院办公厅关于推动药品集中带量采购工作常态化制度化开展的意见》[3],进一步明确了带量采购的覆盖范围,其中把通过一致性评价的药品作为优先纳入采购的条件,保证了中选品种的质量。
2020年11月,第三批国家组织药品带量采购55种药品在北京市正式执行,在此之前,北京市分别在2019年3月和2020年4月执行了2批药品集中带量采购。第三批集中采购涵盖高血压、糖尿病和肿瘤等多个疾病领域,中标价格平均降幅53%,最大降幅>95%,预计执行第三批国家组织集中采购中选药品每年将为北京市节省采购费用约10亿元[4]。卡培他滨作为该批集中采购的药品之一,中标药品的价格为35元/10片,而原研药的价格为350元/12片,集采药品价格降幅接近90%。受国家医疗保障局委托,本研究收集执行第三批国家药品集中带量采购期间,中国医学科学院肿瘤医院(以下简称“我院”)使用仿制与原研卡培他滨患者的临床资料,开展“带量采购中标药品疗效与安全性评价的真实世界研究”项目,为临床提供客观依据。
1 资料与方法
1.1 资料来源
本研究为基于真实世界数据的回顾性、观察性研究,对执行第三批国家药品集中带量采购期间,于我院内科住院治疗且使用集采或原研卡培他滨的患者进行数据的采集、分析。选取2020年11月至2021年11月于我院内科住院治疗,诊断为胃癌或结直肠癌,且使用卡培他滨原研药或集采药品的成年患者。诊断以病历首页的ICD编码为判断标准,ICD编码以C16、C18及C20(C16为胃癌,C18为结肠癌,C20为直肠癌)为开头的病历作为纳入条件。患者年龄<18岁为排除条件。共纳入符合标准的患者254例,其中仿制药组136例,原研药组118例,所有患者的基本特征见表1。

表1 两组患者的基本特征比较Tab 1 Comparison of clinical characteristics between two groups
1.2 方法
仿制药及原研药的卡培他滨规格均为500 mg/片。本研究为真实世界中药物使用的回顾性研究,卡培他滨的具体剂量和疗程由临床医师根据实际治疗需求确定。
1.3 观察指标
基于医院电子病历系统构建研究数据库,回顾性收集符合纳入标准的所有患者的相关信息。结构性数据由电子病历系统自动提取,非结构性数据由2名经过培训的临床药师独立完成录入,并相互审核。患者信息结构化模块分为患者基本情况、疾病及治疗情况、药物使用情况、不良反应、疗效评价等。患者基本情况包括年龄、性别、身高、体重、ECOG评分和医保状况等;疾病及治疗情况包括肿瘤诊断、肿瘤分期、治疗性质和合并疾病等;药物使用情况包括卡培他滨的类型(仿制或原研)、剂量等;不良反应包含不良反应名称、严重程度等。
1.4 疗效评定标准
疗效评价以实体瘤疗效评定标准(RECIST)1.1[5]为标准,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD)。由记录得出客观缓解率(ORR)=CR率+PR率,疾病控制率(DCR)=CR率+PR率+SD率。合并疾病及不良反应模块中的信息若病历未记录,视为无其他疾病及未发生不良反应;其余模块中的信息若病历中未记录,标记为“未知”。安全性的终点指标为主要不良反应发生率,有效性的终点指标为ORR和DCR。
1.5 统计学方法

2 结果
2.1 安全性分析
所有患者以性别、年龄、体表面积、ECOG评分、肿瘤部位、肿瘤分期和单位体表面积剂量为因素,对仿制组和原研组进行1∶1匹配。匹配后仿制组和原研组各纳入118例患者,两组患者基本情况及治疗后主要不良反应的差异均无统计学意义(P>0.05),见表2。

表2 两组患者基本情况和治疗后主要不良反应发生情况比较Tab 2 Comparison of basic information and main adverse drug reactions after treatment between two groups
2.2 有效性分析
利用一线治疗的病例进行有效性分析,仿制组纳入47例,原研组纳入65例,两组患者基本情况的差异无统计学意义(P>0.05),两组患者ORR和DCR的差异均无统计学意义(P>0.05),见表3。
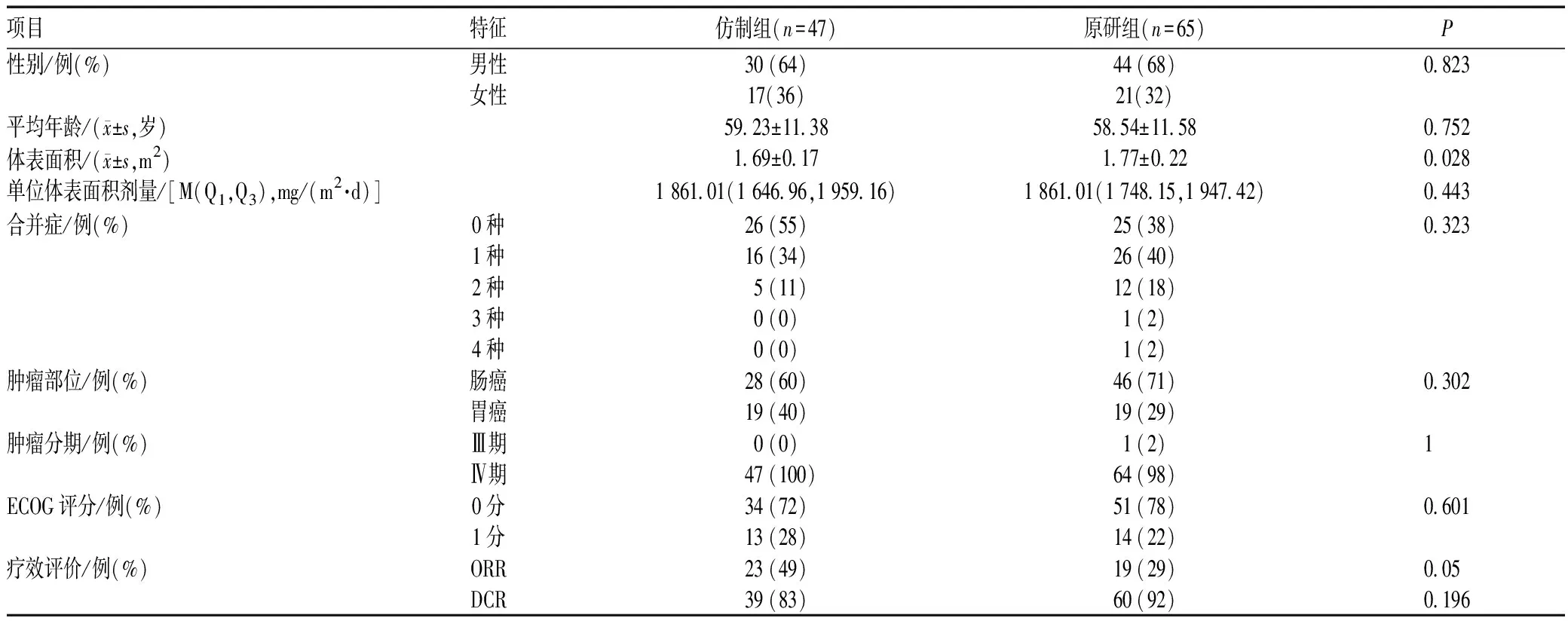
表3 两组患者基本情况、ORR和DCR比较Tab 3 Comparison of basic information, ORR and DCR between two groups
3 讨论
卡培他滨在我国被批准用于结直肠癌和胃癌的辅助治疗,晚期结直肠癌和胃癌的治疗,以及蒽环及紫杉类药物治疗失败的转移性乳腺癌的化疗。氟尿嘧啶类药物是消化道肿瘤治疗的基石类药物,临床研究结果表明,含卡培他滨的XELOX方案与含5-FU的FOLFOX方案在治疗的有效性和安全性方面没有差异[8]。中国临床肿瘤学会指南[9]、美国临床肿瘤协会指南[10-12]中,以卡培他滨为基础的治疗方案在胃癌和结直肠癌的辅助治疗、新辅助治疗以及晚期胃癌和肠癌的一、二线治疗中均是首选方案。由于卡培他滨为口服的前体药物,有被动靶向作用,且使用较为便捷,既缩短了住院时间又避免了中心静脉插管的护理及并发症,实践中更易被医师和患者接受。近年来,我院消化道肿瘤使用卡培他滨治疗的患者远多于使用5-FU的患者。而在乳腺癌的治疗中,卡培他滨并非首选药物,属于后线治疗,因此,真实世界中乳腺癌使用卡培他滨的患者远少于消化道肿瘤,且大多数为多线治疗后的门诊患者,治疗及检查数据的完整性有所欠缺。因此,本研究选取胃癌和结直肠癌的住院患者作为研究人群。
由表1可知,仿制组中医保类型为城镇居民的患者占比高于原研组,且差异有统计学意义(P<0.05)。本研究中,参加城镇居民医保的患者主要是城镇户口的老人或者没有工作的成人,推测该类患者自身收入有限,由于城镇居民的报销比例低于城镇职工,因此该类患者为价格敏感人群,使用集采药品为经济性更好的选择。
根据年龄、性别、体力状况、体表面积、肿瘤部位、肿瘤分期和单位体表面积剂量等因素对使用仿制和原研药品的病例进行倾向性评分匹配后,评估安全性。表2中,虽然两组患者体表面积比较,P<0.05,但两组患者单位体表面积卡培他滨使用剂量的差异无统计学意义(P>0.05),且血液系统、肝肾功能、消化系统及手足综合征等主要不良反应的差异均无统计学意义(P>0.05),提示在药品安全性方面,仿制与原研卡培他滨具有可比性。与其他文献报道[13-14]相比,表2中各类不良反应发生率较低,造成该现象的原因是本研究为回顾性收集病历信息,而病历记录中对不良反应的记录不如前瞻性研究完整、详细。
由于二线及以上治疗的病例数较少,因此选择一线治疗的病例进行有效性评价。两组患者的ORR比较,P=0.05,未达到P<0.05的差异有统计学意义的标准,两组患者DCR的差异无统计学意义(P>0.05)。由于纳入有效性分析的病例数较少,未来还需开展更大样本量的前瞻性研究进行深入探讨。
本研究存在以下局限性:(1)本研究数据来自单一中心的住院患者,研究样本的多样性有所欠缺。虽然该中心为三级甲等肿瘤专科医院,且为亚洲最大的肿瘤医院,收治来自全国各地的肿瘤患者,但由于我国幅员辽阔,城乡差异巨大,不同类型医院的肿瘤治疗不免存在差异。例如,本研究中进行术前、术后及一线治疗的患者占比>80%,而该类患者多为初次治疗的人群,因此,本研究的结论不一定适用于其他类型的医院。(2)本研究通过回顾性收集病历信息进行数据分析,数据的完整性较前瞻性研究有所欠缺。(3)本研究未涉及药物经济学内容。合理用药是指安全、有效、经济地使用药物。国家对药品进行集中带量采购的目标是实现药品价格明显降低,减轻患者医药费用负担。虽然集采药品的单价比原研药下降了约90%,但本研究未进行严谨的经济学验证。
综上所述,真实世界研究结果提示,仿制与原研卡培他滨在有效性和安全性方面的差异无统计学意义,未来还需开展更大样本量的研究,进一步探讨仿制药与原研药的有效性和经济性问题,为临床用药提供客观依据。

