基于P72、MGF和CD2v基因的非洲猪瘟三重荧光定量PCR检测方法的建立
张红云 陈秋英 严斯刚 杜泓明 陆志翔 郑敏 罗廷荣*
(1.广西大学生命科学与技术学院,广西 南宁 530004;2.广西悦牧生物科技有限公司,广西 南宁 530006;3.广西璞缔恩葳生物技术有限公司,广西 南宁 530006;4. 柳州市动物疫病预防控制中心,广西 柳州 545026;5.广西大学动物科学技术学院,广西 南宁 530004;6.广西壮族自治区动物疫病预防控制中心,广西 南宁 530004)
2018年8月在我国辽宁省首次报道非洲猪瘟(African swine fever,ASF)疫情,随后疫情从东北地区迅速蔓延至全国各地,对我国养猪业造成了不可估量的经济损失[1]。非洲猪瘟病毒(African swine fever virus,ASFV)是非洲猪瘟病毒科(Asfarviridae)的一种病毒,仅感染猪科动物[2]。
ASF刚传入中国呈现出感染性强、毒力强的特点,表现为高热、皮肤充血、多器官出血及流产、快速传染和死亡等急性症状,给养猪业造成重大损失。随着ASFV在中国的定殖,逐步出现基因缺失株、自然变异株、自然弱毒株等基因变异毒株,与传统的野毒株相比,生猪感染基因变异毒株后,表现为排毒滴度低、间隙性排毒、潜伏期长、难以早期发现和精确监测。基因变异毒株的基因组序列、致病力等发生明显变化。
ASFV基因变异毒株侵染初期没有明显的临床症状,采用抗体检测无法区分所感染病毒株的类型,采用保守的P72蛋白序列研制的荧光定量PCR方法进行检测,虽然可以尽早发现被ASFV感染的猪只,但是无法鉴别野毒株与基因变异毒株,因此建立能够鉴别野毒株和基因变异毒株的多重荧光定量PCR方法,对构建猪场生物安全屏障,开展ASFV的野毒株和基因变异毒株的鉴别诊断意义重大,有利于养殖场采取相应措施进行防控。
1 材料与方法
1.1 材料
猪圆环病毒2型(PCV2)、猪伪狂犬病病毒(PRV)和猪细小病毒(PPV) 的DNA阳性对照由广西璞缔恩葳生物技术有限公司实验室提供。本实验的阳性对照及构建质粒的模板是在广西动物疫病预防控制中心组织的ASFV比对试验中验证为ASFV阳性的样本。经鉴定,在阳性样本中,有野生型ASFV及MGF-CD2v基因双缺失的ASFV两种样本。2×Taq PCR Mastermix(KT201-12)、普通琼脂糖凝胶DNA回收试剂盒(DP209-02)、pLB 零背景快连接试剂盒(VT205-01)、DH5α感受态细胞(CB101-01)和质粒小提试剂盒(DP103-02)购自天根生化科技(北京)有限公司。DNA marker LD DS2000(LM1101)购自广州东盛生物科技有限公司。Animal Detection U+ Probe Master Mix (QV110-01)购自南京诺唯赞生物科技股份有限公司。
1.2 引物设计
以专利《基因缺失的减毒非洲猪瘟病毒及其作为疫苗的应用》为参考[3],对非洲猪瘟病毒中国流行株Pig/CN/HLJ/2018(GenBank登录号:MK333180.1)的缺失情况进行分析。根据ASFV基因缺失毒株(HLJ/18-7GD株)的两个基因CD2v和MGF的缺失位置设计引物(见表1),用于鉴定野生毒株和基因缺失毒株。
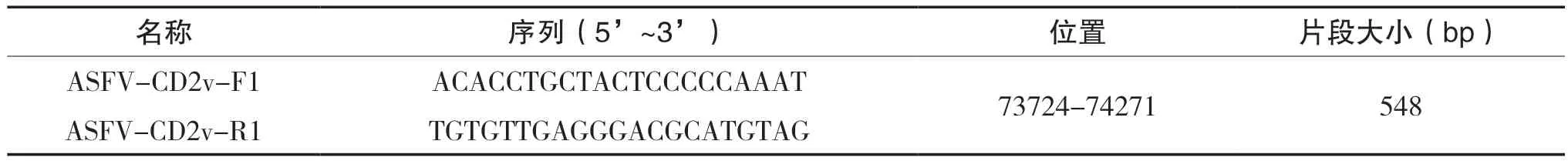
表1 ASFV野生株与基因缺失毒株鉴别引物列表
1.3 重组质粒标准品的构建与鉴定
通过PCR方法从ASFV阳性DNA模板扩增相应基因片段。反应体系如下:2×Taq PCR Mastermix 25 μL,上、下游引物(10 μmol/L)各2 μL,核酸模板5 μL,加ddH2O补充至50 μL。
将PCR产物纯化回收后分别连接在pLB Vector载体上,构建重组质粒,转化到大肠杆菌DH5α感受态细胞上,涂布于Amp抗性LA平板筛选阳性克隆,送至北京擎科生物科技股份有限公司测序。筛选序列正确的阳性菌落扩大培养后提取质粒并测定质粒浓度,根据以下公式计算拷贝数:双链 DNA拷贝数(copies/mL)=6.02×1023(copies/mL)×浓度(g/mL)/ 重组质粒长度×660。
1.4 三重荧光定量PCR检测方法及标准曲线的建立
根据重组质粒序列设计相应的引物和探针(见表2),稀释至10 μmol,建立三重荧光定量PCR检测方法。三重荧光定量PCR体系反应条件探索如下:Animal Detection U+ Probe Master Mix 12.5 μL,正反向引物0.2~0.8 μL,以0.1 μL递增,探针引物0.1~0.4 μL,以0.1 μL递增,采用矩阵法优化引物和探针的最优浓度配比。阳性对照核酸模板1 μL,用ddH2O补足25 μL反应体系。反应程序详见QV110-01产品说明书。
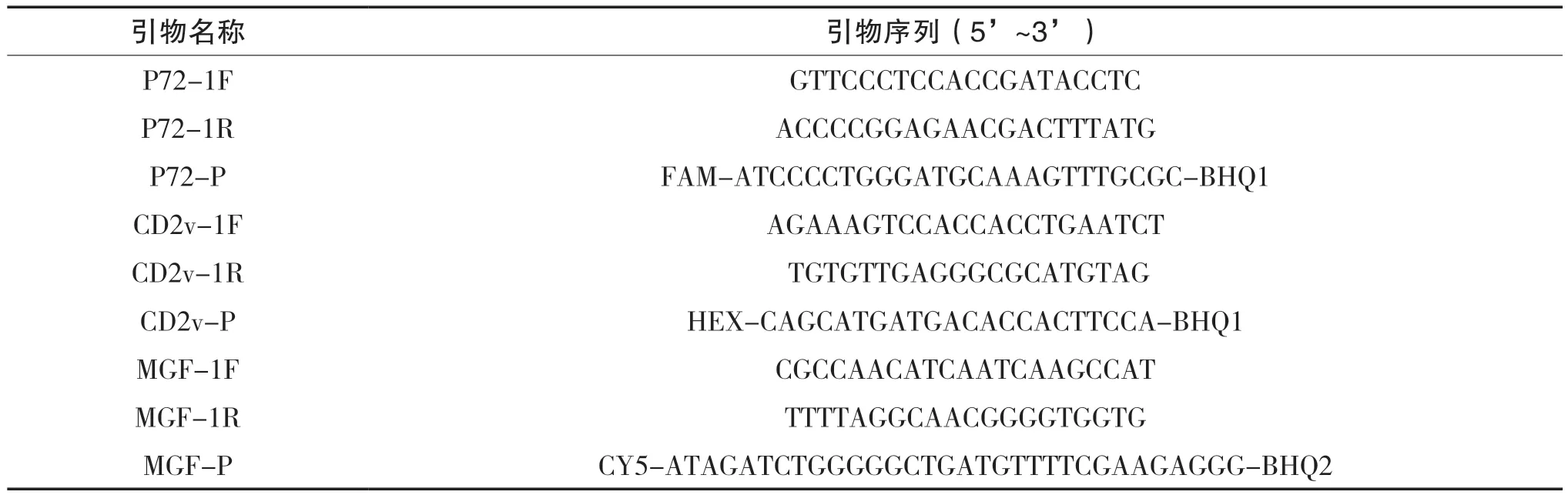
表2 三重荧光定量PCR引物及探针列表
测定pLB-P72、pLB-CD2v、pLB-MGF重组质粒浓度,稀释至(5.44~6.46)×1012copies/mL,按1∶1∶1混匀后作为阳性对照标准品,以10 倍的梯度稀释成11个浓度,按照优化好的反应体系和条件进行多重荧光定量 PCR 扩增,以标准品浓度的对数为横坐标,Ct 值为纵坐标建立标准曲线[用(5.44~6.46)×109copies/mL到(5.44~6.46)×105copies/mL这5个浓度梯度建立标准曲线]。
1.5 特异性试验
以PCV2、PRV 和PPV的 DNA为模板,按照1.4优化出的条件,进行PCR扩增检测,以评估检测方法的特异性。
1.6 敏感性试验
将重组质粒标准品10倍梯度(从1012-102copies/μL)稀释后,按照1.4已优化的条件,以三个重组质粒为阳性对照,确定该方法的敏感性。
1.7 重复性试验
以上述不同浓度的质粒标准品混合物为模板,利用本研究建立的方法检测,每个浓度设3个生物学重复,进行组内重复性分析。将上述试验重复3次,进行组间重复性分析,计算变异系数,分析该方法的重复性。
1.8 三重荧光定量PCR方法的验证试验
以广西动物疫病预防控制中心提供的野生型ASFV及MGF-CD2v基因双缺失的ASFV两种样本为验证材料,使用P72、CD2v、MGF这3个基因的引物(表2)进行普通PCR验证。验证正确后使用上述两种样本的DNA为模板,用1.4优化出的三重荧光定量PCR来检测,鉴别ASFV的野生毒株和MGF-CD2v基因双缺失毒株。
2 结果
2.1 重组质粒标准品的构建
采用表1设计的引物均能扩增出大小正确的目的片段。选取ASFV-P72-F3/R3扩增产物(382 bp)、ASFV-MGF-F1/R1扩增产物(827 bp)和ASFV-CD2v-F1/R1扩增产物(548 bp)连接pLB Vector,转化DH5α。挑选菌落PCR验证正确的阳性克隆送测序,获得测序正确的重组质粒pLB-P72、pLB-MGF和pLB-CD2v。
2.2 引物和探针浓度配比的优化
在引物和探针浓度均在10 μmol情况下,采用矩阵法优化引物和探针的最优浓度配比:取0.1~0.5 μL的引物,扩增效率随引物浓度显著提升;取0.5~0.7 μL的引物,扩增效率不再随引物浓度提升。探针浓度在0.2 μL附近为最优。故优化后体系如下:上下游引物(10 μmol)各0.5 μL,探针(10 μmol)各0.2 μL。
2.3 标准曲线的建立
以pLB-P72(FAM通道)、pLB-CD2v(HEX通道)、pLB-MGF(CY5通道)重组质粒标准品作为阳性对照,建立标准曲线。因为从(5.44~6.46)×1012copies/mL到(5.44~6.46)×1010copies/mL以及从(5.44~6.46)×104copies/mL到(5.44~6.46)×102copies/mL这两个浓度范围的线性关系并不是很显著,所以选取从(5.44~6.46)×109copies/mL到(5.44~6.46)×105copies/mL建立标准曲线。三个重组质粒的拷贝数以10为底的对数值与Ct值在上述浓度范围有较好的线性关系(图1)。
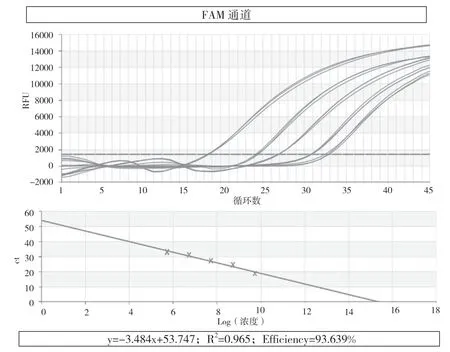
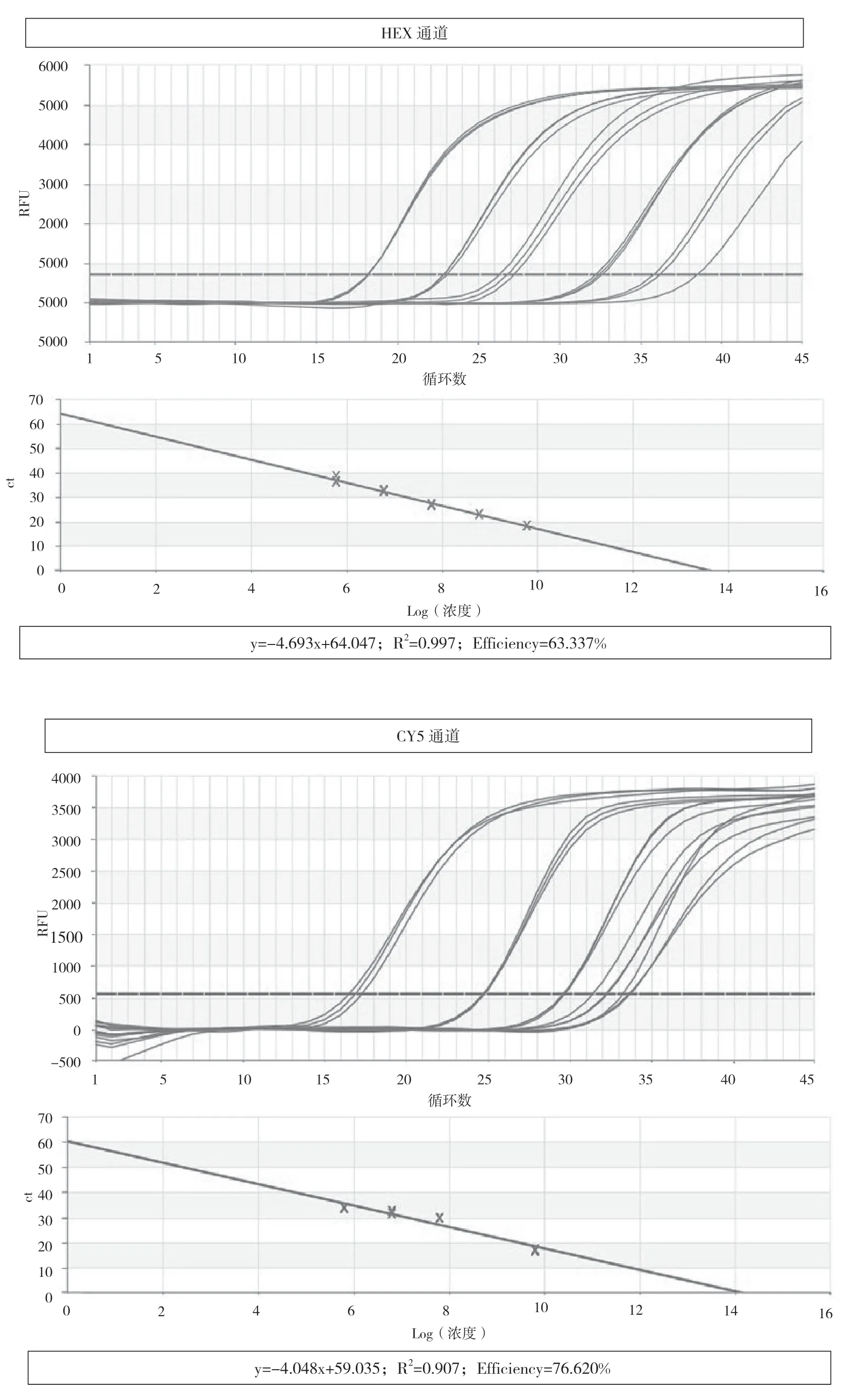
图1 FAM、HEX和CY5通道的扩增曲线图及标准曲线
2.4 特异性试验
以PCV2 、PRV、PPV的DNA为模板,按照1.4已优化的条件进行检测,未出现特异性扩增曲线,说明引物的特异性良好。
2.5 敏感性试验
以pLB-P72、pLB-CD2v、pLB-MGF重组质粒标准品为模板,按照1.4已优化的条件,从(5.44~ 6.46)×1012copies/mL到(5.44~6.46×102)copies/mL浓度范围均可以检测出明显的扩增曲线(图2),其检测阈限在(5.44~6.46)×102copies/ mL之下,其灵敏度可以达到102~103copies/mL之间。
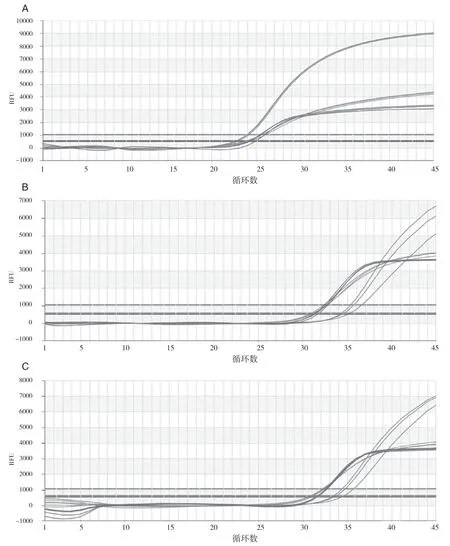
图2 三重荧光定量PCR扩增曲线图
2.6 重复性试验
对FAM、HEX和CY5三个信号通道下109、107和105这3个模板浓度下的数据进行组间的重复性比较,利用变异系数计算公式计算变异系数。结果显示,大部分组间变异系数均小于 2%或接近2%,只有一组数据HEX和CY5二组数据稍大于2%(表3),表明该检测方法具有较好的重复性。

表3 重复性试验结果
2.7 三重荧光定量PCR方法的验证
ASFV的野生毒株可扩增出P72、CD2v和MGF3个基因的所有片段,而MGF-CD2v基因双缺失毒株仅可扩增出P72基因的片段。通过三重荧光定量PCR检测鉴别,ASFV的野生毒株出现FAM、HEX和CY5 3个通道的扩增曲线,而MGF-CD2v基因双缺失毒株仅有FAM通道的扩增曲线(图3)。
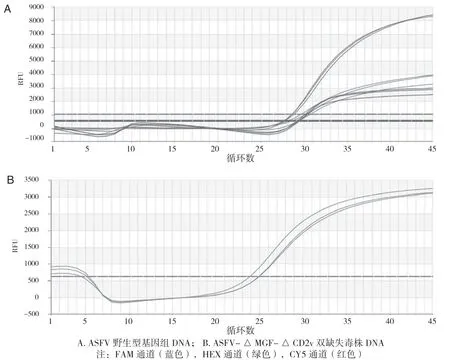
图3 三重荧光定量PCR的样本检测试验
3 讨论
本实验建立的三重荧光定量PCR方法可以有效检测ASFV,并能对ASFV的野毒株和MGFCD2v基因缺失毒株进行鉴别,检测的敏感性为102~103copies/mL。该灵敏度已经达到目前查阅到的基于TaqMan探针的多重荧光PCR检测企业标准(1000 copies/mL)的要求(T/GDMDMA 0001—2021)。同时我们也注意到CY5和HEX扩增效率比较低,可能与使用的Animal Detection U+ Probe Master Mix的扩增效率有关,使用扩增效率更高的Taq酶或能提高检测精确性。
据张静远等报道[4],基于P72基因设计的TaqMan探针,其对阳性重组质粒的检测灵敏度在10 copies/μL,对已知阳性临床组织样品可检至 1∶103稀释度。据韩玉等人研究[5],基于CD2v基因设计的TaqMan探针荧光定量检测方法,对重组质粒的检测阈限在16 copies/μL。而根据蔡晓丽等人所报道的P72和CD2v双基因实时荧光定量PCR检测方法,其检测阈限在7.3 copies/μL~24.5 copies/μL的ASFV核酸浓度[6]。目前现行的非洲猪瘟检测国家标准《非洲猪瘟诊断技术》(GB/T 18648—2020)仅有基于P72基因的单重探针荧光PCR方法[7],本研究建立的基于P72、MGF和CD2v基因的三重探针荧光PCR方法可以区分野毒株和基因缺失变异株,将为两类毒株的鉴别诊断标准的修订提供数据支撑。综上所述,本研究建立的基于P72、MGF和CD2v基因的TaqMan探针荧光定量检测方法可靠有效,可为临床应用提供科学的试验依据。

