上海市及其他地区临床实验室B族链球菌核酸检测室间质量评价分析
杨依绡,肖艳群,黄中强,鲍 芸(上海市临床检验中心,上海 200126)
B 族链球菌(group BStreptococcus,GBS)是革兰氏阳性菌,常定植于人体下消化道及泌尿道中,属于条件致病菌[1]。临床研究表明,GBS 是引起围产期生殖道感染的首要致病菌[2]。GBS 可通过羊水由母体传播给新生儿,从而导致胎儿窘迫并增加新生儿感染风险[3-4]。目前临床广泛开展了对妊娠中晚期孕妇GBS 筛查检测,多项专家共识建议微生物培养法结合核酸扩增检测以提高围产期母婴感染GBS 的检出率[5-8]。荧光聚合酶链式反应法(polymerase chain reaction,PCR)已成为临床常用的检测方法。与传统的微生物鉴定方法相比,荧光PCR 法不需要进行细菌培养,能在2~3h 内快速进行检测,具有较高的敏感度和特异度[9]。但荧光PCR 检测中涉及到对目的片段的体外特异性PCR扩增,容易出现假阳性或假阴性结果[10],影响后续临床干预措施。因此,临床实验室检测质量尤为重要,本研究在全国首次开展GBS 核酸检测项目的室间质量评价(简称室间质评),对该项目的检测质量进行调查评估,并通过实验室上报结果总结,分析临床实验室存在的问题,加强临床实验室该项目检测的质量控制意识,提高检测质量。
1 材料与方法
1.1 参评实验室 2021年参加GBS 核酸检测室间质评计划参评实验室为33 家,参评实验室主要来自三级医疗机构、二级医疗机构和第三方实验室。两次质评活动开展时间分别为:2021年5月12日~5月18日和2021年9月7日~9月14日。
1.2 质控物 室间质评样本盘准备室间质评样本购自上海之江生物有限公司,由灭活的GBS 培养液经稀释液稀释而成。样本盘包含5 份样本,4 支不同浓度阳性样本和1 支阴性样本,每支500μl,于-20℃保存。
1.3 方法
1.3.1 室间质评计划实施:GBS 核酸检测项目室间质评计划为一年两次,两次室间质评样本盘分别含有5 份样本,其中阴性样本1 支及4 种不同浓度阳性样本各1 支。5 支样本随机编码后冷链发送至各参评实验室。要求参评实验室在规定时间内按照常规样本检测流程进行检测并将结果通过网络上报至中心数据库。
1.3.2 室间质评样本的评价
1.3.2.1 均一性评价:参照中国合格评定国家认可委员会CNAS-GL003:2018《能力验证样品均匀性和稳定性评价指南》要求,室间质量评价调查前从制备好的能力验证样本中选取1 个批号弱阳性样本和阴性样本随机抽取10 个样本,使用GBS DNA检测试剂盒检测,具体操作严格按照试剂说明书进行,每个样本重复检测二次。
1.3.2.2 稳定性评价:在每次室间质评结果上报截止日前后3日内,进行同步稳定性评价。选取1 个批号阳性和阴性样本,数量为各6 支,使用GBS DNA 检测试剂盒检测,每个样本检测一次。
1.4 统计学分析 室间结果分析:根据各实验室回报结果计算各参评实验室的得分情况。室间质评成绩计算为检测结果与预期相符的百分率。≥80%判定为室间质评成绩合格。同时计算每个样本的总体符合率、假阳性率和假阴性率,并与实验室沟通分析错误检测结果的原因。
2 结果
2.1 室间质评样本验证结果 2021年室间质评样本采用荧光PCR 法确定各样本的靶值,GBS 核酸检测为定性结果,各样本检测原始扩增曲线见图1。二次室间质评样本盘构成及预期结果见表1。

表1 2021年室间质评样本盘构成及检测符合率
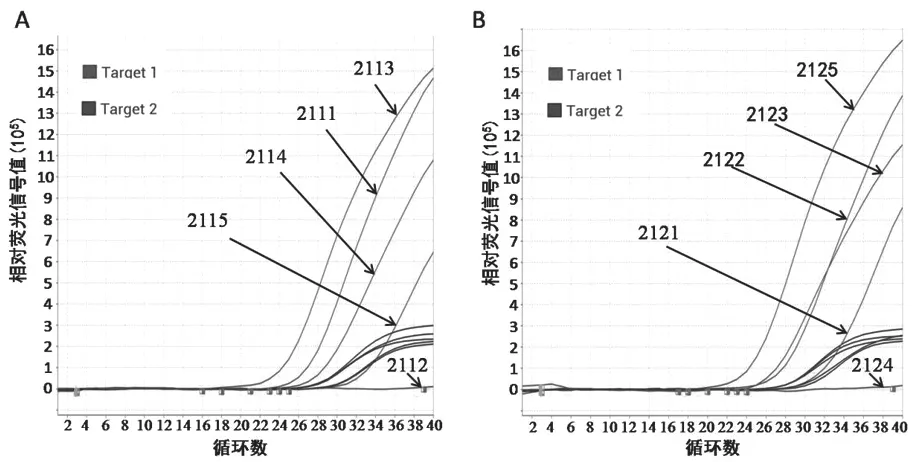
图1 二次室间质评样本荧光PCR 检测扩增曲线图
采用荧光PCR 法进行均一性和稳定性检测,所有样本检测结果与预期结果一致,符合率为100%,表明室间质评样本具有良好的均一性和同步稳定性。
2.2 参评实验室总体情况 2021年GBS 核酸检测室间质评计划参评实验室为33 家,两次质评活动中收到的有效回报结果分别为31 份(其中上海地区19 家,其它地区12 家)和32 份(其中上海地区19 家,其它地区13 家),结果有效回报率为96.88%(31/32)和96.97%(32/33)。室间质评样本检测符合率见表1。此外,本文还对参加二次室间质评计划的实验室类别进行了分析,参评实验室来自各级各类医疗机构,其中来自三级医疗机构各有18 家,二级医疗机构各3 家,第三方医学检验实验室各10 家和11 家。三级、二级和第三方医学检验实验室在2 次室间质评中占比分别为58%,32%,10%和56%,34%,10%。
2.3 室间质评结果评价分析 GBS 核酸为定性检测项目,根据参评实验室上报的定性结果统计得分。2021年两次室间质评中,结果回报完全正确的实验室分别为87.10%(27/31)和96.88%(31/32),样本检测的总体符合率分别为97.42%(151/155)和99.38%(159/160)。回报错误的实验室第1 次室间质评中有4 家,第2 次室间质评中有1 家。2 次室间质评中对实验室采用的7 种不同检测试剂的检测效能进行了比较研究,7 种试剂对室间质评样本都能正常检测,见表2。
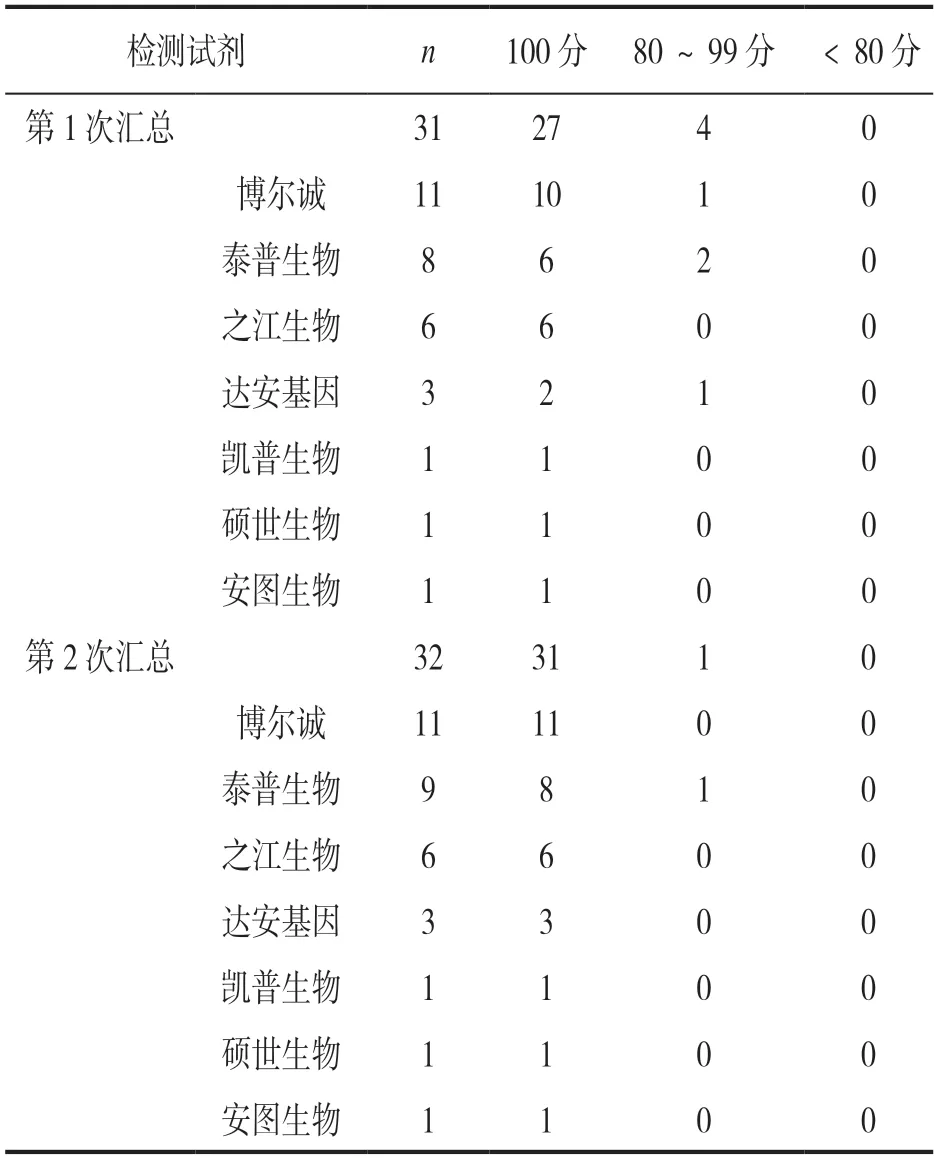
表2 参评实验室所用检测试剂和检测能力
二次室间质评中阴性样本的检测符合率为100%(63/63),阳性样本的检测符合率为98.02%(247/252)。结果汇总中共出现5 例错误,集中表现为假阴性。其中4个浓度阳性样本(浓度从低到高)检测符合率分别为93.65%(59/63),100%(63/63),98.41%(62/63)和100%(63/63)。实验室上报的错误结果主要出现在弱阳性样本(2115 号和2121号样本)检测结果。第一次室间质评结果上报错误的4 家实验室,其中3 家在第二次室间质评中检测符合率提高至100%。
3 讨论
GBS 核酸检测能够帮助临床快速识别妊娠期女性病原体感染的发生,为使用抗生素进行产前预防性干预治疗,降低围生期感染性疾病的发生率提供依据[11]。本研究在国内首次开展了GBS 核酸检测室间质量评价计划,对临床实验室检测质量进行了有效评估。
分析室间质评结果发现,未出现假阳性结果,检测错误主要是部分实验室弱阳性样本未检出。分析错误产生的原因可能有以下几点:①GBS 为革兰氏阳性菌,其细胞壁结构较革兰氏阴性菌更致密复杂,需要经过高温加热裂解破壁才能释放核酸,提取过程中存在金属浴/水浴温度实际温度低于正常,样本加热时间不足等情况可能导致细胞壁裂解不充分,核酸提取效率下降;②检测试剂在运输、储存过程中保存不当,DNA 聚合酶部分失活或荧光探针部分降解,试剂检测效能下降;③实验室检测人员存在试剂配制或加样量不准确等操作误差。建议实验室从以下方面改进:①严格按照试剂说明书要求进行操作,确保样本的充分裂解;②定期进行仪器设备(如金属浴、移液器、温度计等)的校准,确保所有实验条件满足要求;③按要求在使用新批次试剂前进行批间差质检,确保新批次试剂的检测效能,同时严格按说明书要求储存试剂,并定期监控储存温度;④加强人员培训,尤其是新进技术人员的实验操作培训,定期考核并开展人员比对,提高检测能力。
值得一提的是三家在第一次室间质评中出现错误的实验室在第二次室间质评中结果全部正确,质评成绩均为满分。说明实验室通过参加室间质评计划,能够有效发现日常检测中的问题,在及时进行原因分析并采取有效的纠正措施进行内部整改后,能够改进质量提高检测水平。
本研究利用灭活的GBS 培养液经稀释作为质控品,能够有效监测实验室从核酸提取到PCR 结果分析的检测全过程。参评实验室使用多种不同检测试剂盒进行检测且结果正常,表明其具有良好的临床适用性。但与临床样本相比,本研究中使用的质控品只包含GBS 一种微生物,所含的微生物种类单一,不能完全模拟某些复杂临床样本,已有的研究表明不同检测系统对临床样本的检测特异度和抗干扰能力存在差异[12]。今后的研究中,可以考虑使用含有多种生殖道微生物种群的复合样本,以考察不同检测系统检测特异度和抗干扰能力。
随着分子诊断技术在临床实验室的不断推广,GBS 核酸检测已逐渐取代传统微生物培养法成为临床常用的检测方法,其检测质量对于结果的准确度十分重要,希望通过室间质量评价计划的开展,帮助实验室发现问题及时整改,保证质量,为后续临床干预提供有力的技术支撑。

