早发型子痫前期患者血清ESM1及LRP1表达水平及其与病情严重程度的相关性研究
彭 勃,李永平,刘海燕,朱晓红
(1.江苏省盐城市妇幼保健院产科,江苏盐城 224000;2.江苏省盐城市滨海县中医院产科,江苏滨海 224599)
子痫前期是妊娠期特发的高血压疾病,在孕产妇中发病率高达4.6%[1]。早发型重度子痫前期是子痫前期中的严重类型,可导致母体脏器功能不全及胎儿生长发育受限[2]。内皮细胞特异性分子-1(endothelial cell specific molecule-1,ESM1)是内皮细胞活化及功能障碍的标志物[3]。近年来发现,ESM1 在晚发型子痫前期患者中表达升高,与患者较高的心血管疾病风险及代谢紊乱关系密切[4]。低密度脂蛋白受体相关蛋白-1(lipoprotein receptorrelated protein 1,LRP1)属于低密度脂蛋白受体家族成员,参与包括细胞内信号传导、脂质稳态和凋亡细胞清除等过程[5]。研究发现,子痫前期患者血清中LRP1 表达升高,其通过影响患者脂代谢状态,参与子痫前期的疾病发生发展[6]。目前,ESM1 和LRP1 在早发型子痫前期中的表达及临床意义尚不清楚。本研究通过检测早发型子痫前期患者血清ESM1 和LRP1 水平,分析两者联合检测对早发型重度子痫前期的诊断价值。
1 材料与方法
1.1 研究对象 选取2019年2月~2021年2月盐城市妇幼保健院诊治的218 例早发型子痫前期患者为研究对象(病例组),根据早发型子痫前期患者病情严重程度分为轻度组(n=117)和重度组(n=101)。病例纳入标准:①符合中华医学会妇产科学会制定的《妊娠期高血压疾病诊治指南(2015)》中早发型子痫前期诊断标准[7],孕周20~34 周;②自然受孕,单胎妊娠;③临床资料完整,患者及家属对本研究知情理解并签字。排除标准:①伴有慢性高血压、糖尿病、肾病综合征或肾小球肾炎者;②伴有乙肝病毒感染、自身免疫性疾病及甲状腺功能减退等疾病者;③近一个月有激素或免疫抑制药物用药史。病例组中,年龄20~44(31.06±3.78)岁;孕周20~34(28.85±0.52)周;体质量指数20~29(27.54±3.13)kg/m2。以同期80 例健康体检孕妇为对照组,年龄21~43(30.92±3.99) 岁;孕周20~34(29.01±0.45)周;体质量指数20~29(27.28±2.97)kg/m2。病例组与对照组在年龄、孕周、体质量指数之间比较,差异无明显统计学意义(t/χ2=0.279,0.914,0.644,均P>0.05)。经本院伦理委员会审核通过。
1.2 仪器与试剂 人ESM1,LRP1 酶联免疫吸附试剂盒(上海酶联生物科技有限公司,批号:2017706,2016903);多功能酶标仪(美国赛默飞公司,型号:Varioskan LUX);全自动生化分析仪(日立,型号:7000)。
1.3 方法
1.3.1 血清ESM1,LRP1 水平检测:采集患者入院时,对照组体检时的空腹静脉血4 ml,分离血清,采用酶标仪检测所有样品及标准品孔的450nm 处的吸光度值,绘制标准曲线,计算样品孔的浓度值,实验步骤按照试剂盒说明书进行。
1.3.2 信息收集:收集所有研究对象年龄、体质量指数、孕周、入院后第一天收缩压、舒张压、胎儿刚出生时体质量。采用沉淀法检测24h 尿蛋白定量,采用全自动生化分析仪检测血肌酐、血尿素氮及血尿酸。
1.4 统计学分析 采用SPSS 23.0 统计软件处理数据。经K-S 正态性检验和方差齐性检验符合正态分布方差齐性的计量数据以均数±标准差(±s)表示,两组组间均数比较采用两独立样本t检验。计数资料以n(%)表示,组间率的比较采用卡方检验。血清ESM1,LRP1 水平与临床指标的关系采用Pearson 相关分析。多因素Logistic 回归分析早发型重度子痫发生的影响因素。受试者工作曲线(receiver operating curve,ROC)分析血清ESM1,LRP1 及联合检测对早发型重度子痫前期的诊断价值,曲线下面积(area under the curve,AUC)比较采用Z检验。P<0.05 为差异有统计学意义。
2 结果
2.1 病例组与对照组血清ESM1 和LRP1 水平比较 病例组血清ESM1(323.05±45.17 mmol/L),LRP1(12.25±0.97μg/ml)水平高于对照组(195.20±31.67 mmol/L,6.41±0.84 μg/ml),差异具有统计学意义(t=23.291,47.677,均P<0.05)。
2.2 轻度组和重度组患者临床资料及血清ESM1 和LRP1 水平比较 见表1。重度组舒张压、收缩压、24h 尿蛋白定量、血肌酐、血尿素氮、血尿酸、血清ESM1 及LRP1 水平均高于轻度组,新生儿体质量低于轻度组,差异均有统计学意义(均P<0.05)。
表1 轻度组和重度组患者临床资料及血清ESM1,LRP1 水平比较(±s)

表1 轻度组和重度组患者临床资料及血清ESM1,LRP1 水平比较(±s)
项目轻度组(n=117)重度组(n=101)tP舒张压(mmHg)92.41±9.29 113.17±12.24 14.209 0.000收缩压(mmHg)147.25±14.66 165.19±16.63 8.631 0.000 24h 尿蛋白定量(g/24h) 1.42±0.332.63±0.45 22.833 0.000新生儿体质量(kg)3.20±0.622.73±0.645.498 0.000血肌酐(μmol/L) 69.64±15.07 74.47±20.82 1.980 0.000血尿素氮(mmol/L)3.95±0.914.32±0.783.196 0.000血尿酸(μmol/L) 303.82±41.71 339.65±50.13 5.760 0.000 ESM1(pg/ml)551.74±72.20 672.44±83.61 11.438 0.000 LRP1(μg/ml)9.63± 0.89 14.52 ±1.05 37.978 0.000
2.3 血清ESM1,LRP1 水平与临床指标的相关性分析 见表2。病例组患者血清ESM1 和LRP1 水平均与舒张压、收缩压、24h 尿蛋白定量、血肌酐、血尿素氮及血尿酸呈正相关,与胎儿体质量呈负相关(均P<0.05)。
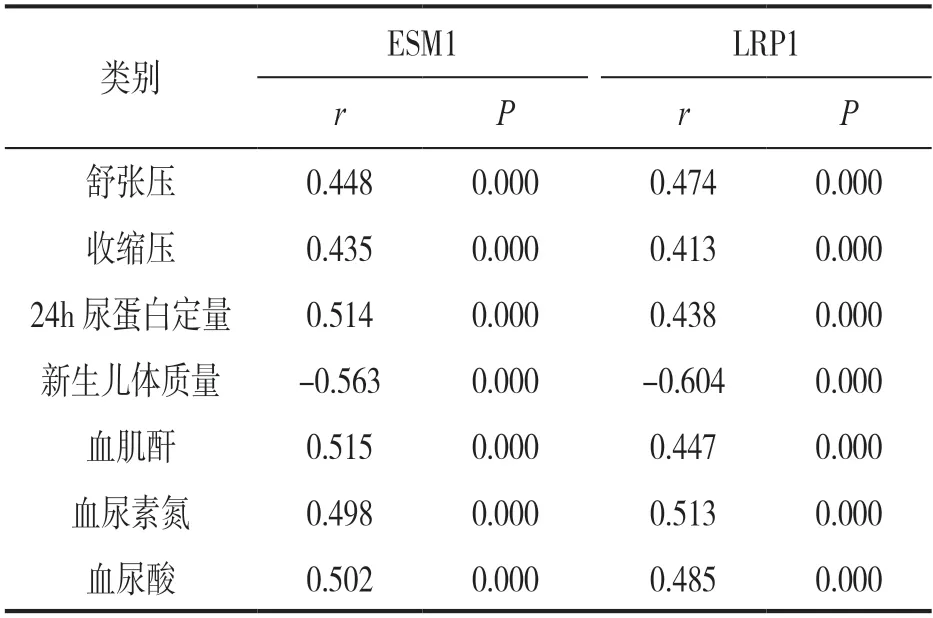
表2 血清ESM1,LRP1 水平与病例组患者临床指标的相关性
2.4 影响子痫前期严重程度的多因素Logistic 回归分析 见表3。以是否发生早发型重度子痫前期为因变量(是=1,否=0),以舒张压、收缩压、24h尿蛋白定量、血肌酐、血尿素氮、血尿酸、血清ESM1 及LRP1 为自变量,建立多因素逐步Logistic回归模型,逐步排除舒张压、收缩压、24h 尿蛋白定量、血肌酐、血尿素氮和血尿酸,显示高血清ESM1 及高LRP1 水平是影响早发型重度子痫前期发生的独立危险因素(均P<0.05)。

表3 影响子痫前期严重程度的多因素Logistic回归分析
2.5 血清ESM1 联合LRP1 对早发型重度子痫前期的诊断价值 见表4,图1。血清ESM1 联合LRP1 检测诊断早发型重度子痫前期的AUC 大于ESM1,LRP1单独诊断(Z=6.752,4.297,均P<0.05)。
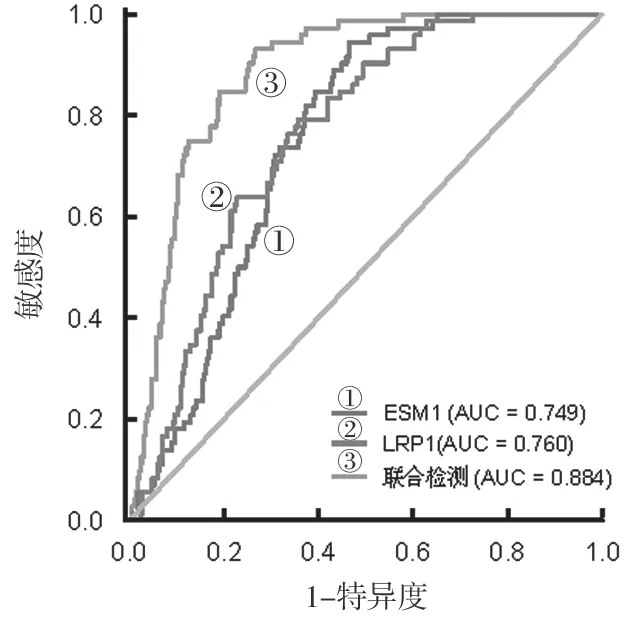
图1 血清ESM1 联合LRP1 诊断早发型重度子痫前期的ROC 曲线
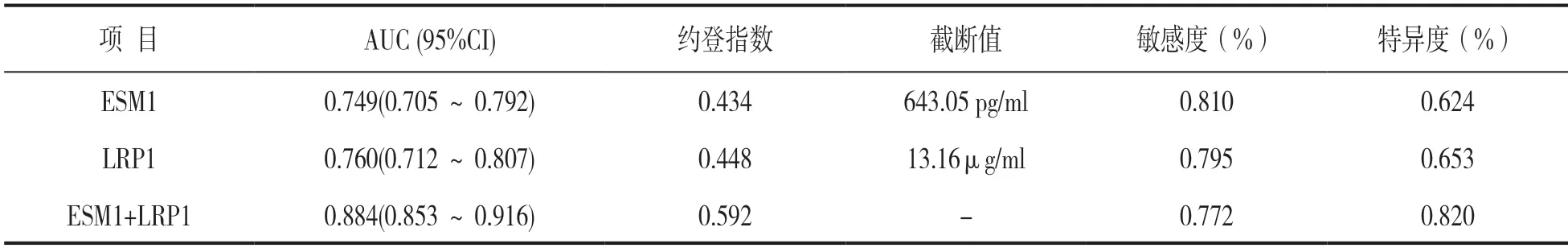
表4 ESM1 联合LRP1 对早发型重度子痫前期的诊断价值
3 讨论
子痫前期是妊娠期高血压疾病,34 周之前发生的子痫前期为早发型。早发型重度子痫前期起病早、病情进展快速、持续时间长,严重威胁母婴健康。目前早发型子痫前期疾病机制尚不清楚,目前认为与血管内皮细胞受损、脂代谢功能紊乱、过度炎症反应及螺旋动脉重铸不足等因素有关[8]。临床上通过监测患者血压、24h 尿蛋白定量等肾功能指标有助于反映早发型子痫前期疾病严重程度,但不同患者临床表现差异较大,靶器官损害各不相同。因此,深入研究子痫前期的疾病机制,寻找能够反映早发型子痫前期疾病发生发展的血清标志物,有利于临床早期诊治,改善患者临床预后。
ESM1 是一种可溶性硫酸皮肤素蛋白聚糖,由胎盘等组织血管内皮细胞合成,参与细胞增殖、迁移及血管生成等生物学过程[9]。研究发现,ESM1能够诱导肺动脉内皮细胞发生上皮间质转化,促进肿瘤坏死因子α 和白介素1β 的分泌,导致肺动脉高压的发生[10]。早发型子痫前期患者滋养细胞浸润能力下降,血管管径小,胎盘灌流量降低,导致胎盘小动脉重铸障碍及缺氧的发生。WATANABE等[11]报道,缺氧条件能够诱导血管内皮细胞中缺氧诱导因子α 的表达,缺氧诱导因子α 通过结合ESM1 基因启动子区域的缺氧反应元件,促进ESM1 基因的表达,导致血管内皮细胞功能失调,这与本研究结果中观察到的早发型子痫前期患者血清ESM1 升高一致。此外,血清ESM1 升高与早发型子痫前期患者疾病严重程度有关。JIN 等[12]研究发现,血管内皮细胞中ESM1 的表达能够促进血管内皮生长因子的表达,增加血管通透性,促进单核巨噬细胞的浸润,加重组织炎症反应,而敲低ESM-1 的表达可降低血管内皮细胞的活化,减少血循环中的白细胞等黏附到血管内皮细胞,减轻组织炎症反应。因此,ESM1 可能通过加重胎盘组织炎症和血管内皮细胞功能障碍,导致早发型子痫前期疾病的发生发展。本研究中,ESM1 升高是影响早发型重度子痫前期发生的独立危险因素。KIM 等[13]研究发现,ESM1 能够促进血管内皮细胞表面细胞间黏附分子1 的表达,其可通过结合白细胞表面整合素受体淋巴细胞功能相关抗原1,招募循环外周血中单核细胞、巨噬细胞与血管内皮细胞的黏附,促进单核巨噬细胞的局部浸润,导致早期重度子痫前期的发生。此外,ESM1 作为一种内皮细胞活化的标志,其表达升高能够激活凝血系统,微小血管栓子导致胎盘血流微循环障碍,导致胎儿生长受限的发生,这与本研究结果报道一致。因此,ESM1作为一种新的血清标志物,有助于评估早发型重度子痫前期的发生风险。
近年来发现,子痫前期患者胎盘床存在急性动脉粥样硬化的现象,病理上主要表现为血管壁纤维素样坏死,内皮下存在泡沫细胞的积聚,血管周围存在大量单核细胞的浸润[14-15]。TU 等[6]学者发现早发型子痫前期患者血清异常表达的基因富集于凝血和补体系统激活及脂质代谢通路。本研究结果中,早发型子痫前期患者血清LRP1 水平升高,这与YANG 等[16]学者在胎盘组织中也观察到的LRP1 表达上调结果报道一致。早发型子痫前期患者血清LRP1 水平升高与胎盘缺氧有关。THOMAS等[17]发现,由于早发型子痫前期患者子宫螺旋小动脉灌注不良,组织缺血缺氧伴随氧化应激,缺氧诱导因子1α 表达上调,其通过结合LRP1 基因启动子区促进LRP1 的表达。此外,本研究中LRP1与早发型子痫前期疾病严重程度有关,提示LRP1能够加重早发型子痫前期疾病严重程度。分析其机制,一方面是LRP1 表达升高能够导致胎盘血管内皮细胞脂质沉积,脂肪酸氧化能力降低,脂质过氧化引起内皮细胞损伤及功能障碍,导致子痫前期疾病的发展[18]。另一方面,LRP1 参与介导低密度脂蛋白聚集内吞,该过程能够促进细胞中的胆固醇酯的积累,抑制胰岛素受体的激活及下游信号传导,胰岛素抵抗发生后激活肾素-血管紧张素-醛固酮系统,缩血管物质如前列环素等导致血管收缩、舒张功能下降、水钠潴留,导致血压升高,加重子痫前期的疾病严重程度[19-20]。本研究中,LRP1 升高是影响早发型重度子痫前期发生的独立危险因素。GARCÍA-GÓMEZ 等[21]报道,LRP1 引起的胰岛素抵抗导致机体脂代谢功能紊乱,脂质沉积于小动脉壁,动脉粥样硬化和血管平滑肌的增生,大量炎症因子释放,加重组织损伤,导致子痫前期疾病发生发展。因此,血清LRP1 可能作为一种新的早发型子痫前期血清标志物,其表达升高参与早发型子痫前期疾病的发生发展。
子痫前期是多系统综合征,病因和机制复杂,本研究基于对近年来报道的高通量筛选结果进行验证[4,6],发现高血清ESM1 和LRP1 水平是早发型重度子痫前期发生的独立危险因素,提示血清ESM1,LRP1 升高可增加早发型重度子痫前期的疾病发生风险。血清ESM1 联合LRP1 检测对早发型重度子痫前期的诊断效能较高,提示联合检测可提高早发型重度子痫前期的诊断价值。临床医生可通过检测血清ESM1,LRP1 水平,对早发型重度子痫前期的发生风险进行评估,对于高危孕产妇,予以积极诊治及随访观察,以改善患者的临床预后。
综上所述,早发型子痫前期患者血清ESM1 和LRP1 升高,二者均与早发型子痫前期疾病严重程度有关,联合检测能提高早发型重度子痫前期的诊断效能。本研究也存在一定的不足之处,本研究未对早发型子痫前期患者在治疗过程中血清ESM1,LRP1 的动态变化及与妊娠结局的关系进行观察,有待今后设计前瞻性临床随机对照研究深入探索。

