mCIM和碳青霉烯酶抑制剂增强试验检测CRE和CRPA产酶表型的方法学评价
尚佳文,徐文娜,许南松,刘晓敏,曾秋耀,郑 炘(.广东医科大学医学技术学院,广东东莞 53808;.中山大学肿瘤防治中心检验科,华南肿瘤学国家重点实验室肿瘤医学协同创新中心,广州 50060)
细菌耐药一直是全球卫生健康领域面临的重大挑战,在目前临床医治G-菌感染的药物选择中,碳青霉烯类抗生素仍是最有效的抗生素之一。根据CHINET 中国细菌耐药监测网的数据分析,亚胺培南和美罗培南在普通G-菌中的抗菌效果相近,但二者均属广谱抗生素,滥用极易造成细菌耐药。近年来,由于广谱抗生素的广泛使用,导致了耐碳青霉烯类肠杆菌目细菌(carbapenem-resistantEnterobacterales,CRE)和耐碳青霉烯类铜绿假单胞菌(carbapenem-resistantPseudomonasaeruginosa,CRPA)的检出率呈逐年上升趋势,根据吴义娟等[1]人于2021年的研究统计,国内外CRE 检出率均逐年递增,并且CRE 感染后的死亡率高达50%。
CRE 与CRPA 的耐药机制复杂多样,其中肠杆菌目细菌对β-内酰胺类抗生素的主要耐药机制是产超广谱β-内酰胺酶和碳青霉烯酶[2],而铜绿假单胞菌的耐药机制更加复杂,主要表现在生物膜形成、外排系统过度表达、产碳青霉烯酶等方面[3]。目前用于治疗感染的新的抗生素:头孢他啶/阿维巴坦(CZA)对产KPC 和OXA-48 型丝氨酸碳青霉烯酶的菌株具有较高的抑菌作用,而对生产B类金属-β-内酰胺酶的菌株则没有抑菌作用[4]。此外,目前正处于研究阶段的亚胺培南/雷利巴坦(imipenem/relebactam)[5]和美罗培南/韦博巴坦(meropenem/vaborbactam)[6]对产金属β-内酰胺酶以及OXA-48 型碳青霉烯酶的菌株无抗菌活性,但对产KPC 型碳青霉烯酶的菌株有较强的抗菌活性。实验室准确、迅速地检测和分类耐碳青霉烯菌株中的碳青霉烯酶是治疗过程中非常关键的一步[7]。本研究通过对实验室常用的mCIM 和增强试验进行多方位比较,并用新型胶体金法进行结果比对,以期得出更适用于临床实验室广泛使用的检测方法,以供参考。
1 材料和方法
1.1 菌株来源 本研究菌株均来自中山大学肿瘤防治中心2019~2022年临床分离的47 株CRE 和42株CRPA,其中CRE 菌株包括22 株大肠埃希菌、13 株肺炎克雷伯菌、4 株阴沟肠杆菌、3 株产气肠杆菌、3 株产酸克雷伯菌和2 株阴沟肠杆菌复合群。全部菌株均用全自动微生物分析仪进行鉴定及药物敏感性测试。所有菌株均采用干燥纸片法保存并存放于-80℃冰箱保存备用。阴性对照所用的大肠埃希菌ATCC25922,铜绿假单胞菌ATCC27853 标准菌株来自国家卫生健康委员会临床检验中心。
1.2 仪器与试剂 VITEK2-compact 全自动微生物分析仪(法国梅里埃生物公司);1μl 和10μl定量接种环(标普生物);亚胺培南和美罗培南(10μg/片)药敏纸片(英国OXOID 公司);血平板、MH 培养液、肉汤培养液(TSB)(广州市迪景微生物科技有限公司);APB-EDTA 缓冲液(上海原科实业发展有限公司);VIM,KPC,NDM,OXA-23,IMP,OXA-48 胶体金试剂(北京金山川科技发展有限公司)。
1.3 方法
1.3.1 纸片扩散法复核:按类别分为CRE 和CRPA两组分批次进行检测,复苏保存的菌株经纸片扩散法(K-B 法)复核CRE 和CRPA 耐药情况,K-B法试验标准和结果判读标准根据2020版CLSI M100执行。
1.3.2 mCIM 检测碳青霉烯酶:CRE 与CRPA 分别作为实验组,大肠埃希菌ATCC25922 和铜绿假单胞菌ATCC27853 标准菌株作阴性对照,严格按照CLSI 操作标准进行,结果判读标准:抑菌圈直径6~15 mm 或在16~18 mm 抑菌圈内有针尖样菌落为碳青霉烯酶阳性;抑菌圈直径≥19 mm 为碳青霉烯酶阴性;抑菌圈直径16~18 mm 或抑菌圈直径≥19 mm 抑菌圈内存在针尖样菌落为碳青霉烯酶不确定。
1.3.3 碳青霉烯酶抑制剂增强试验:检测酶型实验组和对照组同上,将0.5 麦氏浊度目标菌悬液涂布于MH 平板,干燥后贴4 张亚胺培南纸片编号A,B,C,D。纸片A:不加任何液体(空白对照);纸片B:滴加10μl EDTA 溶液;纸片C:滴加10μl 3-氨基苯硼酸(APB)溶液;纸片D:滴加APB 和EDTA 溶液各10μl。35℃过夜孵育后量取结果。结果判读标准: 纸片B 抑菌圈直径与A 相差≥5mm,则该菌株产B 类碳青霉烯酶;纸片C 抑菌圈直径与A 相差≥5mm,则该菌株产A类碳青霉烯酶;如仅纸片D 抑菌圈直径与A 相差≥5mm,则该菌株同时产A 类碳青霉烯酶和B 类金属β 内酰胺酶;如纸片B,C,D 抑菌圈直径与A 相差均<5mm,则该菌不产A 或B 类碳青霉烯酶。
1.3.4 胶体金法验证结果:实验组为CRE,对照组为大肠埃希菌ATCC25922 标准菌株。参照说明书步骤进行操作并按说明书结果标准进行判读。
1.4 统计学分析 mCIM 和碳青霉烯酶抑制剂增强试验的结果资料及胶体金法分别对两种方法进行验证的结果资料均属于自身配对设计方案,为比较两种测定方法结果是否有差别,应采用配对χ2检验。利用SPSS 26.0 统计分析软件进行Pearsonχ2检验分析,检验水准α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 待测菌对碳青霉烯类耐药情况 K-B 法复核结果与VITEK2-compact 所用的MIC 法基本一致,菌株均可入组。
2.2 mCIM 检测碳青霉烯酶结果 见表1,检测部分结果见图1。根据CLSI 标准判读,得到mCIM检测CRE 中的碳青霉烯酶阳性率为70.2%,不确定为25.5%,阴性率为4.3%;检测CRPA 得碳青霉烯酶的阳性率为35.7%,阴性率为52.4%,11.9%不确定。

表1 mCIM 对47 株CRE 和42 株CRPA 的检测结果[n(%)]

图1 mCIM 改良碳青霉烯酶灭活试验图
2.3 增强试验检测碳青霉烯酶结果 根据增强试验结果判读标准,47 株CRE 中,产B 类金属β-内酰胺酶占44.7%,不产A 类或B 类碳青霉烯酶占38.3%;42 株CRPA 中,产A 类碳青霉烯酶占90.4%,同时产A 类碳青霉烯酶和B 类金属β-内酰胺酶占4.8%,不产A 类或B 类碳青霉烯酶占2.4%。
2.4 mCIM 与碳青霉烯酶抑制剂增强试验结果比对配对设计χ2检验比较47 株CRE mCIM 与增强试验结果得到P<0.05,按α=0.05 水准,差异具有统计学意义(χ2=17.803,P=0.01),即两种方法结果存在差异,且mCIM 法检出率高于增强试验,两种方法检测阳性符合率为53.2%;比较42 株CRPA mCIM 与增强试验结果,得到P>0.05,按α=0.05水准,差异无统计学意义(χ2=4.632,P=0.592),即两种方法结果无差异,两种方法检测阳性符合率为35.7%。
2.5 胶体金法检测47 株CRE 进行验证 部分结果见图2,数据见表2。检测47 株CRE 得到产NDM型20 株(42.6%),产KPC 型4 株(8.5%),产IMP 型1 株(2.1%),产OXA-48 型1 株(2.1%),21 株(44.7%)阴性。胶体金结果与mCIM 结果进行比对,阳性符合率为84.6%(22/26),与增强试验结果进行比对,产金属酶的阳性符合率为100%(21/21),产丝氨酸酶的阳性符合率为80%(4/5)。
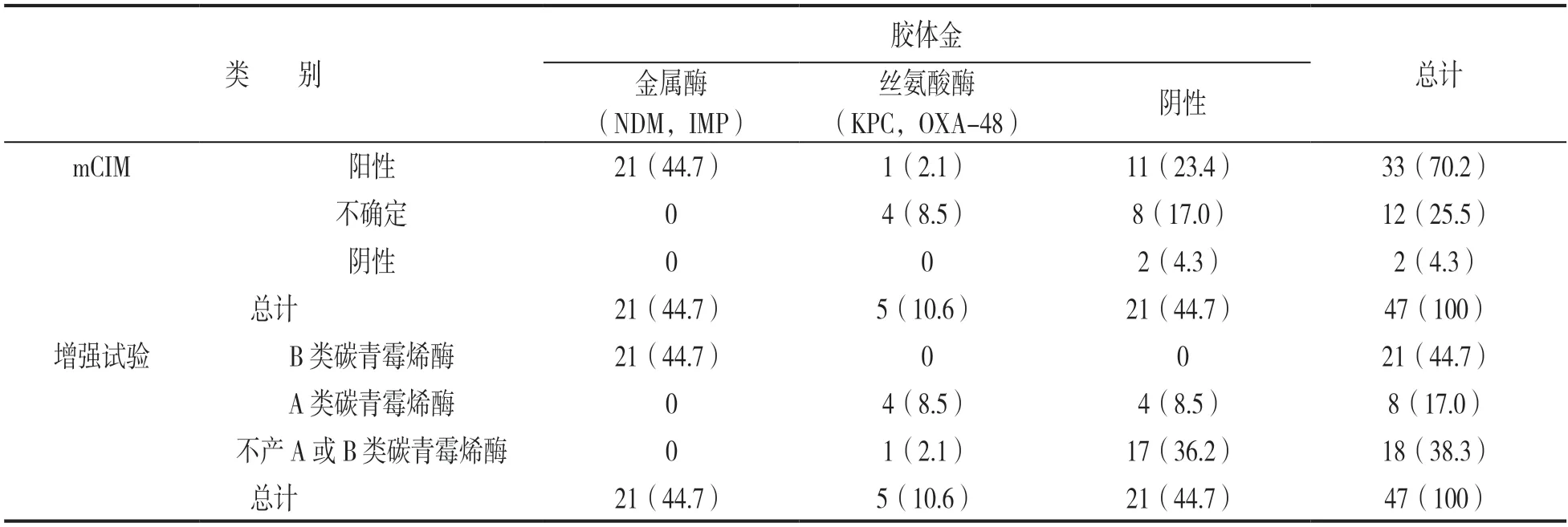
表2 CRE 的mCIM 和增强试验与胶体金结果比对结果[n(%)]
图2 胶体金结果图
3 讨论
据CHINET 2020年公布的统计结果,肠杆菌目中肺炎克雷伯菌对碳青霉烯类药物的平均耐药率已经上升到了25.7%,铜绿假单胞菌对其的平均耐药率28.3%,且耐药性比例均逐年增加[8]。产碳青霉烯酶是导致肠杆菌目细菌和铜绿假单胞菌对碳青霉烯类药物产生耐药的主要原因[3],且为了加快新的抗生素在临床治疗中的推广,要求临床微生物实验室要进一步了解耐碳青霉烯类菌株是否产碳青霉烯酶及其型别,从而使用药更有针对性,故找到一种快速、准确、重复性好且价格适中的检测方法至关重要。
目前,实验室多采用mCIM 法或结合eCIM 法对菌株产酶及其表型进行常规测定,但mCIM 不能区分酶型,eCIM 需额外试剂,也存在不能区分具体型别等弊端,且两种方法所需温育时间较长,不利于早期产酶的诊断[9]。本次研究发现,mCIM 对于CRPA 的检出率较低(35.7%),如谢国艳等[10]人报道mCIM 对产金属β-内酰胺酶的铜绿假单胞菌的阳性检出率仅为11.9%,李军等[11]人发现mCIM 检测碳青霉烯酶基因阳性的铜绿假单胞菌得到的实验结果均为阴性,这是因为铜绿假单胞菌对碳青霉烯类抗生素常表现为多种耐药机制共存的形式[12],说明单一mCIM 法不适用于CRPA 产酶的检出。同时在本次mCIM 法判定过程中发现,CRPA的抑菌圈边缘内侧有均匀致密的针尖样物质,见图3。该物质的存在影响抑菌圈直径量取,导致主观误差增大,而mCIM 法测CRE 无该物质干扰,综上所述,推荐用mCIM 法检测CRE,不建议用该方法检测CRPA。

图3 mCIM 测CRPA 中出现的边缘致密针尖样物
增强试验利用酶抑制剂硼酸(APB)抑制KPC酶活性,EDTA 抑制金属酶活性原理,从而区分金属酶和丝氨酸酶,但增强试验不能检测D 类OXA-48 型碳青霉烯酶且APB 对高产AmpC 酶合并膜孔蛋白缺失的菌株假阳性[13]。临床微生物实验室可根据碳青霉烯酶不同型别特征,开展联合药敏试验以供临床制定更为精准的治疗方案,如金属β-内酰胺酶不能水解氨曲南,阿维巴坦、韦博巴坦能抑制产KPC 型碳青霉烯酶的菌株活性等[14]。此外,不同酶抑制剂的抑酶活性也不同,如阿维巴坦对三乙烯二胺类的抑酶效果可逆,且对A,C,D 类β 内酰胺酶有抑菌作用,对B 类β-内酰胺酶无抑菌作用[15],提示临床可以根据不同酶抑制剂的不同抑酶活性建立针对性更强的治疗方案。
胶体金法采用的酶免疫层析技术被定义为检测碳青霉烯酶的金标法[9]。但因CRPA 耐药机制复杂,常出现多种耐药机制共存现象,TENOVER 等[12]人的研究表明CRPA 除产碳青霉烯酶、高表达OprD 基因外,还存在其他例如AmpC 酶生产过剩和OprD 外膜蛋白缺乏活力等耐药机制,并且随着碳青霉烯类药物进一步的选择压力,其他耐药机制也可能出现,故本研究未对CRPA 进行胶体金验证实验。本研究中47 株CRE 中 mCIM,增强试验与胶体金比对结果说明三种方法均适用,但要警惕胶体金法若待测基因和目标基因不符则会产生假阴性结果。
综合来看,对于CRE 菌株三种方法各有优缺,mCIM 法所需材料价格相对低廉,但所需温育时间较长,操作较为复杂,培养孵育共需要28h,时间成本高,若一菌株同时产丝氨酸型碳青霉烯酶和金属β 内酰胺酶会导致结果假阴性;增强试验需要额外购买EDTA 和APB 碳青霉烯酶抑制剂,操作较mCIM 法简单,但仍需要过培养,且不能检测D 类OXA-48 型碳青霉烯酶;胶体金法虽然具有简便、快速、精确、结果易读的特点,但试剂价格昂贵,临床选取检测方法时应结合实际,如危重症患者需要快速得到CRE 产酶表型时,推荐用胶体金,方便临床快速确定感染治疗方案进行救治。对于CRPA,虽然CLSI 中说明mCIM 方法适用于CRPA,但此次研究发现,量取结果时内缘均匀致密的针尖样物质的存在会导致结果出现偏差,增强试验阳性检出率较高,更推荐使用。
综上所述,要控制多重耐药的检出,需对碳青霉烯等广谱抗生素施行更严格的用药制度,而临床微生物实验室需不断探讨、比较,采用高效优质的检验方法,为临床提供快、精、准的用药依据,让危重感染患者更快得到有效治疗。

