血清LncRNA MALAT1表达水平对EB病毒感染相关胃癌的诊断和预后价值研究
蔡 梦,阎汉英,王晓静(河北北方学院附属第一医院消化内科,河北张家口 075000)
胃癌(gastric carcinoma,GC)在中国所有恶性肿瘤中的发病率位居第二位[1-2],是全球癌症死亡的第三大原因[3]。EB 病毒相关胃癌(EBV-associated gastric carcinoma,EBVaGC)是一种与EBV感染相关的常见恶性肿瘤。根据地理分布,EBVa-GC 约占所有胃癌的1.3%~30.9%,全球平均占所有胃癌的8.9%,每年约有75 000 例新诊断[4-5]。因此,寻找有效的分子靶点以促进对EBVaGC 患者的诊断及预后非常重要。长链非编码RNA(long non-coding RNAs,LncRNAs)是不编码蛋白质的功能性RNA[6]。新出现的证据表明LncRNA 与GC肿瘤发生和进展密切相关[7]。LncRNA 肺腺癌相关转录物1(metastasis-associated lung adenocarcinoma tran 1,MALAT1)长6.5 kb,最初发现于肺肿瘤组织中[7]。研究表明LncRNA MALAT1 在多种肿瘤组织中呈高表达,包括胃癌组织[9]。但其在EBVaGC患者血清中的表达及其诊断与预后评估价值尚不明确,基于此,本研究通过检测EBVaGC 患者血清中LncRNA MALAT1 的表达情况,探讨其对EBVaGC疾病的诊断以及预后评估价值,以期为EBV 相关胃癌的诊断、治疗提供一定参考依据。
1 材料与方法
1.1 研究对象 选取2015年1月~2017年1月河北北方学院附属第一医院消化内科收治的233 例患者为研究对象,采集各组外周静脉血并采用荧光定量PCR 法检测EBV-DNA,并根据EBV DNA 结果将患者分为EBV DNA 阳性组(n=123),男性96例,女性27 例,年龄38~79(62.35±8.59)岁;EBV DNA 阴性组(n=110),男性75 例,女性25例,年龄38~78(61.29±8.21)岁;同时选取在本院进行健康体检的志愿者100 例为对照组,其中男性68 例,女性32 例,年龄38~78(61.95±7.66)岁,三组年龄、性别比较,差异均无统计学意义(均P>0.05)。纳入标准:①所有受试者均经组织病理学确诊;②EBVaGC 患者均为幽门螺旋杆菌阴性;③未接受任何术前治疗;④健康体检人群EB 病毒检测均为阴性。排除标准:①继发性恶性肿瘤;②存在严重的心脏病,如急性心肌梗死、心律失常和心力衰竭;③存在全身性疾病,如肝衰竭、多器官功能障碍综合征和慢性肾病;④临床资料不完整者。研究经过我院道德伦理委员会批准通过,样品采集均获得所有参与者的知情同意,符合《世界医学协会赫尔辛基宣言》。
1.2 仪器与试剂 Trizol 试剂[赛默飞世尔科技(中国)有限公司,货号:15596026],Prime Script II 1st Strand cDNA 合成试剂盒(上海百赛生物技术股份有限公司,货号:RR055B),SYBR Premix Ex Taq 试剂盒(武汉科昊佳生物科技有限公司,货号:RR420A),Bio-Rad Real-Time PCR System(美国Applied Biosystems 公司)。
1.3 方法
1.3.1 标本采集:所有研究对象均于清晨空腹状态下采集静脉血4~5 ml,常规静置30 min,在3 000 r/min 条件下离心10 min,分离提取上层血清,置于低温冰箱中,-80℃保存待测。
1.3.2 qRT-PCR 法检测血清中LncRNA MALAT1水平:根据制造商的说明,使用Trizol 提取试剂盒从血清中提取总RNA。用Prime Script II 1st Strand cDNA 合成试剂盒(TaKaRa Bio)对总RNA 进行逆转录合成cDNA。
使用SYBR Premix Ex Taq(TliRNase H Plus;TaKaRa Bio)试剂盒在Bio-Rad Real-Time PCR System(Bio-Rad,美国)上进行qRT-PCR 测定。PCR反应条件为:95℃ 15 min;95℃ 10 s,60℃ 20 s,40 个循环。以GAPDH 为内参基因,采用2-ΔΔCt方法对血清中LncRNA MALAT1 表达水平进行相对定量分析。PCR 引物序列: LncRNA MALAT1 正向引物5’- TGGGATGGTCTTAACAGGGA-3’,反向引物5’-CCTGAAGGTGTTCGTGCCAA-3’,GAPDH 正向引物5’- AGAAGGCTGGGGCTCATTTG-3’,反向引物5’- AGGGGCCATCCACAGTCTTC-3’。
1.3.3 随访:每3 个月以门诊或电话的形式进行一次定期随访,询问记录患者的生存时间,随访开始时间从出院起计算,随访时间为5年,截止时间为2022年1月,终点事件定义为患者死亡。
1.4 统计学分析 通过SPSS 22.0进行统计学分析,计量资料经正态分布和方差齐性检验后表示为均数±标准差(±s),组间比较行t检验;计数资料表示为n,组间比较采用χ2检验,多组数据比较利用单因素方差分析,进一步两两比较进行SNK-Q分析;利用受试者工作特征(receiver operating characteristic,ROC)曲线评价LncRNA MALAT1水平对EBVaGC 的预测价值;Kaplan-Meier 法分析不同LncRNA MALAT1 表达水平与患者生存时间的关系,并绘制生存曲线;多因素COX 回归风险模型分析EBVaGC 患者的预后影响因素。P<0.05 为差异有统计学意义。
2 结果
2.1 EBVaGC 患者血清中LncRNA MALAT1 的表达 研究结果显示EBV DNA 阳性组EBVaGC 患者血清中LncRNA MALAT1 表达水平(1.27±0.03)高于EBV DNA 阴性组患者(1.12±0.05)和健康对照组(0.96±0.04),差异具有统计学意义(F=1 620.239,P<0.05)。
2.2 血清中LncRNA MALAT1 表达与EBVaGC 患者临床病理参数的相关性研究 见表1。LncRNA MALAT1 在EBVaGC 患者血清中的表达与患者年龄、主癌位置、脉管癌栓、肿瘤直径、肿瘤组织学类型、神经侵犯、浸润深度无关(均P>0.05),与性别、分化程度、淋巴结转移、TNM 分期、Lauren 分型有关(均P<0.05)。
表1 EBVaGC 患者血清中LncRNA MALAT1 表达与临床病理参数的相关性(n=123,±s)

表1 EBVaGC 患者血清中LncRNA MALAT1 表达与临床病理参数的相关性(n=123,±s)
类 别 nLncRNA MALAT1 相对表达量t/FP性别男961.28±0.046.2650.000女271.23±0.02年龄(岁)>50581.28±0.051.4850.140≤50651.27±0.02主癌位置胃食管结合部141.26±0.02 1.3200.271胃底、胃体391.27±0.03胃窦641.27±0.03全胃、残胃61.29±0.06分化程度低分化871.31±0.0417.1070.000中+高分化361.19±0.02淋巴结转移是711.30±0.0312.7840.000否521.23±0.03 TNM 分期Ⅰ+Ⅱ期331.12±0.0129.7480.000Ⅲ+Ⅳ期901.33±0.04脉管癌栓有741.27±0.021.5460.125无491.28±0.05肿瘤直径(cm)<5.5481.27±0.031.8030.074≥5.5751.28±0.03肿瘤组织学类型伴淋巴样间质癌51.29±0.021.4740.143非伴淋巴样间质癌1181.27±0.03 Lauren 分型肠型211.25±0.02弥漫型451.28±0.03混合型321.27±0.02未分型251.28±0.05神经侵犯有641.28±0.041.7310.086无591.27±0.02浸润深度<T2111.29±0.051.9700.051≥T21121.27±0.03 4.8800.003
2.3 LncRNA MALAT1 对EBVaGC 患者的诊断价值分析 见图1。以EBV DNA 阳性为因变量,以LncRNA MALAT1 表达水平为自变量进行ROC 曲线分析,结果显示,LncRNA MALAT1 预测EBVa-GC 患者的AUC 为0.863(95%CI:0.811~0.906),截断值为:>1.21,对应的敏感度为92.68%,特异度为81.00%。

图1 血清LncRNA MALAT1 水平对EBVaGC诊断价值的ROC 曲线
2.4 EBVaGC 患者血清LncRNA MALAT1 水平与预后的关系 随访过程中无失访病例,随访期间生存56 例,LncRNA MALAT1 以中位数为临界值,超出该范围判定为高表达,低于该范围定义为低表达。其中高表达者共78 例,低表达者45 例。
绘制五年生存曲线,Kaplan-Meier 分析结果显示,LncRNA MALAT1 高表达组患者五年累积生存率34.62%(27/78),平均生存时间36.84±19.40个月,显著低于低表达组57.78%(26/45),平均生存时间46.35±18.18 个月,差异有统计学意义(Log rankχ2=6.944,P=0.008)。见图2。
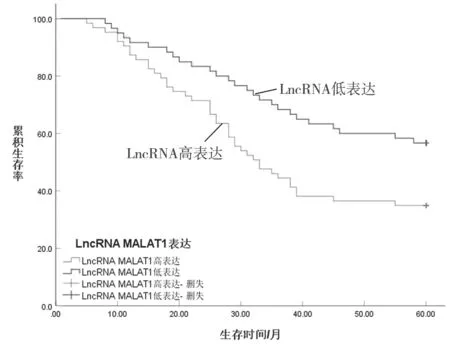
图2 EBVaGC 患者血清LncRNA MALAT1 水平与预后的关系
2.5 影响EBVaGC 患者预后的单因素和多因素COX 回归分析 见表2。以EBVaGC 患者是否死亡为因变量(未死亡=0,死亡=1),以年龄、主癌位置、脉管癌栓、肿瘤直径、肿瘤组织学类型、神经侵犯、浸润深度、性别、分化程度、淋巴结转移、TNM 分期、Lauren 分型为自变量进行单因素分析,结果显示年龄、分化程度、淋巴结转移、TNM 分期、Lauren 分型、LncRNA MALAT1 均与EBVaGC 患者预后相关(P<0.05)。进一步行多因素COX 回归分析,年龄(>50=1,≤50=0)、分化程度(G2/G3=0,G1=1)、淋巴结转移(无=0,有=1)、TNM 分期(Ⅰ+Ⅱ=0,Ⅲ+Ⅳ=1)、Lauren 分型(其他=0,弥漫型=1)、LncRNA MALAT1(低表达=0,高表达=1)为自变量,结果显示年龄、分化程度、淋巴结转移、TNM 分期、LncRNA MALAT1 高表达均是影响EBVaGC 患者生存状况的独立危险因素(P<0.05),见表3。
表2 影响EBVaGC 患者预后的单因素分析(±s)

表2 影响EBVaGC 患者预后的单因素分析(±s)
死亡(例)类别n t/FP是否n=56性别男96 50461.006 0.316女27 1710年龄(岁)>5058 203817.682 0.000≤5065 4718主癌位置胃食管结合部1486 0.330 0.954 n=67胃底、胃体39 2019胃窦64 3628全胃、残胃633分化程度低分化87 41466.466 0.011中+高分化36 2610淋巴结转移是71 264521.581 0.000否52 4111 TNM 分期Ⅰ+Ⅱ期33 2588.240 0.004Ⅲ+Ⅳ期90 4248脉管癌栓有74 40340.013 0.909无49 2722肿瘤直径(cm)<5.548 30182.046 0.153≥5.575 3738肿瘤组织学类型 伴淋巴样间质癌5230.440 0.507非伴淋巴样间质癌 118 6553 Lauren 分型肠型21 156 8.084 0.044弥漫型45 1827混合型32 1815未分型25 178神经侵犯有64 39250.158 0.691无59 3821浸润深度<T211560.396 0.529≥T2112 6250 LncRNA MALAT1 高表达63 41225.860 0.015低表达60 2634
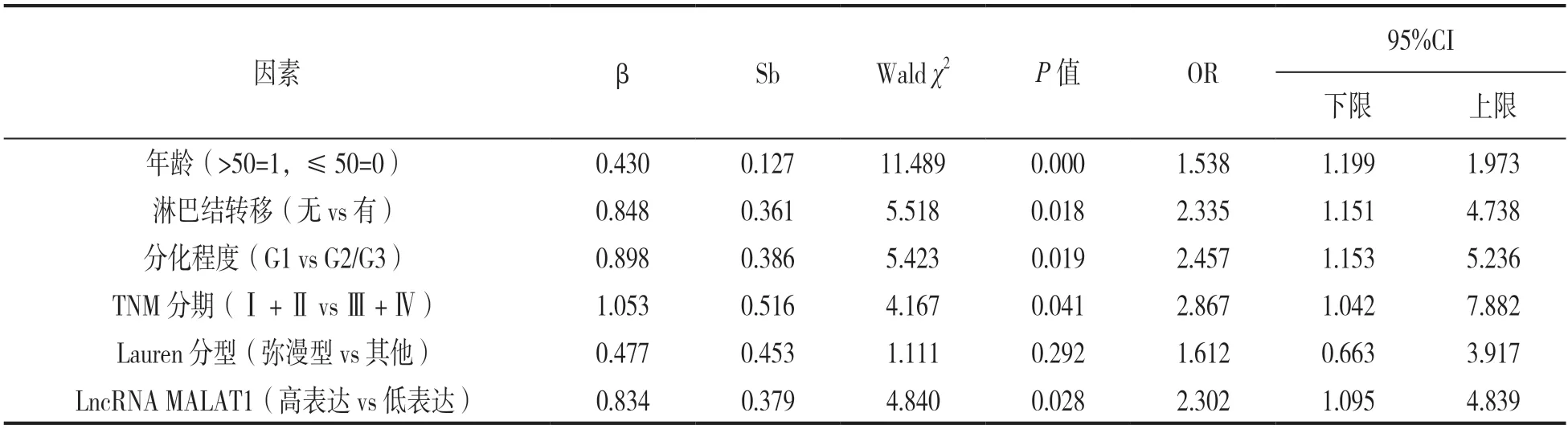
表3 影响EBVaGC 患者预后的COX 回归分析
3 讨论
EBV 是一种双链DNA 病毒,是第一个被发现与多种人类癌症相关的病毒,包括淋巴瘤、鼻咽癌和胃癌(EBVaGC)等[10-11]。其中EBVaGC 每年的发病率为75 000~90 000 例,是EBV 相关肿瘤中最大的亚群,其中位生存期仅为8.5年[12]。但目前EBVaGC 的发病机制尚不明确,部分EBVaGC 患者难以被准确诊断,预后较差,因此急需选择有效可靠的指标评估EBVaGC 患者疾病及预后。
LncRNA 在免疫反应、血管生成、细胞增殖、凋亡、自噬、细胞迁移和侵袭等多种生物学过程中发挥着重要的作用[13]。多项研究表明,LncRNA 也可以调节和被肿瘤免疫微环境调控,使LncRNA 成为潜在的生物标志物和治疗靶点,从而可以改善GC 的管理和治疗。例如,血浆LncRNA H19 已在GC 中得到鉴定,可作为GC 诊断的潜在生物标志物[13]。已证明位于染色体11q13 上的MALAT1 与各种类型的肿瘤有关[15]。据报道LncRNA MALAT1在多种癌症中过表达,并调节癌细胞的增殖、迁移、侵袭和凋亡[16]。最近的研究表明,LncRNA MALAT1 通过激活自噬,在胶质瘤和卵巢癌中促进增殖和侵袭[17-18]。此外,LncRNA MALAT1 通过调节肝细胞癌、弥漫性大B 细胞淋巴瘤和GC 中的自噬来调节化疗耐药性[18,20]。在本研究中,EBVaGC 患者血清中LncRNA MALAT1 表达较EBV DNA 阴性胃癌患者及健康人群中均明显升高,表明LncRNA MALAT1 可能在EBVaGC 疾病中发挥促癌基因的重要作用,分析其原因可能是LncRNA MALAT1 通过多种调控因子及途径影响下游基因表达,进一步促进肿瘤的发生、发展,但其具体机制还需进一步研究。研究进一步通过相关性分析可知,LncRNA MALAT1 表达与性别、分化程度、淋巴结转移、TNM 分期、Lauren 分型有关,且随着肿瘤分期升高,LncRNA MALAT1 表达水平越高,表明LncRNA MALAT1 的高表达可促进EBVaGC 相关胃癌进展,与肿瘤转移、增殖等关系密切,可能作为临床判断EBVaGC 疾病进展的血清学指标,从而为临床EBVaGC 的筛查、诊断、治疗提供可靠的病理学依据;根据ROC 结果发现LncRNA MALAT1 对诊断EBVaGC 疾病有较好的敏感度和特异度,表明LncRNA MALAT1 可能作为诊断该疾病的潜在标志物。经过绘制生存曲线结果显示LncRNA MALAT1高表达患者五年累积生存率显著低于低表达患者,推测LncRNA MALAT1 是评估EBVaGC 胃癌患者不良预后的生物标志物,提示LncRNA MALAT1可在一定程度反映EBVaGC 胃癌患者生存期,可为临床评估预后提供有效信息,此外其表达升高不利于患者生存预后也提示临床可通过降低LncRNA MALAT1 表达水平,降低EBVaGC 患者不良预后发生率,提高生存率;研究发现年龄、分化程度、淋巴结转移、TNM 分期、LncRNA MALAT1 高表达均是影响EBVaGC 患者生存状况的危险因素,有望成为EBVaGC 患者预后预测的无创生物标志物,提示临床LncRNA MALAT1 高表达的患者,可以在手术后进行严密的随访及观察,在必要的时候给予患者恰当的辅助治疗,以期改善患者的预后。上述结果可能为LncRNA MALAT1 参与EBVaGC 的发生提供依据,但本研究只分析了血清中LncRNA MALAT1 表达单独诊断EBVaGC 的价值,后续研究可进一步分析其与肿瘤标志物联合检测对EBVa-GC 的诊断价值,更多作用机制尚需深入研究。
综上所述,EBVaGC 患者血清中LncRNA MALAT1呈高表达与EBVaGC 患者临床特征密切相关,可作为EBVaGC 胃癌患者预后不良的生物标志物,为EBVaGC 的致病机制研究提供新思路,对临床诊断EBVaGC 和评估生存预后具有重要价值。

