维奈克拉增强MDS细胞系对地西他滨化疗敏感性机制的实验研究
曲志梅,董 伟,刘艳萍(山东第一医科大学附属人民医院,济南 271199)
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是起源于造血干细胞以病理性造血为特征的异质性克隆性疾病,具有向急性髓系白血病转化的高风险[1]。目前MDS 发病机制尚不清楚,可能与分子遗传学、造血微环境变化、造血干/祖细胞增殖、细胞凋亡紊乱和肿瘤抑制基因甲基化等多种因素相关[2-3]。传统化疗对MDS 疗效有限,去甲基化药物(hypomethylating agents,HMAs)已成为对于国际预后评分系统(the international prognostic scoring system,IPSS)不适合移植的中危-2 级和高危患者的临床治疗首选药物[4]。HMA是一种特异性的DNA 甲基转移酶抑制剂,包括阿扎胞苷和地西他滨(decitabine,DAC),尽管HMAs 治疗的总有效率约为50%,但患者的完全缓解率仅为20%,且严重的骨髓抑制需要多疗程巩固治疗等因素导致患者治疗依从性较差[5]。此外,随治疗时间的延长,部分患者的疗效会逐渐下降,耐药性普遍存在严重影响HMAs 临床效果。为进一步提高MDS 患者的缓解率和生存时间,探索与HMAs 的联合治疗是MDS 治疗的主要目标。
维奈克拉(venetoclax,VCX)是2016年获得美国食品药品管理局(Food and Drug Administration,FDA)加速批准用于治疗急性淋巴细胞白血病,在2019年获得可用于治疗慢性淋巴细胞白血病和淋巴瘤的高选择性B 细胞白血病/淋巴瘤-2(B-cell leukemia/lymphoma-2,Bcl-2)抑制剂[6]。在MDS治疗领域,多个地区的临床研究表明,VCX 联合HAMs 对初治高危MDS 是安全有效的[7]。一项前瞻性研究也报道,DAC 联合VCX 维持治疗对预防MDS 患者异基因造血干细胞移植治疗后复发和降低化疗耐受性具有一定的有效性[8]。这表明DAC联合VCX 对MDS 的治疗可能具有较大应用潜力。因此本研究通过体外培养MDS 细胞系探讨了DAC联合VCX 对MDS 化疗敏感性的影响及潜在可能机制,以期为改善MDS 的治疗提供实验依据。
1 材料与方法
1.1 研究对象 人MDS 细胞系SKM-1 细胞和MUTZ-1 细胞(武汉普诺赛生命科技有限公司),采用含10%(v/v)FBS的RPMI-1640培养液在37 ℃,5%(v/v)CO2的细胞培养箱中进行培养。
1.2 试剂与仪器 RPMI-1640 培养液(美国Hyclone公司);VCX 和DAC(西安杨森制药有限公司);CCK-8 试剂盒(江苏凯基生物技术股份有限公司);Annexin V-FITC/ PI 试剂盒(美国eBioscience 公司);JC-1 试剂盒(美国SAB 公司);H2DCF-DA试剂盒(美国MedChemExpress 公司);BCA 蛋白定量试剂盒(美国Thermo 公司);Laemmli 上样缓冲液(美国Bio-Rad 公司);小鼠抗Bcl-1,cleaved Caspase-3,P62(美国Cell Signal Technology 公司);兔抗LC3B,Bax,Beclin 1,cytochrome C 和β-actin(美国Santa Cruz 公司);大鼠抗小鼠或山羊抗兔二抗(美国Abacm 公司);CO2细胞培养箱(美国Thermo 公司);LightCycler480II 型RT-PCR 仪(瑞士Roche 公司);800TS 型酶标仪(美国BioTek 公司);CytoFLEX 型流式细胞仪(美国BD 公司)。
1.3 方法
1.3.1 CCK-8 法检测MDS 细胞增殖活性:取生长状态良好的SKM-1 和MUTZ-1 细胞,按每孔3×104个细胞接种至96 孔板,用稀释后不同浓度的VCX(0,0.1,1.0,2.5,5.0,10.0,25.0,50.0 μmol/L)处理SKM-1 或MUTZ-1 细胞24h,每孔加入10 μl CCK-8 试剂,继续孵育2h;采用酶标仪在450 nm 处测定各孔的吸光度值(A值)。将0 μmol/L 的VCX 设为0 加药组,并设置不含细胞的培养液孔为空白组。计算各组细胞增殖活性,使用统计学软件绘制曲线,分析VCX 对细胞的半数抑制浓度(half maximal inhibitory concentration,IC50)。细胞增殖活性=(A加药-A空白)/(A0加药-A空白)×100%。IC50值即与对照组A值减少一半所需的VCX 浓度。每组每个浓度设置6 个复孔,实验重复三次取平均值。
1.3.2 细胞处理和分组:根据上述“CCK-8 法检测MDS 细胞增殖活性”的检测结果,使用8 μmol/L的VCX 分别处理MUTZ-1 细胞;按细胞处理方式的不同将MUTZ-1 分为4 组:无任何药物处理的对照组、VCX 组、DAC 组(参考文献[9-10]方法使用5 μmol/L 的DAC 处理)和VCX+DAC 组(使用VCX 和DAC 联合处理细胞)。将各组细胞在培养箱中培养24h 后用于后续实验检测。
1.3.3 Annexin V-FITC/PI 法检测MDS 细胞凋亡率:取各组待测MUTZ-1 细胞,常规胰酶消化制成细胞悬液,细胞计数后按照Annexin V-FITC/PI 试剂盒使用说明书加入Annexin V-FITC 和PI 试剂,37 ℃下避光孵育15~ 20 min,上机分析。其中Annexin V-FITC 阳性,PI 阴性为早期凋亡细胞,Annexin V-FITC 和PI 双阳性为晚期凋亡细胞,两者之和为总凋亡细胞。实验重复三次取平均值。
1.3.4 JC-1 染色法检测MDS 细胞线粒体膜电位:取各组待测MUTZ-1 细胞,胰酶消化制成细胞悬液,计数后加入JC-1 荧光染料,37℃避光孵育30 min,PBS 溶液再次洗涤后上机进行分析。JC-1 荧光染色后细胞通常发出红色荧光,但当线粒体膜电位降低时JC-1 则变为绿色荧光,通过计算绿色荧光比值可分析细胞的线粒体膜电位改变。实验重复三次取平均值。
1.3.5 H2DCF-DA 荧光探针法检测MDS 细胞中ROS含量:按前述方法收集各组细胞,800 g 离心5 min,取细胞沉淀,加入H2DCF-DA 试剂重悬细胞,37 ℃避光孵育30 min,PBS 溶液再次洗涤细胞,上机检测各组细胞中ROS 含量。实验重复三次取平均值。
1.3.6 Western blotting 检测MDS 细胞中凋亡与自噬相关蛋白的表达:取各组待测MUTZ-1 细胞,用预冷RIPA 细胞裂解液和蛋白酶抑制剂在冰上提取细胞总蛋白,采用BCA 蛋白定量试剂盒检测蛋白浓度;取40 μg 蛋白样品进行SDS-PAGE 凝胶电泳分离,后转移至PVDF 膜上,分别加入Bcl-1(1∶800),Bax(1∶800),cleaved Caspase-3(1∶1 000),cytochrome C(1∶1 000),LC3B(1∶1 000),Beclin 1(1∶800),P62(1∶800)和β-actin(1∶2000)一抗,4 ℃孵育过夜,次日加入抗小鼠或抗兔二抗(1∶1 000),室温孵育2 h,通过增强化学发光检测方法对蛋白条带进行显影。采用Image J 软件评估蛋白条带的灰度值,以β-actin 为内参,通过计算目的蛋白条带的灰度值与内参蛋白条带灰度值的比值对目的蛋白进行半定量分析。实验重复三次取平均值。
1.4 统计学分析 采用SPSS 19.0 和 GraphPad Prism 8.0 软件进行统计分析。数据以均数±标准差(±s)表示,两组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 VCX 对MDS 细胞增殖的影响 见表1。CCK-8 法检测显示,随VCX 浓度升高,SKM-1 细胞和MUTZ-1细胞增殖活性均明显降低(P<0.05),且呈浓度依赖性。VCX 对SKM-1 细胞的IC50值为10.14±3.26 μmol/L,对MUTZ-1 细胞的IC50值为8.09±2.73 μmol/L。选择对VCX 更为敏感的MUTZ-1 细胞,并使用8 μmol/L 的VCX 分别处理MUTZ-1 细胞进行后续研究。
表1 不同浓度VCX 对MDS 细胞增殖活性的影响 [(±s)%]

表1 不同浓度VCX 对MDS 细胞增殖活性的影响 [(±s)%]
注:与空白组比较,*tSKM-1=2.139,5.286,11.268,14.391,21.589,31.308,37.912,tMUTI-1=2.844,5.854,10.474,15.336,20.351,29.909,38.076,均P<0.05。
VCX(μmol/L)细胞空白组F 值P 值0.11.02.55.010.025.050.0 SKM-198.23±7.11 92.97±3.18 85.23±1.90* 70.52±1.58* 62.84±2.07* 45.14±1.08* 21.24±0.58* 5.00±0.09* 17.29223.770 MUTZ-1101.05±6.92 94.00±2.43 86.54±3.21* 75.09±2.39* 63.04±1.18* 50.61±1.27* 26.92±0.94* 6.18±0.15*0.0030.001
2.2 各组MDS 细胞凋亡率与凋亡相关蛋白表达 见表2。Annexin V-FITC/PI 实验检测表明,与对照组比较,VCX 组、DAC 组和VCX+DAC 组细胞凋亡率明显升高(t=3.604,3.086,5.259,均P<0.05);与DAC 组比较,VCX 组细胞凋亡率差异无统计学意义(t=0.518,P>0.05),VCX+DAC 组凋亡率则明显升高(t=2.473,P<0.05)。Western blotting实验结果显示,与对照组比较,VCX 组,DAC 组和VCX+DAC 组细胞中促凋亡蛋白cytochrome C,cleaved Caspase-3 表达水平均明显升高(t=11.637,10.755,39.319; 13.023,8.864,30.314,均P<0.05),Bcl-2/Bax 比值明显降低(t=14.893,13.352,22.596,均P<0.05);与DAC 组比较,VCX 组细胞中cytochrome C,cleaved Caspase-3 表达和Bcl-2/Bax比值差异均无统计学意义(t=0.882,4.159,1.541,均P>0.05);而VCX+DAC 组细胞中cytochrome C,cleaved Caspase-3 表达水平均明显升高(t=28.564,17.291,均P<0.05),Bcl-2/Bax 比值则明显降低(t=9.244,P<0.05)。
表2 各组MDS 细胞凋亡率和凋亡相关蛋白的表达(±s)
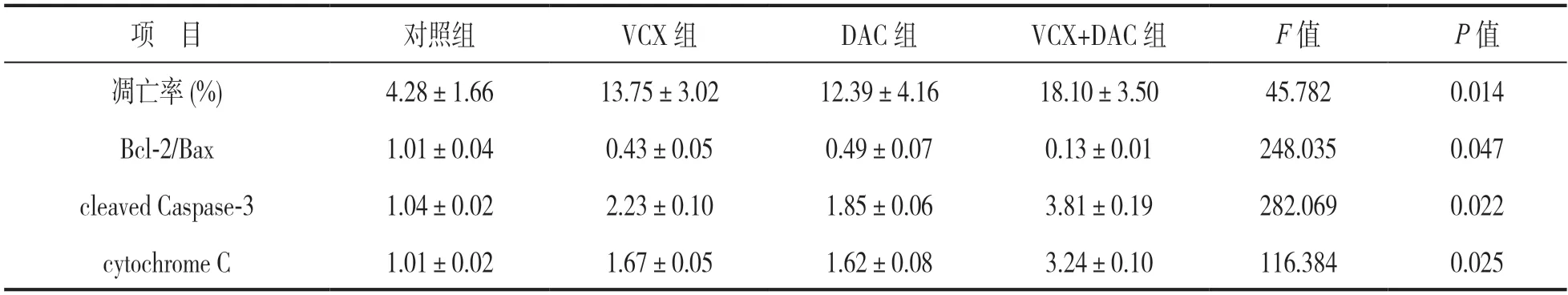
表2 各组MDS 细胞凋亡率和凋亡相关蛋白的表达(±s)
项 目对照组VCX 组DAC 组VCX+DAC 组F 值P 值凋亡率(%)4.28±1.6613.75±3.0212.39±4.1618.10±3.5045.7820.014 Bcl-2/Bax1.01±0.040.43±0.050.49±0.070.13±0.01248.0350.047 cleaved Caspase-31.04±0.022.23±0.101.85±0.063.81±0.19282.0690.022 cytochrome C1.01±0.021.67±0.051.62±0.083.24±0.10116.3840.025
2.3 各组MDS 细胞线粒体膜电位与细胞中ROS 表达 见表3。JC-1 法检测显示,与对照组比较,VCX 组,DAC 组和VCX+DAC 组细胞线粒体膜电位均明显降低(t=4.269,4.089,8.710,均P<0.05);与DAC 组比较,VCX 组细胞线粒体膜电位虽有降低,但差异无统计学意义(t=0.179,P>0.05),而VCX+DAC 组细胞的线粒体膜电位明显降低(t=4.621,P<0.05)。H2DCF-DA 荧光探针法检测结果表明,与对照组比较,VCX 组、DAC 组和VCX+DAC 组细胞中ROS 含量明显升高(t=3.686,3.109,12.428,均P<0.05);与DAC组比较,VCX 组细胞中ROS 含量的差异无统计学意义(t=0.577,P>0.05),而VCX+DAC 组细胞中ROS 含量明显升高t=9.319,P<0.05)。
表3 各组MDS 细胞线粒体膜电位和细胞中ROS 含量[(±s)%]

表3 各组MDS 细胞线粒体膜电位和细胞中ROS 含量[(±s)%]
项 目对照组VCX 组DAC 组VCX+DAC 组F 值P 值JC-1 染色2.05±0.348.72±1.26*8.44±2.13*15.66±2.90*#66.7820.041 ROS 含量8.78±1.3714.02±1.45*13.20±2.41*26.45±1.53*#69.0710.046
2.4 各组MDS 细胞自噬相关蛋白表达 见表4。Western blotting 检测显示,与对照组比较,VCX组、DAC 组和VCX+DAC 组细胞中自噬相关蛋白Beclin1 表达和LC3-Ⅱ/LC3-Ⅰ比值均明显升高,而P62 蛋白水平明显降低,差异具有统计学意 义(t=4.481,4.874,20.988; 9.818,8.886,15.907;4.696,4.905,9.183,均P<0.05);与DAC 组比较,VCX 组细胞中Beclin1,P62 蛋白表达及LC3-Ⅱ/LC3-Ⅰ比值差异均无统计学意义(t=0.393,0.932,0.209,均P>0.05),而VCX+DAC 组细胞中Beclin1 表达和LC3-Ⅱ/LC3-Ⅰ比值均明显升高,P62 蛋白水平明显降低,差异有统计学意义(t=16.115,7.021,4.278,均P<0.05)。
表4 各组MDS 细胞的自噬相关蛋白的表达(±s)

表4 各组MDS 细胞的自噬相关蛋白的表达(±s)
项 目对照组VCX 组DAC 组VCX+DAC 组F 值P 值Beclin11.05±0.041.62±0.151.67±0.173.72±0.21118.2570.017 P621.01±0.070.56±0.150.54±0.140.13±0.09236.920.007 LC3-Ⅱ/LC3-Ⅰ1.02±0.082.60±0.192.45±0.203.58±0.27209.4220.009
3 讨论
Bcl-2 家族蛋白作为一类膜整合蛋白,能够通过调节细胞的完整性和凋亡因子的释放来调控细胞的存亡[11]。研究表明,Bcl-2 家族抗凋亡蛋白的过度表达与血液系统恶性疾病发生和耐药性的形成密切相关,而VCX 是一种高效、选择性的Bcl-2 抑制剂,其能与Bcl-2 直接结合,改变线粒体外膜的通透性,活化凋亡相关蛋白,诱导肿瘤细胞凋亡[6]。目前,VCX 在我国主要与HAMs 类药物联合应用于治疗高龄难治性急性髓系白血病患者[12]。然而临床研究发现,VCX 联合HAMs 对MDS 治疗同样有效[7-8]。因而本研究通过体外细胞培养实验,验证了应用VCX 对MDS 细胞DAC 化疗敏感性的影响及机制。
研究表明,Bcl-2在MDS高危组中表达水平明显高于低危组,且在急性粒细胞白血病中表达水平最高,推测应与Bcl-2 蛋白在不成熟造血细胞中堆积相关,增加MDS 向恶性髓系白血病转化的风险[11]。而本研究表明,VCX 对MDS 细胞生长具有浓度依赖性抑制能力,可能与Bcl-2 在MDS 中的过度表达相关。为明确VCX 与DAC 的应用对MDS 细胞的凋亡作用,本实验探究发现,VCX 与DAC 联合应用明显提高MDS 细胞的凋亡率,增加细胞中凋亡相关蛋白cytochrome C,cleaved Caspase-3的表达,下调Bcl-2/Bax 比值。众所周知,线粒体损伤被认为是化疗敏感性机制中的一个重要因素,线粒体膜电位的丧失会增加线粒体膜通透性,调节线粒体依赖的细胞凋亡途径[13]。Bax 作为Bcl-2 家族中的重要蛋白,主要通过与Bcl-2 形成异二聚体促进线粒体外膜的通透性,发挥促凋亡作用[14]。研究发现,Bcl-2/Bax 比值可直接决定细胞是否走向凋亡[15]。此外,DAC 还可直接通过引起线粒体跨膜电位的丢失,进而激活线粒体凋亡途径[15]。本研究通过检测细胞线粒体膜电位来观察线粒体损伤程度,结果表明,VCX 与DAC 共处理组细胞线粒体膜电位丧失较两药物单独处理组明显增高。
ROS 的产生和积累可导致线粒体损伤和细胞凋亡[16]。包括HMAS 在内的多种化疗药物在诱导ROS 产生的过程中会激活抗氧化通路,诱导抗氧化酶的生成,中和ROS,削弱化疗药物对肿瘤细胞的杀伤。但有数据表明,联合应用VCX 与DAC 可减少抗氧化酶的产生[17]。本实验结果同样显示VCX与DAC 共处理组ROS 产生明显增多。此外,氧化应激也被认为是化疗药物介导细胞自噬相关死亡的关键途径[18]。研究报道,自噬途径的关键启动因子Beclin1 具有Bcl-2 同源结构域BH3。Bcl-2 蛋白与Beclin1 的BH3 结构域的相互作用,阻止了自噬体结构的组装,导致细胞的自噬进程被抑制[19]。微管相关蛋白1 轻链3(LC3)是自噬发生的常用指标,自噬过程中,胞质可溶形式的LC3-Ⅰ与亲脂性磷脂酰乙醇胺结合转换为自噬囊泡相关形式的LC3-Ⅱ。而P62 是LC3 的选择性底物之一,P62 直接与LC3 结合,促进泛素化蛋白聚集物降解。由于自噬被激活时,LC3-II 积累,而P62 减少,因此LC3-II/LC3-Ⅰ和P62 常被用作研究自噬的标准标志物[20]。本研究结果发现,VCX 与DAC 共处理组细胞自噬水平、Beclin1 蛋白表达及LC3-Ⅱ/LC3-Ⅰ比值均明显升高,P62 蛋白则显著降低。这提示VCX 与MDS 的联合可能通过上调MDS 细胞的自噬水平参与细胞的凋亡。然本研究是基于体外细胞实验进行探究分析,VCX 增强MDS 对DAC 化疗敏感性的机制还需通过裸鼠成瘤体内实验进一步研究分析。
综上所述,VCX 可能通过调节细胞凋亡、自噬和氧化应激来促进MDS 细胞对DAC 的化疗敏感性。VCX 与MDS 的联合使用可能成为有效的MDS 治疗策略的潜在候选方案,值得临床进一步探究。

