LncRNA JHDM1D-AS1对MPP+诱导的帕金森细胞模型线粒体功能的机制研究
李斯琴,王 兴,阿日奔吉日嘎拉(巴彦淖尔市医院.神经内科;.脊柱外科,内蒙古巴彦淖尔 015000)
帕金森病(Parkinson’s disease,PD)是老年人常见的神经退行性疾病之一,发病率呈逐年上升趋势,然而该病的发生受到社会因素、药物因素、患者因素等多种因素的影响,导致其病因及发病机制至今尚未明确[1-2]。既往研究显示,线粒体功能障碍是导致神经系统中细胞凋亡的主要原因,也被认为是引起PD 患者体内活性氧(reactive oxygen species,ROS)累积的主要原因之一,在PD 发病过程中起着重要作用[3]。因此,寻找调节神经元细胞线粒体功能的生物学标志物,并深入探讨其分子机制,对于治疗PD 疾病具有重要的临床意义。沉默调节蛋白1(SIRT1)是一种具有烟酰胺腺嘌呤二核苷酸依赖性的蛋白去乙酰基酶,可以调节细胞寿命、能量代谢及神经保护等[4]。有研究报道,SIRT1 激活剂通过激活SIRT1 依赖性PGC-1α/NRF1/TFAM 信号通路,来改善线粒体生物合成受损功能,从而预防神经发育性疾病[5]。长链非编码RNA(long non-coding RNA,LncRNA)不仅可作为遗传信息中间载体的辅助性角色,而且更多地承担了各种调控功能,已被证实在脑发育、阿尔茨海默症及PD 疾病中发挥重要调节作用[6]。JHDM1D反义RNA 1(JHDM1D antisense RNA 1,JHDM1DAS1) 是一种新发现的 Lnc RNA,定位于染色体7q34,有研究报道,JHDM1D-AS1 在神经发育、细胞分化、氧化应激等多个生物学过程中起关键作用[7]。本研究通过生物信息学预测发现,SIRT1可能是JHDM1D-AS1 的靶基因,那么,JHDM1DAS1 是否能通过调控SIRT1 在PD 细胞模型中发挥潜在作用呢?故本研究利用多巴胺能神经毒素1-甲基-4-苯基吡啶离子(MPP+)处理 SH-SY5Y 细胞构建PD 模型,并检测JHDM1D-AS1 差异表达对PD 模型细胞凋亡及线粒体功能的影响,从而深入探讨JHDM1D-AS1/SIRT1 轴在PD 进展过程中的可能分子机制。
1 材料与方法
1.1 研究对象 人神经母细胞瘤细胞SH-SY5Y 购自中国科学院细胞库,进行复苏、传代培养后,用于后续实验。
1.2 仪器与试剂 DMEM 培养基(美国Gibco 公司);1-甲基-4-苯基吡啶离子(MPP+)(美国Sigma 公司);LJHDM1D-AS1 mimic,JHDM1DAS1 siRNA 序列构建和RT-PCR 引物由上海生工生物工程有限公司设计合成;AnnexinV-FITC/PI 细胞凋亡试剂盒(美国BD 公司);ROS 试剂盒(上海通蔚生物科技有限公司);双荧光素酶基因检测试剂盒(上海碧云天生物技术有限公司);兔源SIRT1,鼠源β-actin 抗体及HRP 标记羊抗兔(鼠)II 抗(美国Abcam 公司);PCR 仪(德国Biometra);细胞培养箱(日本三洋公司);低温高速离心机(美国Thermo 公司);流式细胞分析仪(美国BD 公司)。
1.3 方法
1.3.1 细胞培养:采用含10g/dl 胎牛血清的DMEM培养液,加入100 U/ml 青霉素和100 μg/ml 链霉素,37 ℃,5ml/dl CO2孵育箱中培养,当细胞融合度为80%时,胰蛋白酶消化传代,待细胞长至取对数生长期后进行后续实验。
1.3.2 PD 模型构建及细胞转染:取对数生长期SH-SY5Y 细胞接种于6 孔板,在其培养液中加入MPP+试剂(终浓度为5 mmol/L),轻轻摇晃混合均匀,恒温孵育24 h,构建PD 模型;将正常培养的细胞设为对照组(control 组)。将MPP+诱导的SH-SY5Y 细胞重新接种于6 孔板中,待细胞贴壁时将JHDM1D-AS1 mimic 和JHDM1D-AS1 siRNA序列转染至SH-SY5Y 细胞中,分别记为JHDM1DAS1 mimic 组和JHDM1D-AS1 siRNA 组,培养6 h后更换新鲜培养液继续培养48 h,收集细胞检测转染效率。
1.3.3 CCK-8 法检测细胞活力:取对数生长期SHSY5Y 细胞,胰酶消化、重悬,接种于96 孔板,每孔5×103个细胞,37 ℃,5ml/dl CO2孵育箱培养24 h,加入MPP+处理24 h,每组设3 个重复孔,后分别培养1~5 天,吸出培养液,每孔分别加入CCK-8液继续孵育2 h,在450 nm 处测量各组吸光度值。
1.3.4 RT-PCR 检测转染效率:利用RNA 提取试剂盒提取各组SH-SY5Y 细胞总RNA,采用反转录试剂盒合成cDNA,反转录条件为:42 ℃孵育30 min,85 ℃灭活5 min。以反转录合成的cDNA作为模板,进行PCR 扩增,扩增条件为:94 ℃ 5 min;94 ℃ 30s,60 ℃ 30s,72 ℃ 45s,40 个循环。扩增后的样品经PCR 仪测定,采用2-ΔΔCt法计算各组细胞中JHDM1D-AS1 相对表达量,以β-actin为内参,引物序列为:JHDM1D-AS1 上游引物:5’-TGTTGTTCTGTCACCCACCC-3’,下游引物:5’-TGCATGGGTCTTTCCACTCC-3’;β-actin 上游引物:5’-CTCCATCCTGGCCTCGCTGT-3’,下游引物:5’-GCTGTCACCTTCACCGTTCC-3’。
1.3.5 细胞凋亡水平检测:取转染后各组SH-SY5Y细胞,PBS 洗涤2 次后,离心,重悬,每组加入3μl Annexin V-FITC,室温避光孵育10 μl,后再加入3μl PI 染液,室温避光孵育15 min,离心去上清,每管加入200 μl 1×Bingding buffer,混匀后在1h内行流式细胞仪检测细胞凋亡情况。
1.3.6 线粒体膜电位变化:取转染后各组SHSY5Y 细胞,重悬,分别加入JC-1 荧光染料,浓度为 1 μg/ml,37 ℃孵育30 min,离心,收集底部细胞,加入1 ml PBS 缓冲液轻轻漂洗,同等条件下离心后收集细胞,加入提前预热的500 μl PBS 缓冲液,轻轻弹起细胞使其混合均匀,经流式细胞仪检测。
1.3.7 ROS 含量测定:收集转染后SH-SY5Y 细胞悬液,加入200 μl 浓度为5 μmol/L 的 Cell Rox Red 荧光染料,轻摇混匀,37 ℃避光孵育30 min,离心去上清,加入1 ml PBS 缓冲液轻轻漂洗后,再次离心去上清,加入300 μl PBS 缓冲液,轻摇混匀后通过流式细胞仪进行检测。
1.3.8 Western blot 检测SIRT1 蛋白表达情况:取转染后SH-SY5Y 细胞,胰蛋白酶消化,加入蛋白裂解液提取细胞总蛋白,BCA试剂盒检测蛋白浓度。取蛋白样品进行SDS-PAGE 凝胶电泳,后转PVDF膜,脱脂牛奶封闭1 h,加入SIRT1 和β-actin 一抗(1∶1 000),4 ℃孵育过夜,次日加入IgG-HRP二抗,室温孵育1 h,PBS 漂洗3 次,加入ECL 发光液,暗室曝光并拍照,采用Image-J 软件分析SIRT1 蛋白相对表达。
1.3.9 双荧光素酶基因报告实验:分别构建含有野生型和突变型 SIRT1 基因的荧光素酶报告基因质粒,将其与JHDM1D-AS1 mimic 及control 共转染于SH-SY5Y 细胞中,37℃孵育48 h 后,利用双荧光素酶活性检测试剂盒检测荧光强度。
1.3.10 SIRT1 激活剂处理后SH-SY5Y 细胞线粒体膜电位变化:为进一步证实JHDM1D-AS1 通过靶向作用SIRT1 调控PD 细胞线粒体功能,研究在上述转染了JHDM1D-AS1 mimic 的细胞中加入了SIRT1激活剂Resveratrol 溶液,恒温孵育24 h,后通过流式细胞仪分析SH-SY5Y 细胞线粒体膜电位变化。
1.4 统计学分析 采用SPSS 23.0 软件进行结果分析,所有数据均采用平均数±标准差(±s)表示,两组间比较采用独立t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD 检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 MPP+对SH SY5Y 细胞活力的影响 见图1。研究采用MPP+处理SH-SY5Y 细胞构建PD模型,经CCK-8 检测显示,MPP+处理后1,2,3,4,5 天时SH-SY5Y 细胞活力分别为1.00±0.01,0.89±0.04,0.77±0.03,0.54±0.02,0.33±0.02,随着培养时间延长细胞活力逐渐降低(均P<0.05)。
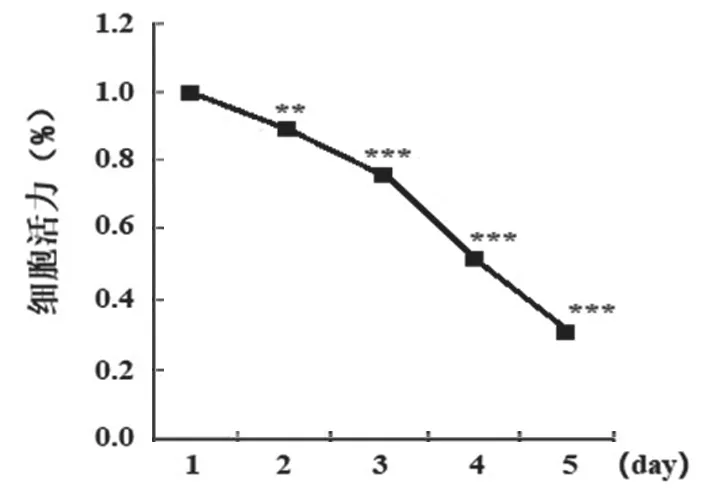
图1 MPP+处理对SH-SY5Y 细胞活力的影响
2.2 JHDM1D-AS1 在各组细胞中的表达 RT-PCR结果显示,control 组SH-SY5Y 细胞中JHDM1DAS1 相对表达水平为0.85±0.21,MPP+组细胞中JHDM1D-AS1 相对表达水平为1.25±0.33,较control 组增加,差异有统计学意义(t=62.017,P<0.05)。转染JHDM1D-AS1 mimic 和JHDM1DAS1 siRNA 序列后,两组细胞中JHDM1D-AS1相对表达水平分别为1.63±0.38 和0.72±0.17,与MPP+组相比,三组间差异亦有统计学意义(F=112.035,P<0.05),说明转染成功。
2.3 JHDM1D AS1 对MPP+诱导的SH SY5Y 细胞凋亡的影响 细胞凋亡结果显示,MPP+组SHSY5Y 细胞凋亡率为17.64%,转染JHDM1D-AS1 mimic 和JHDM1D-AS1 siRNA 序列后,SH-SY5Y细胞凋亡率分别为25.92%和10.74%,三组间比较差异有统计学意义(F=49.052,P<0.05),说明JHDM1D-AS1 过表达可促进MPP+ 诱导的SHSY5Y 细胞凋亡,沉默JHDM1D-AS1 表达则结果相反。
2.4 JHDM1D AS1 调控MPP+诱导的SH SY5Y 细胞膜电位变化 见图2。根据JC-1 染料依赖膜电位的极性发现,JHDM1D-AS1 过表达时,JC-1 以单体形式被释放到胞质内,绿色荧光增强,线粒体膜电位降低;沉默JHDM1D-AS1 表达时,红色荧光增强,线粒体膜电位升高,三组间比较差异有统计学意义(F=57.390,P<0.05)。
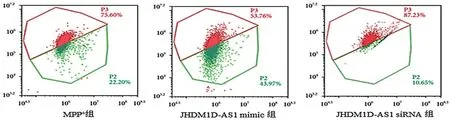
图2 JHDM1D-AS1 差异表达对MPP+诱导的SH-SY5Y 细胞线粒体膜电位的影响
2.5 JHDM1D AS1 对MPP+诱导的SH SY5Y 细胞中ROS 含量的影响 流式结果显示,MPP+组ROS相对荧光强度为27.58%±4.25%,转染JHDM1DAS1 mimic 后,SH-SY5Y 细胞中ROS 含量显著增加,其相对荧光强度为45.10%±6.05%;转染JHDM1D-AS1 siRNA 后,SH-SY5Y 细胞中ROS 含量显著减少,其相对荧光强度为14.82%±3.70%,三组间比较差异有统计学意义(F=25.794,P<0.05)。
2.6 JHDM1D AS1 与SIRT1 之间的靶向关系 Target Scan 软件预测显示,JHDM1D-AS1 与SIRT1 序列具有靶向结合位点,见图3。双荧光素酶报告基因显示,JHDM1D-AS1 过表达可降低WT-SIRT1 荧光素酶活性,而对MUT-SIRT1 荧光素酶活性无显著影响,进一步说明JHDM1D-AS1 与SIRT1 之间为负向调控关系,见表1。

表1 双荧光素酶报告基因检测结果

图3 JHDM1D-AS1 与SIRT1 的结合位点
2.7 JHDM1D AS1 对MPP+诱导的SH SY5Y 细胞中SIRT1 蛋白的影响 Western blot 结果显示,Control组SIRTI 蛋白相对表达为1.00±0.23,MPP+组SIRT1 蛋白表达下调为0.70±0.27,两组间差异有统计学意义(t=35.740,P<0.05)。转染JHDM1DAS1 mimic 后,SIRT1 相对表达为0.44±0.16,较MPP+组下调;转染JHDM1D-AS1 siRNA 后,SIRT1蛋白表达为1.34±0.22,较MPP+组上调,三组间比较差异亦有统计学意义(F=29.508,P<0.05)。
2.8 JHDM1D AS1 通过SIRT1 调控SH SY5Y 细胞线粒体膜电位 为了证实MPP+诱导的PD 模型中JHDM1D-AS1 是否通过SIRT1 调控线粒体功能,研究在MPP+诱导的SH-SY5Y 细胞中加入SIRT1激活剂Resveratrol后,SIRT1相对表达为1.46±0.34,较MPP+组0.70±0.27 明显上调,差异有统计学意义(t=3.032,P<0.05);在转染JHDM1D-AS1 mimic 组加入激活剂Resveratrol,SIRT1 相对表达为0.97±0.21,较仅转染JHDM1D-AS1 mimic 组0.44±0.16 相比明显上调,组间差异有统计学意义(t=3.477,P<0.05),表明SIRT1 激活成功。进一步经流式细胞仪检测发现,相比MPP+组,JHDM1D-AS1 过表达时线粒体膜电位明显降低,SIRT1 激活时线粒体膜电位明显升高,转染JHDM1D-AS1 mimic 并激活 SIRT1 后,线粒体膜电位水平回升,说明JHDM1D-AS1 的确可通过靶向调控SIRT1 影响MPP+诱导的SH-SY5Y 细胞线粒体功能,见图4。

图4 SIRT1 激活剂处理后JHDM1D-AS1 过表达对线粒体膜电位的影响
3 讨论
据调查,PD 是仅次于阿尔茨海默病的第二大神经退行性疾病,其发病率、致残率较高,严重影响着患者的生活质量[8]。目前而言,临床治疗PD 的药物及方法主要是缓解其症状,并不能阻止病情的恶化,因此,从基因水平寻找可有效干预PD 发生发展的靶向因子,是近年来医学工作者研究的热点及难点。有研究指出,JHDM1DAS1 是一种营养饥饿反应性 LncRNA,由组蛋白去甲基化酶JHDM1D 的反义链产生,具有抗氧化应激及神经保护作用[9]。SHI 等[10]研究数据显示,上调JHDM1D-AS1 表达,可以抑制Bcl-2 蛋白水平和eIF2α 磷酸化水平,进而导致干细胞凋亡,提示JHDM1D-AS1 在ROS 诱导的细胞凋亡中起促进作用。LIU 等[11]研究显示,JHDM1D-AS1 可能作为靶向miR-101-3p 的竞争性内源性RNA,结合在DUSP1 mRNA 的3’UTR 上,从而抑制神经元凋亡,发挥神经保护作用。WANG 等[12]研究发现,JHDM1D-AS1 可以调节MPP+诱导的神经元细胞凋亡、炎症和氧化应激,其作用机制可能是JHDM1D-AS1 通过miR-134-5p/PIK3R3 轴诱导神经元损伤,进而参与PD 的发生发展,提示JHDM1DAS1 与PD 疾病进展关系密切。
PD 最主要的病理特征是中脑黑质中多巴胺能神经元细胞选择性丢失,诱发线粒体功能异常、氧化应激,最终导致细胞凋亡,引起神经元细胞不可逆损伤[13]。广泛应用多巴胺能神经毒性物质建立体外PD 细胞模型是目前研究的重要手段。MPP+是多巴胺能神经元相对选择性神经毒素,是1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)的活性代谢产物,其能对中脑黑质多巴胺能神经元产生选择性破坏作用,研究证实MPP+诱导可产生与PD 相似的神经细胞氧化应激和凋亡等病理变化,是目前制备PD细胞模型的常用诱导剂[14-15]。而神经母细胞瘤细胞SH-SY5Y具有与多巴胺能神经元相似的生化特征,MPP+处理的SH-SY5Y 细胞被认为是高度模拟神经细胞线粒体功能障碍导致氧化应激的PD 细胞模型[14]。本研究中采用终浓度5 mmol/L MPP+诱导处理SH-SY5Y 细胞后发现细胞活力明显降低,细胞凋亡增加,ROS 含量增加,符合PD 病理改变,表明PD 细胞模型构建成功。进一步探究发现,MPP+诱导PD 细胞模型中JHDM1D-AS1 表达显著增加,转染JHDM1D-AS1 过表达序列后,促进了MPP+诱导SH-SY5Y 细胞凋亡、ROS 含量增加及线粒体膜电位降低。线粒体膜电位的稳定是线粒体及细胞发挥正常生理功能的基本保证,线粒体功能障碍是引起多巴胺能神经元损伤的重要机制[3]。大量研究已证实,不同刺激下细胞发生凋亡时常伴随线粒体膜电位的下降[16]。本研究中观察到转染JHDM1DAS1 过表达时线粒体膜电位降低,沉默JHDM1DAS1 表达则结果相反,说明JHDM1D-AS1 可能通过诱导线粒体功能异常,引起神经元细胞损伤,在PD 疾病发展过程中发挥重要作用,有望成为PD 诊断治疗的潜在靶点,但其具体的作用机制还有待进一步探讨。
SIRT1 是目前研究最深入的 Sirtuin 蛋白,它以组蛋白和多种非组蛋白为底物,通过其去乙酰化调节自噬、凋亡、衰老、炎症反应、氧化应激、基因转录等关键生物过程,在线粒体功能及能量代谢等多种过程中发挥关键作用[17-18]。CAMPOREZ等[19]研究表明,在阿尔茨海默症动物模型中SIRT1活性降低,究其原因可能是它通过去乙酰化上调PGC-1α,而后者激活线粒体生物发生。LI 等[20]研究指出,SIRT1 在PD 动物模型中表达下调,给予SIRT1 激活剂干预后,可以抑制小胶质细胞活化、减轻氧化应激和炎症反应,避免多巴胺神经元线粒体损伤。基于上述报道,推测JHDM1DAS1 是否通过靶向作用SIRT1 而影响PD 细胞模型的线粒体功能呢?本研究通过生物学软件预测发现JHDM1D-AS1 与SIRT1 存在结合位点,证实JHDM1D-AS1 可以负向调控SIRT1,说明JHDM1D-AS1 通过SIRT1 轴调节PD 模型细胞的生物学行为。其次研究通过转染SIRT1 激活剂上调SIRT1 表达,经流式细胞仪分析,SIRT1 过表达时线粒体膜电位升高,在转染 JHDM1D-AS1 过表达并激活 SIRT1 后,线粒体膜电位水平回升。研究结果提示,JHDM1D-AS1 过表达可以导致神经元细胞线粒体功能障碍,加速PD 疾病的发展进程,激活SIRT1 后,则可以保护线粒体功能,抑制MPP+诱导的SH-SY5Y 细胞凋亡,发挥神经元细胞保护作用。此外,前期有大量文献证实活性氧(ROS)来源于线粒体,并且通常情况下,细胞内的ROS处于较低水平状态,若ROS 水平过高,将会对细胞和基因结构造成严重损伤[21-22]。本研究证实,JHDM1D-AS1 过表达后ROS 含量增加,反之沉默其表达后ROS 含量减少,与既往研究报道的ROS大量累积,可导致线粒体代谢紊乱,细胞氧化应激反应增强,最终引起细胞的凋亡,导致神经元细胞不可逆损伤的结论相一致[23]。
综上所述,MPP+诱导的PD 细胞模型中,沉默JHDM1D-AS1 表达可以负向调控SIRT1 蛋白水平,抑制SH-SY5Y 细胞发生凋亡,减轻氧化应激反应,增加线粒体膜电位水平,保护线粒体功能,发挥了神经元细胞保护作用,在一定程度上为临床诊断和治疗PD 病提供新的思路及理论基础。但本研究还存在一定的局限性,后期可结合体内动物实验验证JHDM1D-AS1 在PD 疾病形成过程中的可能作用机制。

