4种鲜食葡萄果实糖积累和代谢相关酶及基因表达差异分析
任言 李美璇 刘婉君 乔月莲 王莉 师校欣 杜国强


摘要:为明确鲜食葡萄果实糖积累规律及相关机理,以阳光玫瑰、巨峰、意大利和摩尔多瓦葡萄为试材,对发育期果实糖组分含量、蔗糖代谢相关酶活性及糖转运蛋白基因表达进行分析。结果表明,葡萄果实成熟过程中葡萄糖与果糖含量呈上升趋势,果实成熟时果糖与葡萄糖含量由高到低依次为阳光玫瑰>巨峰>意大利>摩尔多瓦,且差异显著。在糖代谢中,酸性转化酶(AI)活性在各品种果实成熟初期均达峰值,且阳光玫瑰葡萄AI活性比巨峰、意大利和摩尔多瓦分别高39.89%、72.55%和86.20%;阳光玫瑰葡萄蔗糖合酶-分解方向(SS-c)活性分别比巨峰、意大利和摩尔多瓦高11.13%、34.44%和45.76%。转色末期至成熟期,阳光玫瑰葡萄果实糖转运蛋白基因VvHT2和VvSWEET15相对表达量分别是其他品种的1.23~2.60倍与1.14~3.05倍。各品种葡萄果实果糖和葡萄糖含量与VvHT2、VvSWEET15表达量和AI活性均呈显著正相关,阳光玫瑰和巨峰果实果糖、葡萄糖含量与SS-c活性呈显著正相关。综上所述,4种鲜食葡萄果实果糖及葡萄糖的积累规律差异主要由糖转运蛋白基因VvHT2、VvSWEET15的差异表达和AI、SS-c酶活性差异所致。
关键词:葡萄果实;品种;糖含量;代谢酶;表达量;相关性
中图分类号:S663.101 文献标志码:A 文章編号:1002-1302(2023)09-0140-07
基金项目:热杂果现代种业科技创新团队(编号:21326310D);河北省现代农业产业技术体系葡萄创新团队(编号:HBCT2018100204)。
作者简介:任 言(1996—),男,河北石家庄人,硕士研究生,主要从事园艺产品质量与安全研究。E-mail:15075192193@163.com。
通信作者:杜国强,教授,主要从事果树生物技术、果树生理与生态、园艺(果树)产品质量与安全研究。E-mail:gdu@hebau.edu.cn。
葡萄营养丰富,其果实可溶性固形物与可溶性糖含量较高且具有多种氨基酸、维生素和矿质元素等,其中糖类物质是决定果实甜度、口感与风味的重要因子[1]。高糖含量的鲜食葡萄品种甜度值高、风味佳,更易满足消费者与市场需求。葡萄属于糖直接积累型果实,其主要糖分有葡萄糖、果糖和蔗糖,少量存在其他糖组分种类,如水苏糖和棉子糖等[2]。叶片光合作用产生的蔗糖通过韧皮部运送至果实中被分解成葡萄糖和果糖[3]。因此,在葡萄果实生长发育过程中,蔗糖代谢酶,如:转化酶(INV)、蔗糖合酶(SS)和蔗糖磷酸合成酶(SPS)活性大小决定库强大小,进而影响了浆果内各糖组分含量[4-6]。闫梅玲等对赤霞珠葡萄的研究表明,葡萄糖、果糖的积累主要受转化酶的调控[7]。卢彩玉等研究发现,通过根域限制巨玫瑰葡萄可提高酸性转化酶(AI)活性,进而提高果实可溶性糖含量[8]。Han等发现,疏果处理提高了赤霞珠葡萄果实AI与细胞壁转化酶(CWI)活性,从而提高葡萄糖与果糖含量[9]。在山葡萄果实中,转色期SPS活性上升促进了蔗糖含量的积累。此外,糖转运蛋白在葡萄果实糖分跨膜运输中起重要作用,Wang等发现,疏果可上调转色期后西拉葡萄果实糖转运蛋白基因VvHT5表达量,从而提高葡萄糖与果糖含量[10]。在霞多丽葡萄中,VvSWEET10定位在质膜中并负责成熟后期己糖的跨膜转运[11]。
目前,针对葡萄果实糖含量的研究主要集中于栽培技术、外源生长调节剂及肥料喷施等方面[12-14],而对不同品种间糖分积累差异及产生机制的研究较少。本试验选取阳光玫瑰、巨峰、意大利和摩尔多瓦4个不同糖含量的鲜食葡萄品种,对其发育过程中糖积累、蔗糖代谢相关酶活性及糖转运蛋白基因表达量进行研究,以期为阐明葡萄品种之间糖含量差异产生的原因及风味品质改良提供理论基础。1 材料与方法
1.1 试验材料
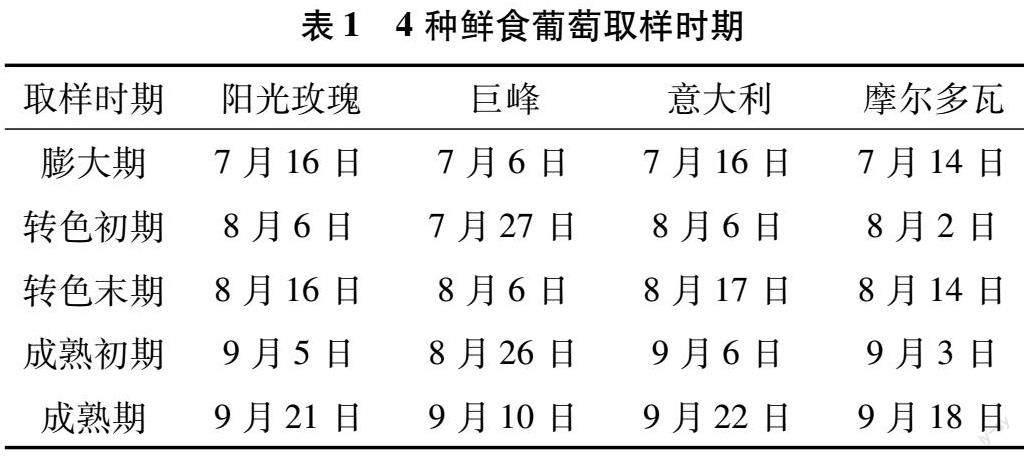
试验材料取自河北省定州市黄家葡萄酒庄葡萄园(38°29′44″N,115°09′5″E),土壤类型为沙土,单臂篱架,南北行向,株行距1.5 m×2.0 m,树龄8年生,品种为阳光玫瑰、巨峰、意大利和摩尔多瓦葡萄。于果实膨大期、转色初期、转色末期、成熟初期及成熟期采样(表1)。每品种挑选生长势一致、无病虫害树15株,采用完全随机设计,3次重复,5株为1小区。每次取样兼顾树体方位采集果实30粒,迅速放入冰盒,用液氮速冻分装后于-80 ℃超低温冰箱中保存。
1.2 试验方法
1.2.1 糖组分含量测定 糖组分提取及测定参照黄艳等的方法[14]进行。
1.2.2 糖代谢相关酶活性测定 蔗糖代谢相关酶提取参照王惠聪等的方法[15],取1 g冻样,加入液氮充分研磨,置于10 mL离心管中,加入4 mL 50 mmol/L Hepes-NaOH 缓冲液(pH值7.5)作为提取液,内含10 mmol/L MgCl2,1.0 mmol/L EDTA,2.5 mmol/L DTT,0.05% TritonX-100和0.1% BSA,12 000 r离心20 min,将上清液装入透析袋中在稀释10倍的提取缓冲液(无Triton X-100)于 4 ℃ 下透析16 h之后保存于-80 ℃待测。酶活性测定参照赵智中等的方法[16]。
1.2.3 实时荧光定量PCR分析 葡萄果实RNA提取参考Vashisth等改良的CTAB法[17],采用UEIris Ⅱ RT-PCR System反转录试剂盒进行第一链cDNA的合成。本研究中荧光定量PCR特异性引物和内参基因序列见表2,引物合成工作由上海生物工程股份有限公司完成。定量分析使用宇恒生物科技有限公司生产的qRT-PCR试剂盒Fast Super EvaGreenTM qPCR Master Mix进行。PCR反应体系为20 μL:cDNA模板 1 μL,上、下游引物各 1 μL,Mix 10 μL,ddH2O 7 μL。反应程序:95 ℃ 预变性5 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环;72 ℃ 10 min延伸。所有PCR反应设置3次生物学重复,采用2-ΔΔCT法计算相对表达量。
1.2.4 数据处理 采用Excel 2016和DPS软件进行统计和差异显著性分析(Duncans新复极差法,α=0.05),采用SPSS 20.0软件进行相关性分析。
2 结果与分析
2.1 果实糖组分含量变化
随着葡萄果实的发育,各品种果实果糖(图1-A)、葡萄糖(图1-B)含量呈不断上升趋势,蔗糖(图1-C)含量呈先上升后下降的趋势。果实发育过程中,摩尔多瓦果糖与葡萄糖含量均显著低于阳光玫瑰和巨峰,意大利葡萄糖和果糖含量分别在成熟初期和成熟期显著低于阳光玫瑰和巨峰。成熟期,葡萄糖与果糖在各品种中含量均较高,其中果糖占比为48.08%~50.24%,葡萄糖占比为48.01%~50.30%,两者总占比为98.25%~98.48%,蔗糖含量较低,占比仅为1.53%~1.75%;阳光玫瑰果实果糖含量分别为巨峰、意大利、摩尔多瓦的1.13、1.19、1.33倍,葡萄糖含量分别为巨峰、意大利、摩尔多瓦的1.07、1.24、1.29倍,差异达显著水平(P<0.05)。
2.2 蔗糖代谢相关酶活性的变化
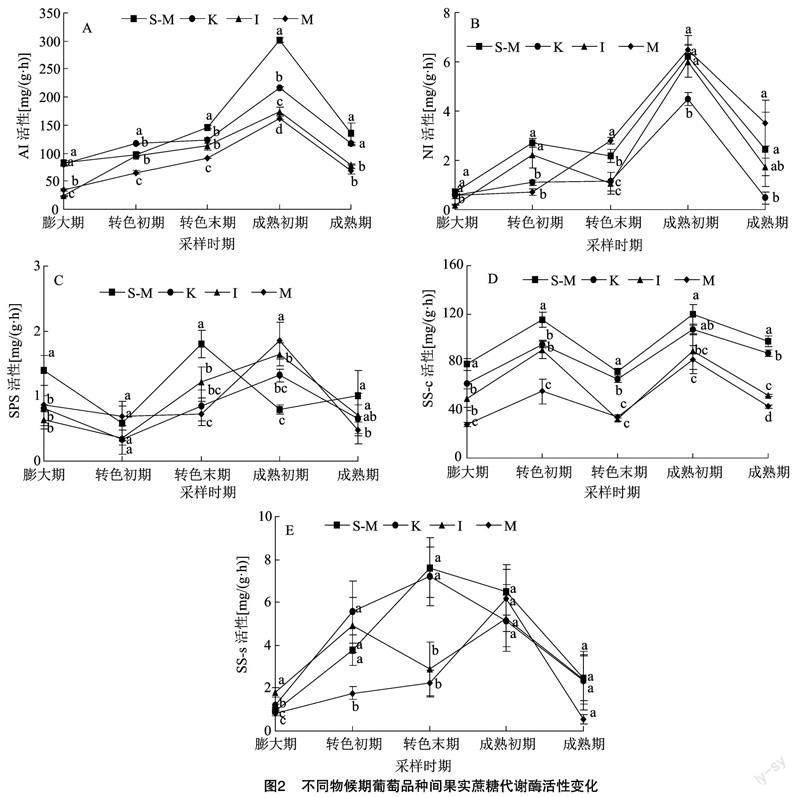
由图2-A可知,4个品种葡萄果实酸性转化酶(AI)活性均呈先升后降的趋势,在成熟初期AI活性达峰值。成熟初期,阳光玫瑰AI活性最高,为301.46 mg/(g·h),分别为巨峰、意大利、摩尔多瓦的1.40、1.73、1.86倍。由图2-B可知,中性转化酶(NI)活性较低但变化趋势与AI相似,在成熟初期达最高值,巨峰NI活性显著低于其他品种。
蔗糖磷酸合成酶(SPS)活性在葡萄果实发育过程中呈波动变化趋势,由图2-C可知,转色末期,阳光玫瑰果实SPS活性达峰值。成熟初期,巨峰、意大利与摩尔多瓦果实SPS活性达峰值。成熟期阳光玫瑰SPS活性略微升高,而巨峰、意大利与摩尔多瓦SPS活性下降。由图2-D可知,蔗糖合酶分解方向(SS-c)均呈“M”形变化趋势,果实发育期内均以阳光玫瑰SS-c活性最高。转色初期,各品种SS-c活性均达峰值,阳光玫瑰SS-c活性最高,为115.13 mg/(g·h)。成熟初期各品种葡萄果实 SS-c 活性均上升至峰值,且阳光玫瑰SS-c活性最高,为119.25 mg/(g·h),其次為巨峰,SS-c活性为107.31 mg/(g·h)。蔗糖合酶合成方向(SS-s)一直呈较低水平且分别在转色期和成熟初期达到峰值。转色末期,阳光玫瑰和巨峰SS-s活性分别为7.62、7.21 mg/(g·h),显著高于意大利和摩尔多瓦。成熟期各品种葡萄果实SS-s活性均下降,无显著差异(图2-E)。
2.3 糖转运蛋白相关基因表达水平的变化
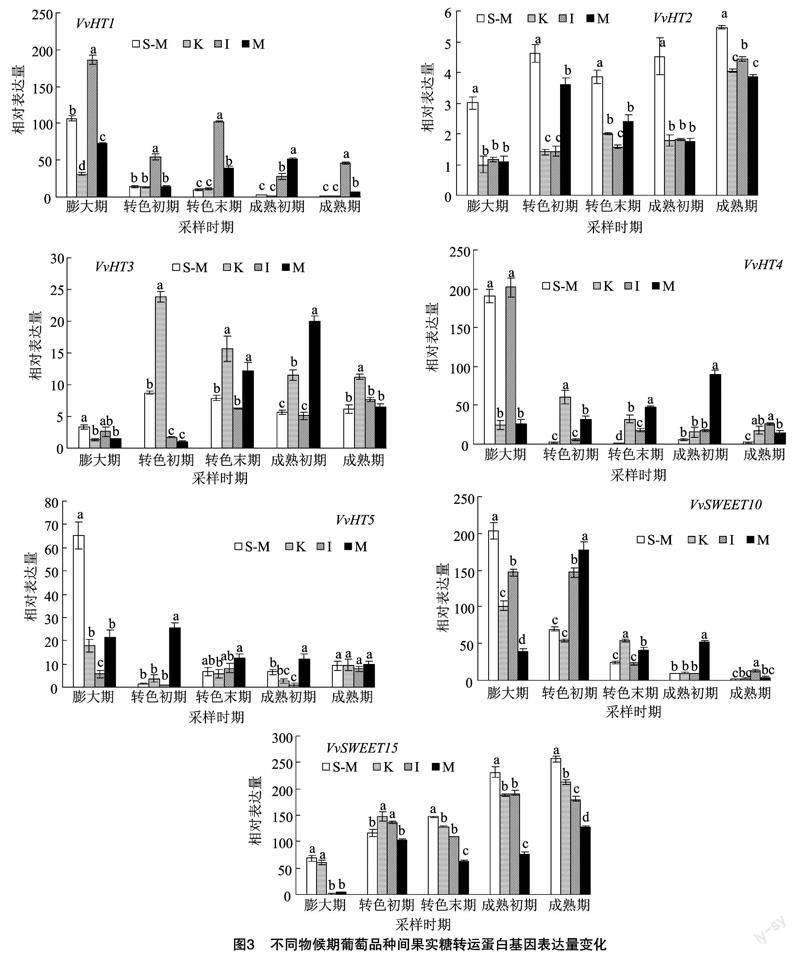
由图3可知,VvHT1基因在意大利果实中表达量除成熟初期外均显著高于其他品种。VvHT5基因在膨大期阳光玫瑰果实中表达量最高,转色初期至成熟初期以摩尔多瓦果实表达量最高,成熟期时各品种表达量一致。VvHT2基因在阳光玫瑰果实中表达量均显著高于同时期其他品种,成熟初期,阳光玫瑰果实VvHT2基因表达量分别为巨峰、意大利、摩尔多瓦的2.52、2.47、2.60倍;VvHT3基因在巨峰果实中表达量较高,成熟期时,其表达量分别为阳光玫瑰、意大利、摩尔多瓦的1.83、1.46、1.73倍。VvHT4基因在阳光玫瑰和意大利膨大期果实中表达量较高,至成熟初期,摩尔多瓦果实中表达量较高。VvSWEET10基因在各品种果实中前期表达量高于后期,转色初期摩尔多瓦果实表达量分别为阳光玫瑰、巨峰、意大利的2.54、3.25、1.21倍。VvSWEET15基因在各品种果实中呈不断上升的趋势,除转色初期外,阳光玫瑰果实VvSWEET15基因表达量均高于其他品种,成熟初期,阳光玫瑰果实VvSWEET15基因表达量分别为巨峰、意大利、摩尔多瓦的1.23、1.22、3.05倍。
2.4 葡萄果实糖组分含量与代谢酶活性和转运蛋白基因表达相关性分析
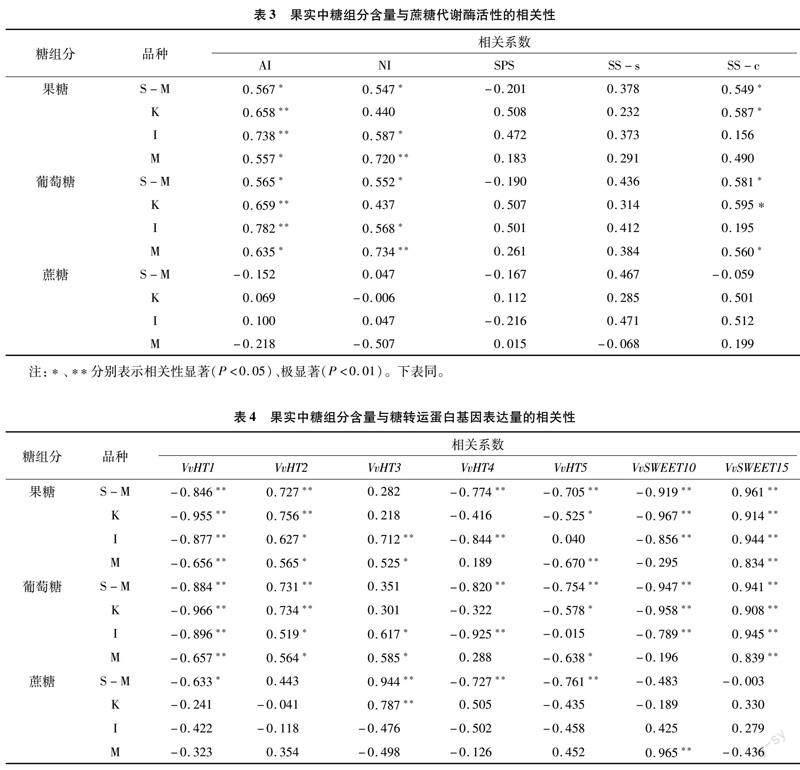
由表3可知,各品种葡萄果实果糖与葡萄糖含量均与AI活性呈显著或极显著正相关,阳光玫瑰、意大利和摩尔多瓦果糖和葡萄糖含量与NI活性呈显著或极显著正相关。阳光玫瑰与巨峰果糖和葡萄糖含量与SS-c活性呈极显著正相关,摩尔多瓦葡萄糖含量与SS-c活性呈显著正相关。各品种糖组分与SPS和SS-s活性均无明显相关性,蔗糖与
5种蔗糖代谢酶活性均无明显相关性。
由表4可知,各品种果实果糖和葡萄糖含量与VvHT2和VvSWEET15表达量呈显著或极显著正相关,与VvHT1表达量呈显著或极显著负相关。阳光玫瑰和巨峰果实果糖与葡萄糖含量与VvHT5、VvSWEET10表达量呈显著负相关,蔗糖含量与VvHT3表达量呈显著正相关。意大利果实果糖与葡萄糖含量与VvHT4和VvSWEET10表达量呈显著负相关。摩尔多瓦果实果糖与葡萄糖含量与VvHT3表达量呈显著正相关,与VvHT5表达量呈显著负相关,蔗糖含量与VvSWEET10表达量呈极显著正相关。
3 讨论
葡萄果实中糖的种类及含量是影响鲜食品质的主要因素[2]。葡萄为己糖积累型,蔗糖作为运输糖运输到果实内被分解为葡萄糖和果糖,为细胞内的物质代谢提供能量并以己糖形式储存于果实内[18]。本研究表明,4种鲜食葡萄品种果实均以积累果糖与葡萄糖为主,且二者含量相近,蔗糖占比仅为1.53%~1.75%。在发育期内,摩尔多瓦果实果糖与葡萄糖含量均较低,而阳光玫瑰、巨峰和意大利果实果糖与葡萄糖含量在成熟初期至成熟期出现显著差异,表明果实发育后期为果实糖积累差异的关键时期,这与邓倩在枣中的研究结果[19]相一致。
葡萄果实的糖代谢对浆果内糖分积累起重要作用[2]。葡萄果实糖分积累主要受蔗糖代谢相关酶的调控,其中,最主要的是与蔗糖分解相关的AI、
NI和SS-c及蔗糖合成相关的SPS和SS-s等[13]。果实内糖分积累也与酶活性之间存在密切关系。果实作为一个代谢库,在其生长发育过程中从源组织中获得同化物,果实获得同化物的能力称为库强。库强在一定程度上与果实内蔗糖代谢酶的活性相关,因为蔗糖作为运输糖由源至库进行运输,到达葡萄果实内被分解为己糖,从而形成蔗糖浓度梯度差,促进蔗糖运输[20]。本研究结果表明,在各品种果实发育过程中,AI在成熟初期达到最高值且阳光玫瑰活性最高,显著高于巨峰,导致成熟期阳光玫瑰己糖含量显著高于巨峰,AI活性与果糖和葡萄糖含量呈显著正相关,表明高AI活性是引起糖分积累差异的重要原因,这与何昕孺等的研究结果[21]相一致。NI活性变化趋势与AI相似,但其活性远小于AI。SS既可促进蔗糖的合成,也可分解蔗糖,多种研究表明,果实发育后期糖含量的提高均与SS相关。SS-c活性在葡萄果实成熟初期达到峰值且阳光玫瑰与巨峰显著高于意大利和摩尔多瓦,相关性分析表明,阳光玫瑰与巨峰果糖含量与SS-c活性呈显著正相关,意大利和摩尔多瓦果糖含量与 SS-c 活性无显著相关性,表明SS-c活性的不同使糖分积累产生差异。成熟初期葡萄品种间AI和SS-c活性的差异导致了成熟期果实果糖与葡萄糖含量不同,这与刘丽媛在山葡萄[22]和李航在中国樱桃中的结果[23]相似。SS-s活性与SPS活性较低导致葡萄果实内蔗糖含量始终处于较低水平,且与蔗糖含量无明显相关性,可见蔗糖合成酶类对葡萄果实中蔗糖的积累无明显作用,这与贺琰等在美乐葡萄中的研究结果[13]不一致,可能是由于酿酒葡萄果实中蔗糖含量较高,与鲜食葡萄的糖代谢方式不同所致。
糖运输蛋白参与果实糖类由质外体运输进入果肉细胞的过程,糖运输蛋白基因表达量的高低与库组织糖分积累密切相关[24]。本研究中VvHT2基因表达量在4种鲜食葡萄果实发育过程中显著上调,与果糖和葡萄糖含量呈显著正相关,且在阳光玫瑰果实中高表达,推测VvHT2基因是葡萄品种间糖含量差异的关键基因,这与Wang等的研究结果[10]相似。Conde等研究发现,VvHT1在葡萄幼果期表达水平高,葡萄糖含量的增加抑制了VvHT1的表达,表明VvHT1可能参与了细胞生长的能量供给[25]。本试验同样发现,VvHT1基因在各品种果实中幼果期表达量高于成熟期。李芬等研究发现,VvHT3基因表达水平的降低导致花色苷合成量减少[26],本研究发现在巨峰与摩尔多瓦中VvHT3基因表达水平明显高于阳光玫瑰与意大利,表明VvHT3与浆果颜色关系密切。VvHT4与VvHT5基因表达模式与VvHT1基因相似,在果实发育前期表达量高于成熟期,推测可能参与了其他代谢途径。Chen等研究发现,SWEET蛋白在植物中具有运转糖的能力[27]。VvSWEET15基因表达水平随果实发育不断上升且与果糖和葡萄糖含量呈极显著正相关,说明VvSWEET15基因是参与果实糖分运输的关键糖转运蛋白基因。在浆果成熟期,VvSWEET15基因高表达,且阳光玫瑰中表达量显著高于其余品种,表明VvSWEET15基因是导致葡萄果实品种间糖含量差异的关键基因,这与Ren等在小芒森葡萄上的研究结果[28]相一致。
4 结论
4种鲜食葡萄果实糖含量均在成熟期达到峰值且葡萄糖与果糖含量由高到低排序依次为阳光玫瑰、巨峰、意大利和摩尔多瓦;果实发育后期,糖转运蛋白基因VvHT2、VvSWEET15的差异表达及酸性转化酶与蔗糖合酶(分解方向)活性不同是葡萄果实糖分积累差异的关键。
参考文献:
[1]钟海霞,丁 祥,周晓明,等. 新疆10个酿酒葡萄品种(系)可溶性糖组分及含量分析[J]. 新疆农业科学,2021,58(7):1323-1331.
[2]赵艳侠,亓桂梅,董兴全,等. 葡萄果实中糖代谢及转运机制研究进展[J]. 中国果树,2019(5):7-11.
[3]Hawker J,Ruffner H,Walker R. The sucrose content of some Australian grapes[J]. American Journal of Enology and Viticulture,1976,27(3):125-129.
[4]李利梅,王秀芹,楊培培,等. 赤霞珠葡萄果实糖积累与糖代谢相关酶的关系[J]. 中外葡萄与葡萄酒,2011(7):24-27.
[5]Shiraishi M,Hamada M. Genetic and gene expression analysis of berry sugar composition in a sucrose-accumulating grapevine[J]. The Horticulture Journal,2020,89(3):216-224.
[6]胡瑞芳,姜 慧,李玥莹. 蔗糖代谢相关酶的研究进展[J]. 北方园艺,2012(1):167-170.
[7]闫梅玲,王振平,范 永,等. 蔗糖代谢相关酶在赤霞珠葡萄果实糖积累中的作用[J]. 果树学报,2010,27(5):703-707.
[8]卢彩玉,郑小艳,贾惠娟,等. 根域限制对‘巨玫瑰’葡萄果实可溶性糖含量及相关代谢酶活性的影响[J]. 园艺学报,2011,38(5):825-832.
[9]Han W W,Han N,He X,et al. Berry thinning to reduce bunch compactness improves fruit quality of Cabernet Sauvignon (Vitis vinifera L.)[J]. Scientia Horticulturae,2019,246:589-596.
[10]Wang W,Liang Y Y,Quan G R,et al. Thinning of cluster improves berry composition and sugar accumulation in Syrah grapes[J]. Scientia Horticulturae,2022,297:110966.
[11]Zhang Z,Zou L M,Ren C,et al. VvSWEET10 mediates sugar accumulation in grapes[J]. Genes,2019,10(4):255.
[12]李夢鸽. 避雨栽培对葡萄果实糖分积累及蔗糖代谢酶活性的影响[D]. 雅安:四川农业大学,2015:12-13.
[13]贺 琰,孙艳丽,赵芳芳,等. 外源油菜素内酯处理对‘美乐’葡萄果实糖代谢的影响[J]. 园艺学报,2022,49(1):117-128.
[14]黄 艳,文 露,庞亚卓,等. 喷施钙肥对‘夏黑’葡萄果实糖酸积累的影响[J]. 中国土壤与肥料,2020(2):166-172.
[15]王惠聪,黄辉白,黄旭明. 荔枝果实的糖积累与相关酶活性[J]. 园艺学报,2003,30(1):1-5.
[16]赵智中,张上隆,徐昌杰,等. 蔗糖代谢相关酶在温州蜜柑果实糖积累中的作用[J]. 园艺学报,2001,28(2):112-118.
[17]Vashisth T,Johnson L K,Malladi A. An efficient RNA isolation procedure and identification of reference genes for normalization of gene expression in blueberry[J]. Plant Cell Reports,2011,30(12):2167-2176.
[18]李金龙. 果实内糖的积累与糖代谢相关酶[J]. 中国林副特产,2015(3):92-93.
[19]邓 倩,王 羊,邓群仙,等. 枣和酸枣果实可溶性糖积累规律差异研究[J]. 四川农业大学学报,2021,39(6):734-741.
[20]刘翔宇,李 娟,黄 敏,等. 柑橘砧木对砂糖橘果实糖积累的影响[J]. 中国农业科学,2015,48(11):2217-2228.
[21]何昕孺,单守明,黄学春,等. 赤霉酸对“摩尔多瓦”葡萄果实糖代谢及果实品质的影响[J]. 北方园艺,2013(21):23-26.
[22]刘丽媛. 山葡萄糖酸积累规律及代谢调控机理研究[D]. 杨凌:西北农林科技大学,2016:65.
[23]李 航. 两种中国樱桃果实糖酸积累和代谢相关酶及其基因表达的研究[D]. 雅安:四川农业大学,2019:45.
[24]Xu F,Xi Z M,Hui Z,et al. Brassinosteroids are involved in controlling sugar unloading in Vitis vinifera ‘Cabernet Sauvignon’ berries during véraison[J]. Plant Physiology and Biochemistry,2015,94:197-208.
[25]Conde C,Agasse A,Glissant D,et al. Pathways of glucose regulation of monosaccharide transport in grape cells[J]. Plant Physiology,2006,141(4):1563-1577.
[26]李 芬. 盐碱处理对酿酒葡萄果实膨压和成熟进程的影响[D]. 济南:齐鲁工业大学,2019:36-37.
[27]Chen L Q,Qu X Q,Hou B H,et al. Sucrose efflux mediated by SWEET proteins as a key step for phloem transport[J]. Science,2012,335(6065):207-211.
[28]Ren R H,Yue X F,Li J N,et al. Coexpression of sucrose synthase and the SWEET transporter,which are associated with sugar hydrolysis and transport,respectively,increases the hexose content in Vitis vinifera L. grape berries[J]. Frontiers in Plant Science,2020,11:321.

