瑞马唑仑诱导PC-12细胞炎症因子表达和凋亡
陈博伦,杨倩,石华堂,陈新华,李轶聪
(1.佳木斯大学,黑龙江 佳木斯 154007;2.解放军联勤保障部队第962医院 麻醉科,黑龙江 哈尔滨 150080)
瑞马唑仑是一种新型的苯二氮䓬类药物,与丙泊酚等静脉镇静药物相比,具有起效快、副作用小、血流动力学稳定、清除时间短、呼吸抑制轻微等的优点[1-2]。研究发现,除镇静作用外,瑞马唑仑还能诱导胶质瘤细胞凋亡[3],对神经性疼痛也具有缓解作用[4],但其具体机制仍不明确。炎症反应是引起包括肿瘤在内的多种疾病的基础,在肿瘤的病理生理中发挥重要作用[5]。过量的炎性细胞因子有助于恶性细胞的增殖和生存,扩大炎症反应,促进肿瘤细胞的生存,最终促进肿瘤的发生和发展[6-7]。因此,本研究通过将瑞马唑仑作用于大鼠肾上腺嗜铬细胞瘤细胞PC-12,观察瑞马唑仑对神经细胞瘤炎症和凋亡的影响,为瑞马唑仑的临床应用提供更多参考。
1 材料与方法
1.1 细胞和试剂和仪器
大鼠肾上腺嗜铬细胞瘤细胞PC-12 来源中国科学院上海细胞库。F12K、胎牛血清购于Gibco公司,Donor Equine Serum 马血清购于HyClone 公司,瑞马唑仑购于江苏恒瑞公司,PBS、0.25%胰蛋白酶、细胞活力检测试剂盒(CCK-8)、BCA 蛋白浓度测定试剂盒、RIPA(强)组织细胞快速裂解液、十二烷基硫酸钠(SDS)购于solarbio 公司,AnnexinV-FITC/PI 凋亡检测试剂盒购于BD 公司,大鼠肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)酶联免疫吸附检测试剂盒、兔抗Bcl-2、Bax 和辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)购于Bioswamp 公司,聚偏二氟乙烯(PVDF)转移膜、化学发光试剂购于millipore 公司。
1.2 主要仪器
二氧化碳(CO2)恒温培养箱购于Thermo 公司,倒置荧光显微镜购于Leica 公司,酶标仪购于杭州奥盛,流式细胞仪购于艾森公司,电泳仪购于BIO-RAD 公司。
1.3 方法
1.3.1 细胞培养及分组 PC-12 细胞用含5%胎牛血清(FBS)和10% 马血清(HS)的F12K 培养基置于37℃,5%CO2的培养箱中培养,待细胞汇合度达到80%以上时,用0.25%胰酶消化,按照1∶2 传代培养,取对数期的细胞进行后续实验。将细胞分成5 组:对照组(瑞马唑仑0 μmol/L)、25 μmol/L 组(瑞马唑仑25 μmol/L)、50 μmol/L组(瑞马唑仑50 μmol/L)、125 μmol/L 组(瑞马唑仑125 μmol/L)、250 μmol/L 组(瑞马唑仑250 μmol/L)。
1.3.2 CCK8 检测细胞存活率 收集细胞,调整细胞悬液浓度,接种于96 孔板,使每孔3×103个细胞,过夜培养使细胞贴壁,不同浓度的瑞马唑仑处理PC-12 细胞,继续培养24、48、72 h,取出培养板每孔加入10 μL CCK-8,培养4 h 后检测450 nm 处的吸光值。
1.3.3 流式细胞术检测细胞凋亡 不同浓度的瑞马唑仑处理PC-12 细胞,继续培养24、48、72 h后收集细胞,取1×106个培养基重悬的细胞,400 g,4℃离心5 min,弃上清后加入1 mL 预冷的PBS,轻轻吹打混匀,400 g,4℃离心5 min,弃上清,用200 μL PBS 重悬细胞,加入10 μL Annexin V-FITC 和10 μL PI,混匀后4℃避光孵育30 min,加入300 μL PBS,随即进行流式检测,利用NovoExpress 分析软件对结果进行分析。
1.3.4 酶联免疫吸附测定(ELISA)检测炎症因子TNF-α、IL-6、IL-1β 水平 收集不同浓度和处理时间瑞马唑仑处理后的PC-12 细胞,严格按照试剂盒说明书检测各组细胞中炎症因子TNF-α、IL-6、IL-1β 的水平,每组设置3 次重复。
1.3.5 Western blot 检测凋亡蛋白Bcl-2 和Bax 的表达 收集不同浓度和处理时间瑞马唑仑处理后的PC-12 细胞,吸去培养液,加入含有蛋白酶和磷酸酶抑制剂的裂解液,充分裂解后,4℃12 000 g 离心15 min,取上清用二喹啉甲酸(BCA)法测定蛋白浓度,每孔上样量为20 μg 蛋白,12% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),结束后湿转至PVDF 膜,5%脱脂奶粉4℃封闭过夜,加入一抗稀释液(1∶1 000),室温孵育1 h,PBST 洗涤5 min,洗涤3 次后加入二抗稀释液(1∶20 000),室温孵育1 h,PBST 洗涤3 次后增强型化学发光(ECL)显影,全自动化学发光分析仪检测,TANON GIS 软件读取灰度值。
1.4 统计学方法
利用SPSS 20.0 软件进行数据分析。计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 瑞马唑仑抑制PC-12 细胞增殖
随着瑞马唑仑浓度的升高,PC-12 细胞的增殖能力不断降低,呈现剂量效应关系。所有瑞马唑仑处理组与对照组相比,差异有统计学意义(P<0.05),说明瑞马唑仑能够抑制PC-12 细胞增殖。见表1。
表1 各组细胞增殖能力的比较()

表1 各组细胞增殖能力的比较()
注:†与对照组比较,P<0.05。
2.2 瑞马唑仑对PC-12 细胞炎症因子水平的影响
与对照组相比,其他四组IL-1β、IL-6 和TNF-α 水平均升高,差异有统计学意义(P<0.05),呈现剂量和时间效应关系,瑞马唑仑浓度越高处理时间越长,IL-1β、IL-6 和TNF-α 水平越高,说明瑞马唑仑能够升高PC-12 细胞炎症因子水平,促进炎症反应。见表2。
表2 各组细胞炎症因子水平的比较(,pg/mL)

表2 各组细胞炎症因子水平的比较(,pg/mL)
注:†与对照组比较,P<0.05。
2.3 瑞马唑仑促进PC-12 细胞凋亡
与对照组相比,所有瑞马唑仑处理组的细胞凋亡率均升高,差异有统计学意义(P<0.05),且细胞凋亡率随着瑞马唑仑浓度的升高和作用时间的延长而不断升高,说明瑞马唑仑能够促进PC-12细胞凋亡。见图1 和表3。
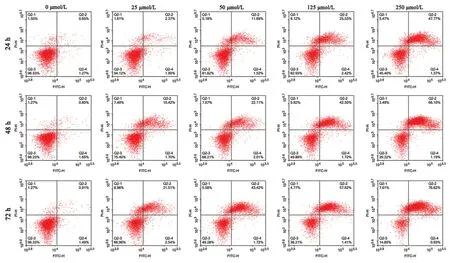
图1 瑞马唑仑对PC-12 细胞凋亡的影响
表3 各组细胞凋亡率的比较(,%)
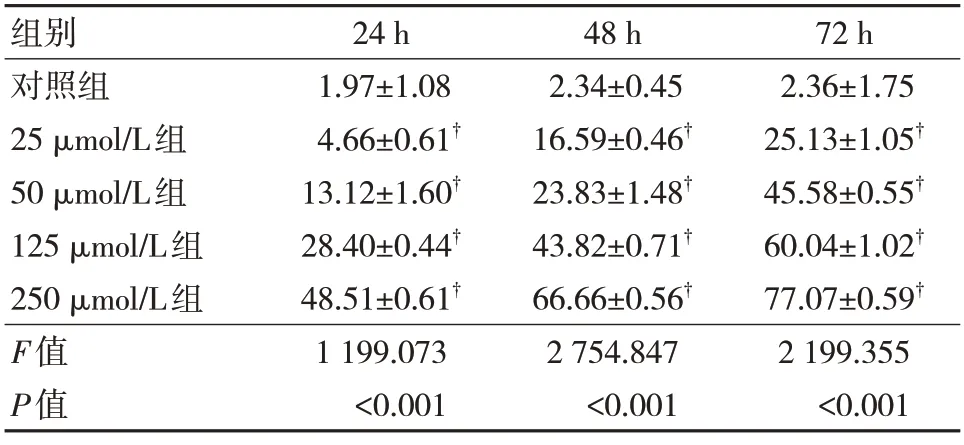
表3 各组细胞凋亡率的比较(,%)
注:†与对照组比较,P<0.05。
2.4 瑞马唑仑对PC-12 细胞中凋亡相关蛋白Bax和Bcl-2 表达的影响
结果显示,瑞马唑仑处理后PC-12 细胞内促凋亡蛋白Bax 的表达水平显著升高,而抗凋亡蛋白Bcl-2 的表达水平显著降低,且均具有浓度依赖性。提示瑞马唑仑可通过诱导PC-12 细胞内Bax蛋白表达,抑制Bcl-2 蛋白表达来促进凋亡。见图2和表4。

图2 瑞马唑仑对PC-12 细胞Bax 和Bcl-2 蛋白表达的影响

表4 各组细胞Bax、Bcl-2 蛋白水平比较
3 讨论
瑞马唑仑是一种新型镇定药物,自2020 年12 月在中国被国家药品监督管理局批准使用以来,瑞马唑仑广泛地应用于成人全身麻醉和ICU 镇静[8]。除镇静作用外,瑞马唑仑还具有抑制肿瘤的作用,XU 等[3]发现瑞马唑仑能够抑制胶质瘤细胞生长,诱导细胞凋亡。本研究表明,瑞马唑仑能够显著抑制PC-12 细胞的增殖,表明瑞马唑仑具有抑制神经细胞瘤的作用。TNF-α、IL-6、IL-1β等炎症因子作为免疫应答的关键调节因子,在肿瘤复杂的病理生理机制中发挥着重要作用[9]。炎症介质和细胞效应因子是肿瘤局部环境的重要组成部分,有助于恶性细胞的增殖和生存,促进血管生成和转移,破坏适应性免疫反应,并改变对激素和化疗药物的反应[10-11]。我们检测了瑞马唑仑对PC-12 细胞炎症因子表达的影响,结果显示瑞马唑仑能够促进炎性因子TNF-α、IL-6 和IL-1β的释放,提示瑞马唑仑误导细胞凋亡在多细胞生物中是一个高度受控的生理过程,凋亡异常会导致多种疾病的发生[12]。细胞凋亡缺陷与多种疾病相关,包括自身免疫性疾病、神经退行性疾病、心脏病和癌症等[13]。研究表明,凋亡细胞的快速清除是诱导免疫耐受和预防炎症反应的关键。生理条件下,正常组织中游离的凋亡细胞很少。然而,吞噬细胞摄取死亡细胞的效率低下或凋亡率增加会导致游离凋亡细胞的继发性坏死,从而诱导促炎细胞因子的分泌[14]。本研究结果显示,瑞马唑仑处理后,PC-12 细胞的凋亡率显著升高,表明瑞马唑仑能够诱导PC-12 细胞的凋亡,发挥抗肿瘤作用。
Bcl-2 蛋白家族因其异常表达会导致多种疾病的发生而成为重要的药物靶点[15]。Bcl-2 是Bcl-2家族中的抗凋亡因子,对许多细胞系的诱导凋亡具有保护作用,而家族中的其他蛋白质如Bax 具有相反的效果,能够促进细胞凋亡[16]。研究表明,Bcl-2 可以与其他蛋白质如Bax 相互作用形成异二聚体,Bax 在细胞中的表达可以抵消Bcl-2 的作用[17]。本研究结果显示,瑞马唑仑能够上调PC-12 细胞中促凋亡蛋白Bax 的表达,并下调抗凋亡蛋白Bcl-2 的表达,提示瑞马唑仑可通过调节凋亡相关蛋白的表达促进PC-12 凋亡,这与YANG等[18]的研究结果一致。
综上所述,瑞马唑仑可诱导PC-12 细胞的炎症反应,并能通过调节凋亡相关蛋白的表达促进PC-12 凋亡。

