一种抗原稳定剂的研究及应用
王慧敏,杨阳,逯阵毫,闫淼,王玉堂
(郑州安图生物工程股份有限公司,河南 郑州 450000)
体外诊断试剂是指用于人体血清或血浆样本检测的试剂,其中包含试剂盒、校准品等产品,与仪器、设备或系统配合使用,也可单独使用,最终对疾病预防、诊断、治疗检测、预后观察[1]。体外诊断试剂稳定性是指产品在生产企业规定的条件下储存,在规定的时间内保持其性能特性的能力[2]。稳定性作为评价体外诊断试剂保持产品性能的重要指标,对产品的研发生产、运输、保存和使用等环节具有重要意义。在诊断试剂研发过程中,试剂的稳定性是制约该类产品市场化的关键。国外已经有多想有关稳定剂的专利,而国内在诊断试剂稳定性方面还在探索阶段,其中包被抗原的稳定剂是我国诊断试剂研发过程汇总必须克服的瓶颈技术。体外诊断试剂组成成分中包含化学及生物活性物质,保持这些成分物理、化学、生物特性是实现产品稳定性的关键,任何影响产品组成成分特性的因素均有可能对产品稳定性造成影响[3]。为此,本研究对诊断试剂盒稳定性问题进行了剖析,筛选了一种包被抗原保护剂,以期为同类研究提供借鉴。
1 材料与方法
1.1 材料
表面羧基磁性纳米微粒购自德国Merk 公司;磁微粒包被抗体、磁微粒酶标抗抗体,单克隆抗原购自郑州伊美诺生物技术有限公司;牛血清白蛋白(BSA);磷酸氢二钠、磷酸二氢钠、氯化钠(纯度分析纯)购自美国sigma 公司;2-(N-吗啉)乙磺酸(MES)购自美国sigma 公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)购自美国sigma 公司;N-羟基琥珀酰亚(NHS)购自美国sigma 公司;PVA80(聚乙烯醇)、聚氧乙烯-聚丙乙烯-聚氧乙烯(PEO-PPO-PEO)三嵌段共聚物购自美国sigma 公司;聚乙二醇(PEG)购自美国sigma 公司;磁微粒检测混悬液,自制;
1.2 设备
化学发光免疫分析仪A2000 Plus(郑州安图生物工程股份有限公司);垂直混匀器(宁波新芝生物科技有限公司,型号:HS-3);星星陈列柜(星星制冷设备有限公司,型号:LSC-518Y);Sepmag A200 磁分离器;隔水式电热恒温培养箱(上海跃进医疗器械有限公司,型号:HH-B11·360-BS-II)
1.3 稳定性考核实验
采用EDC+NHS 活化磁微粒表面的羧基,后加入包被抗体通过与磁珠上活化后的羧基进行偶联反应,具体步骤如下:抽取30 μL 磁微粒原液,用PBS 缓冲液(pH 7.0)洗涤4 次,每次5 min。洗涤结束后,去除上清,加入50 μL 20 mg/mL EDC MES 缓冲液和50 μL 20 mg/mL NHS MES 缓冲液,混匀并震荡反应1 h,磁吸去除上清加入300 μL MES 缓冲液洗涤2 次,加入7.5 μL 包被抗体,震荡反应2 h,去上清后加入300 μL 1% BSA 磷酸盐缓冲液封洗10 min,重复洗涤3 次,磁吸去除上清。最后用1% BSA 磷酸盐缓冲液定容至3 mL,2~8℃保存备用。
1.4 稳定性考核实验——酶、抗原
将包被好的磁微粒混悬液,酶标抗体单组份,抗原单组份分别放置于4℃、37℃,放置天数为4 d。放置结束后,将磁微粒混悬液放置于垂直混匀器上,混匀30 min,观察是否混匀,并用移液枪吹打直至混匀。将37℃加速后的磁微粒混悬液、酶、抗原整套组合后,拆解酶和抗原,组合3 套试剂进行A2000 Plus 上机实验。
1.5 抗原稳定性影响因素——离子强度及pH
抗原溶液配置:配置不同摩尔浓度的磷酸盐缓冲液,并调节至所需的pH 值,将抗原稀释至缓冲液中,搅拌均匀。将不同摩尔浓度、不同pH 值的抗原溶液,分别放置4℃、37℃,放置天数为3 d。放置结束,将不同的抗原溶液放置与垂直混匀器上,混匀30 min,与4℃磁微粒混悬液和酶组合成一整套试剂后,进行A2000 Plus 上机实验。
1.6 抗原稳定性影响因素——抗吸附
实验中用的试剂瓶为普通的塑料瓶,表面具有疏水性,抗原是两亲自性的一种蛋白,一段具有亲水端,一段为疏水链。在37℃加速过程中,温度升高,布朗运动加速,抗原分子疏水端以疏水作用力吸附于瓶壁上,溶液中抗原浓度降低,可能造成37℃加速后,与4℃相比,整套试剂发光值降低。
本实验选用硅化瓶,与普通的试剂瓶相比,其表面进行特殊的硅化处理,其疏水性低,亲水性增加。两种瓶(硅化瓶和试剂瓶-对照)分别分装抗原溶液,分别放置4℃、37℃,放置天数为3 d、7 d。放置结束后,将不同瓶的抗原溶液连瓶取出,放置混匀器上混匀30 min,与4℃磁微粒混悬液和酶组合成一整套试剂,在A2000 Plus 上进行测试。
与此同时,也可尝试在抗原溶液中的试剂瓶中,先加入亲水性的阻断剂如0.5%PVA、1%BSA和1%Casien,阻断其在试剂瓶内壁上的吸附,过夜处理瓶子。将三种抗原溶液瓶子和对照(1%PBS)抗原溶液处理的瓶子,分别分装抗原溶液,放置4℃、37℃,放置3 d。放置结束后,与4℃磁微粒混悬液和酶组合成一整套试剂,与对照整套试剂进行A2000 Plus 上机实验。
1.7 抗原稳定性影响因素——防聚集
聚合物分子通过吸附可有效的阻止颗粒间的聚集,是一种良好的分散剂,减少颗粒的团聚和沉积[4],基于此理论基础,通过加入醇类聚合物分子,少量吸附试剂瓶内部,大量吸附于抗原表面,探究对稳定性的影响。纳米颗粒的团聚和沉积
将三类聚合物分子PVA、PEO-PPO-PEO、聚乙二醇醇入抗原溶液中,分别分装抗原溶液,放置4℃、37℃,放置3 d。放置结束后,与4℃磁微粒混悬液和酶组合成一整套试剂,与对照整套试剂进行A2000 Plus 上机实验。
2 结果
2.1 稳定性考核实验——酶、抗原
试剂组分:磁微粒、酶、抗原37℃加速4 d后,将三组分全部加速后组合上机检测,与4℃全套试剂组分(磁微粒、酶、抗原)对比,发现发光值偏差降幅在55%左右。将37℃的磁微粒和抗原组分替换为4℃的磁微粒和抗原,即只将酶进行37℃加速4 d,与4℃全套试剂对比,发光值降幅明显降低为6%。继而将抗原单组份进行37℃加速4 d,发光值降幅为49%。由此可见,整套试剂加速后降幅较大(55%),稳定性较差的主要原因是抗原单组份引起的,其加速后不稳定,引起整套发光值降幅显著升高。见表1。
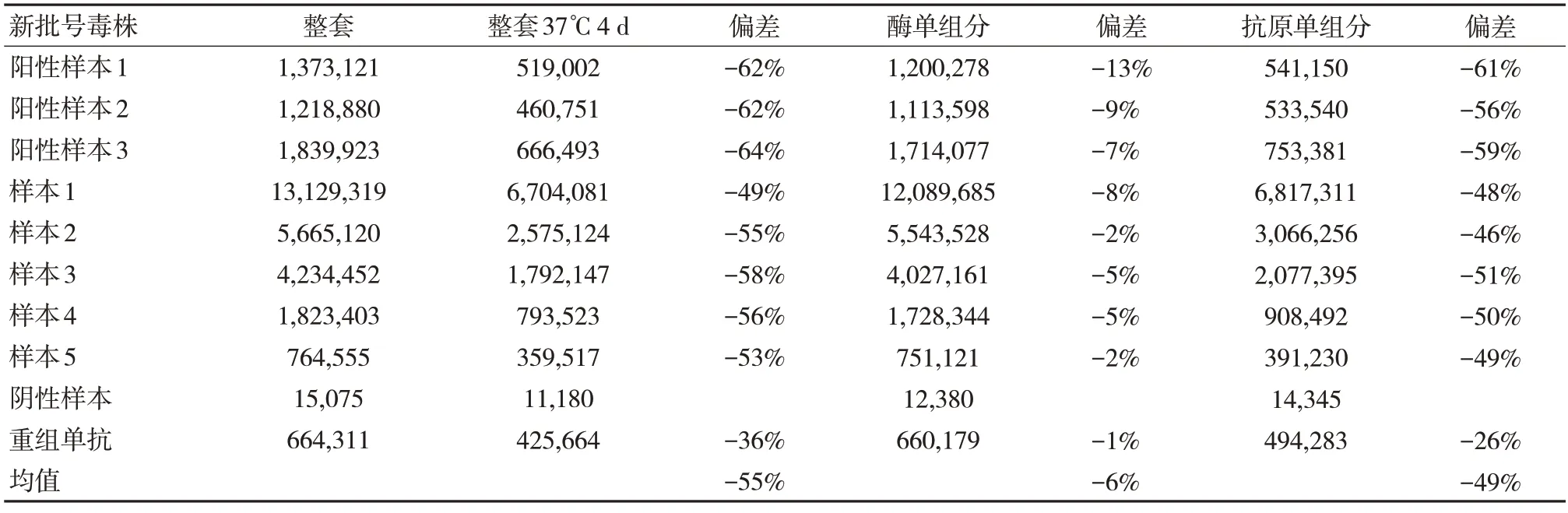
表1 试剂组三组分加速后拆分稳定性
2.2 抗原稳定性影响因素——离子强度及PH
不同摩尔浓度及pH 值的磷酸盐缓冲液稀释抗原,制备成抗原溶液,37℃加速3 d 后发现:同样摩尔浓度不同pH 值磷酸盐缓冲液配置的抗原溶液,37℃加速后,稳定性无明显差异;同一pH 不同磷酸缓冲盐溶液配置的抗原溶液,37℃加速后,稳定性无明显差异。由此可见,抗原缓冲液的离子强度和pH 对抗原稳定性的影响不大。见表2。
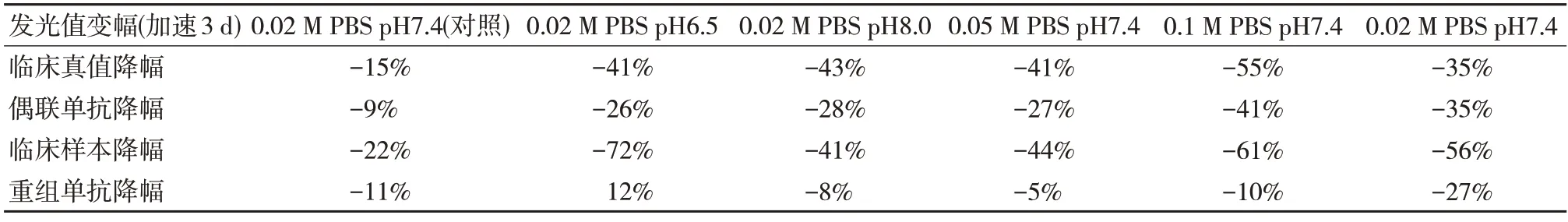
表2 不同摩尔浓度及pH 抗原溶液稳定性
2.3 抗原稳定性影响因素——抗吸附
抗吸附分析包括硅化瓶比较实验和热封实验,见表3、表4。将硅化瓶和试剂瓶(对照)进行37℃加速3 d、7 d 后,与4℃整套试剂对比,其整套试剂的发光值降幅较大;阻断剂0.5%PVA、1%BSA、1%Casein 预处理瓶内壁后,抗原溶液37℃加速3 d 后,分别与4℃的全套试剂对比,发光值均降幅较大,无任何改善。
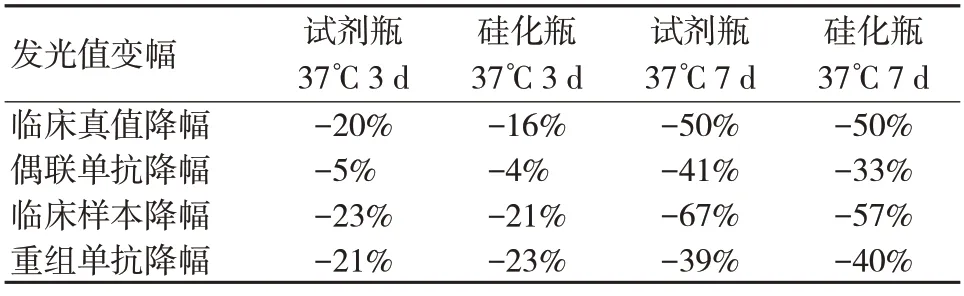
表3 硅化瓶处理后抗原溶液稳定性
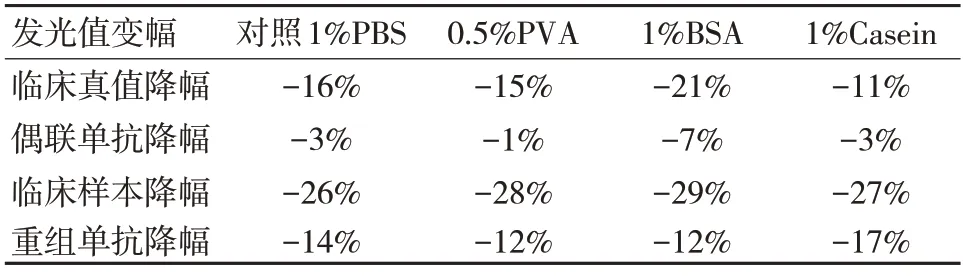
表4 热封实验后抗原溶液稳定性
由此得出,抗原稳定性的降低并不是由于吸附到瓶身内壁抗原溶液浓度降低造成的,可能存在微量的抗原吸附于瓶内壁,但并不足以显著的引起发光值降低。
2.4 抗原稳定性影响因素——防聚集
如表5 所示,PVA,PEO-PPO-PEO、PEG 加入到抗原溶液中(添加比例0.1%),分别放置37℃进行加速3 d 后,与对照相比,发现抗原溶液中加入PVA、PEG,发光值降幅仍然较大;抗原溶液中加入PEO-PPO-PEO,加速3 d 后,与对照比,其发光值降幅得到明显的提升。将抗原溶液放置37℃加速7 d,其中泊洛沙姆12600、泊洛沙姆14600 发光值几乎不再降低,对照降幅在50%左右,而泊洛沙姆8400 稳定性较差,发光值降幅较大;将泊洛沙姆12600、泊洛沙姆14600 继续加速考核至10 d,其发光值降幅依然没有明显增加,而对照则降幅持续升高至60%;重复泊洛沙姆12600、泊洛沙姆14600 考核稳定性,37℃ 3 d,其稳定性依然较对照有显著提升。
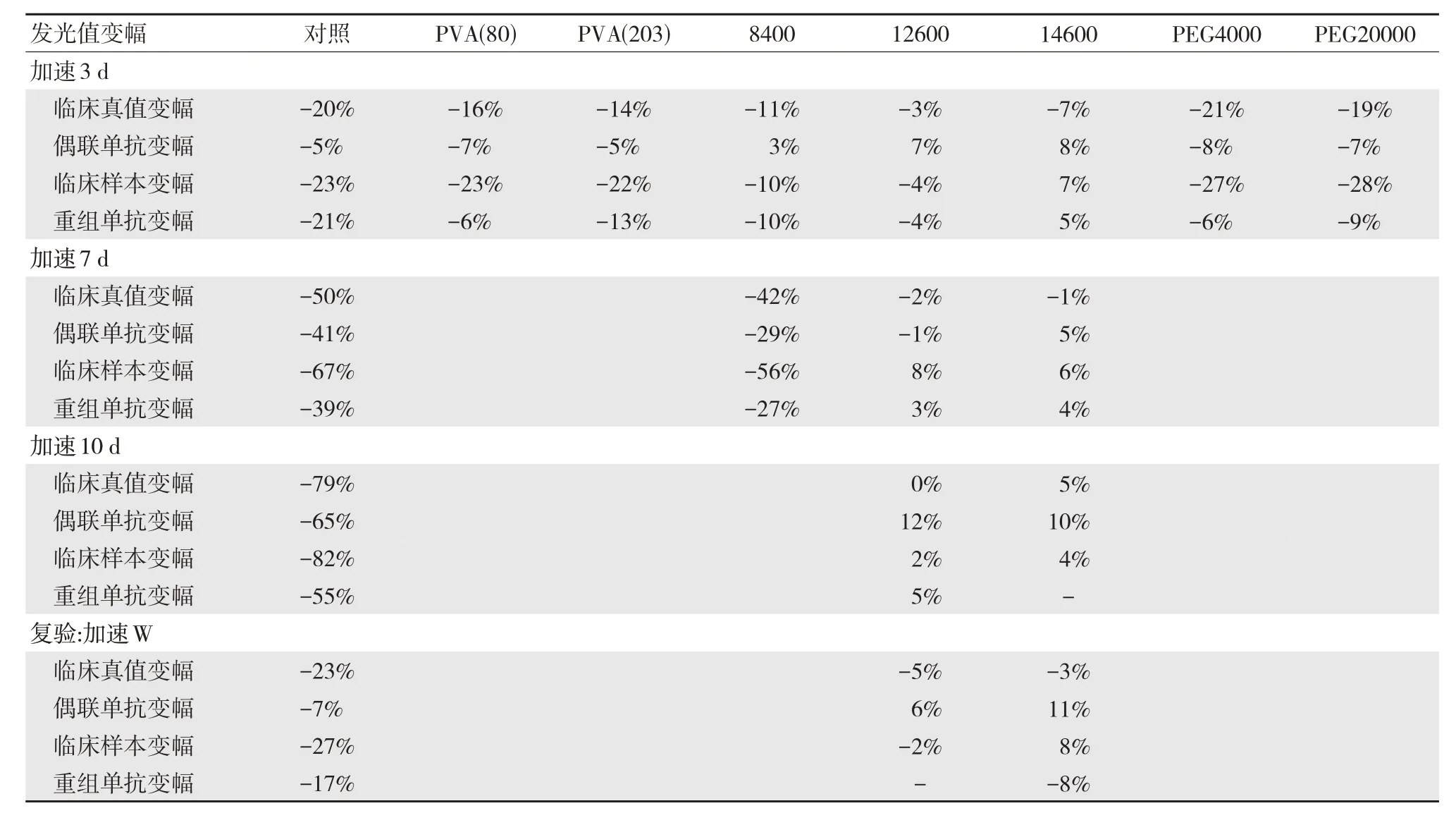
表5 不同聚合物分子对抗原稳定性的影响
取出试剂瓶观察发现,如图1 所示:放置10 d 后,4℃放置的试剂瓶瓶内的抗原溶液均为透明无色的溶液;37℃放置10 d,对照组瓶内溶液颜色透明度发生明显变化,对照组抗原溶液成浑浊状态,而加入泊洛沙姆12600、泊洛沙姆14600的抗原溶液仍为透明的液体。笔者猜测:高分子聚合物具有两亲性,疏水端吸附于抗原的疏水端,增加抗原的亲水性,提高抗原的稳定性。

图1 抗原溶液透明度对照
3 讨论
本研究通过拆分实验,得出抗原单组份不稳定,并从pH、离子强度,瓶身吸附,聚集等几个方面分别分析了抗原溶液不稳定的因素。实验结果表明,抗原溶液热加速后不稳定,通过改变抗原溶液粒子浓度、pH,更换不同厂家的BSA 及试剂瓶的亲水预处理,抗原溶液的稳定性均未的到解决。通过抗原溶液中加入聚醚类高分子,其稳定性得到明显改善提升。聚合物分子具有良好的可溶解性,溶解于抗原溶液中。高分子聚合物PEO-PPO-PEO 具有生物相容性,被广泛应用于药物递送[4-5]、基因载体[4]介孔材料制备[6-7]、酶修饰[8-9]等领域。其具有两亲性,其疏水基通过疏水作用力与抗原的疏水部分结合,亲水基暴露与外侧,增加了抗原的溶解性,提升抗原在溶液中的稳定性。与此同时,聚合物分子吸附于抗原表面,增加了抗原分子空间位阻,降低抗原自聚,提高抗原的分散性,提升抗原稳定性。

