大叶藤黄叶片的化学成分及其抗氧化活性研究
权帆, 张健, 颜健, 黎平
大叶藤黄叶片的化学成分及其抗氧化活性研究
权帆, 张健, 颜健, 黎平*
(华南农业大学资源环境学院,农业农村部华南热带农业环境重点实验室,广州 510642)
为了解药用植物大叶藤黄()叶片的化学成分,采用UPLC-QTOF-MS从叶片中得到19个化合物,主要为双黄酮类、黄酮类和间苯三酚类化合物。采用色谱分离法从叶片的80%甲醇提取物中分离得到5个单体化合物,根据理化性质及波谱数据,分别鉴定为二氢山奈酚 (1)、dulcisbiflavonoid A (2)、7-去甲基银杏双黄酮(3)、mono-[2-(4-carboxy- phenoxycarbonyl)-vinyl] ester (4)、山奈酚(5)。化合物1和2为首次从大叶藤黄中分离得到,化合物3和4为首次从藤黄属植物中分离得到。化合物1和5 清除DPPH自由基的IC50值分别为146.8和39.0g/mL,表明其具有抗氧化活性。
大叶藤黄;叶;化学成分;黄酮类;抗氧化活性
大叶藤黄()为藤黄科(Clusiaceae)藤黄属植物,俗称假山竹,主要分布在云南南部、西南部至西部、广西南部、台湾南部、福建、广东、海南等地区[1]。在民间大叶藤黄广泛用于治疗腹泻、痢疾、恶心和呕吐[2],大叶藤黄也是我国传统的傣药之一[3],茎和叶的汁用于驱虫, 清火退热,解食物中毒,其成熟果实可直接食用, 味道较酸,嫩叶作为蔬菜煮食,而在东南亚地区,有许多国家以大叶藤黄入药[4]。
现代植物化学研究表明,大叶藤黄的化学成分为苯甲酮、黄酮、双黄酮、三萜和多异戊烯基呫吨酮等化合物[5]。为了进一步了解大叶藤黄的化学成分,促进该植物的综合开发利用,本研究对云南西双版纳产大叶藤黄叶片的化学成分进行分析,超高液相-四极杆飞行时间质谱联用仪(UPLC-QTOF-MS)分析和鉴定了19个化合物,通过多种色谱法和波谱法分离和鉴定了5个化合物。
1 材料和方法
1.1 仪器和材料
AVANCE-600型核磁共振波谱仪(德国Bruker公司);紫外光谱仪Evolution 300紫外-可见光谱仪(Thermo Fisher Scientific);TLC (薄层层析)硅胶板和柱色谱硅胶(青岛海洋化工有限公司);MCI GEL (日本三菱公司);Sephadex LH-20葡聚糖凝胶(美国安玛西公司);超高液相-四极杆飞行时间质谱联用仪(UPLC-QTOF-MS, Xevo G2, 美国沃特世科技有限公司);Synergy MX酶标仪(BIOTEK公司);色谱纯甲酸和乙腈(美国Thermo Fisher公司);其余试剂均为分析纯分析级试剂(广州化学试剂厂)。
本研究所用大叶藤黄采自云南西双版纳,经华南农业大学羊海军博士鉴定为藤黄科藤黄属植物大叶藤黄(),凭证标本存放于华南农业大学标本馆。
1.2 UPLC-QTOF-MS分析
供试品溶液的制备 大叶藤黄叶片经粉碎后,以体积分数80%甲醇浸泡提取3次,合并提取液,减压浓缩后得到浸膏,取适量叶片提取物溶于色谱甲醇,配制成1 mg/mL样品溶液,用0.22m微孔滤膜过滤,装于2 mL液相样品瓶,备用。
色谱条件 Waters ACQUITY UPLC®BEH C18色谱柱(2.1 mm×100 mm, 1.70m);流动相: A为0.1%甲酸-水溶液,B为0.1%甲酸-乙腈溶液,梯度洗脱程序为:0~1.0 min,15%~20% B; 1.0~3.0 min, 20%~60% B;3.0~5.0 min, 60%~75% B;5.0~7.5 min, 75%~80% B; 7.5~8.5 min, 80%~95% B; 8.5~10.0 min,95% B; 10.0~10.1 min, 95%~15% B; 10.1~12 min, 15% B; 流速为0.3 mL/min; 柱温40 ℃; 进样量 2L。
质谱条件 质谱检测采用电喷雾离子源(ESI),在正离子模式和负离子模式下,质量扫描范围100~1 000 Da,正态的毛细管电压设定为3 kV, 负态的毛细管电压设定为1.5 kV,源温度保持在120 ℃。碰撞气体为氩气,氮气在400 ℃下用作去溶剂,扫描时间为0.5 s,通过MSE模式收集测试数据。
1.3 化合物的分离
将叶片用80%体积分数甲醇提取得到的浸膏,均匀分散在适量纯水中,依次用等体积石油醚、氯仿和乙酸乙酯萃取后,减压浓缩获得各个萃取层的提取物。其中,乙酸乙酯层浸膏(450 g)进行硅胶柱色谱分离,以不同比例的二氯甲烷-甲醇(100:0→ 0:100)进行梯度洗脱,得到11个组分Fr.1~Fr.11。取组分Fr.4 (16 g)过MCI柱,得到组分Fr.4-1,Fr.4-1经硅胶柱层析,二氯甲烷-甲醇体系(40:1→8:1)梯度洗脱,得到29个子馏分(Fr.4-1-1~Fr.4-1-29)。馏分Fr.4-1-12经Sephadex LH-20纯化得化合物1 (9 mg), Fr.4-1-11经Sephadex LH-20纯化得化合物2 (10 mg),Fr.4-1-21经Sephadex LH-20纯化得化合物3 (12 mg),合并Fr.4-1-13和Fr.4-1-14经Sephadex LH-20纯化得化合物4 (20 mg)和5 (13 mg)。
1.4 结构鉴定
化合物1 白色粉末;HR-ESI-MS:287.057 4 [M − H]−, 分子式C15H12O6;1H NMR (600 MHz, DMSO-6):11.91 (s, 1H, 5-OH), 7.32 (d,= 8.5 Hz, 2H, H-2′, 6′), 6.80 (d,= 8.5 Hz, 2H, H-3′, 5′), 5.93 (d,= 2.0 Hz, 1H, H-8), 5.87 (d,= 2.0 Hz, 1H, H-6), 5.05 (d,= 11.4 Hz, 1H, H-2), 4.59 (dd,= 11.3, 2.8 Hz, 1H, H-3);13C NMR (150 MHz, DMSO-6):197.93 (C-4), 166.88 (C-5), 163.39 (C-7), 162.66 (C-9), 157.82 (C-4′), 129.54 (C-2′, 6′), 127.65 (C-1′), 115.01 (C-3′, 5′), 100.55 (C-10), 96.13 (C-6), 95.10 (C-8), 82.97 (C-2), 71.56 (C-3)。以上数据与文献[6]报道一致,故鉴定为二氢山奈酚。
化合物2 黄色粉末;HR-ESI-MS:675.221 9 [M + H]+, 分子式C40H34O10;1H NMR (600 MHz, DMSO-6):13.40 (s, 1H, 5″-OH), 12.98 (s, 1H, 5-OH), 10.80 (s, 1H), 10.27 (s, 1H), 7.89 (d,= 2.2 Hz, 1H, H-2′), 7.78 (d,= 2.0 Hz, 1H, H-6′), 7.54 (d,= 8.8 Hz, 2H, H-2‴, H-6‴), 6.83 (s, 1H, H-3), 6.79 (s, 1H, H-3″), 6.71 (d,= 8.7 Hz, 2H, H-3‴, H- 5‴), 6.46 (d,= 1.8 Hz, 1H, H-8), 6.18 (d,= 1.9 Hz, 1H, H-6), 5.44 (t,= 7.1 Hz, 1H, H-8′), 5.25 (t,= 7.1 Hz, 1H, H-10″), 3.46 (d,= 7.1 Hz, 1H, H-7′), 3.43 (d,= 7.2 Hz, 1H, H-9″), 1.76 (d,= 4.8 Hz, 9H, H-10′, H-11′, H-13″), 1.65 (s, 3H, H-12″);13C NMR (150 MHz, DMSO-6):182.23 (C-4″), 181.66 (C-4), 164.08 (C-7), 163.87 (C-2), 163.32 (C-2″), 161.42 (C-5, C-7″), 160.93 (C-4‴), 157.97 (C-4′, C-5″), 157.31 (C-8a), 152.86 (C-8a″), 131.96 (C-9′), 130.61 (C-11″), 129.55 (C-3′), 129.30 (C-6′), 128.08 (C-2‴, C-6‴), 127.55 (C-2′), 122.38 (C-10″), 122.31 (C-8′), 121.41 (C-1‴), 115.69 (C-3‴, C-5‴), 111.51 (C-6″), 103.89 (C-4a″), 103.67 (C-4a, C-8″), 102.98 (C-3), 102.50 (C-3″), 98.80 (C-6), 93.98 (C-8), 28.79 (C-7′), 25.61 (C-12″), 25.52 (C-11′), 21.48 (C-9″), 17.80 (C- 10′), 17.75 (C-13″)。以上数据与文献[7]报道一致, 故鉴定为dulcisbiflavonoid A。
化合物3 黄色粉末;HR-ESI-MS:551.098 6 [M − H]−,分子式C31H20O10;1H NMR(600 MHz, DMSO):13.07 (s, 1H, OH), 12.97 (s, 1H, OH), 8.00 (dd,= 7.6, 2.0 Hz, 2H, H-2′, 6′), 7.67 (d,= 9.0 Hz, 2H, H-2′′′, 6′′′), 7.15 (d,= 9.2 Hz, 1H, H-5′), 6.92 (d,= 9.0 Hz, 2H, H-3′′′, 5′′′), 6.87 (s, 1H, H-3′′), 6.82 (s, 1H, H-3), 6.45 (d,= 2.1 Hz, 1H, H-8), 6.41 (s, 1H, H-6′′), 6.18 (d,= 2.1 Hz, 1H, H-6), 3.75 (s, 3H, OCH3);13C NMR (150 MHz, DMSO):182.12 (C-4′′), 181.71 (C-4), 164.10 (C-2), 163.81 (C-2′′), 163.19 (C-7), 162.18 (C-7′′), 161.93 (C-5), 161.44 (C-4′′′), 160.54 (C-5′′), 159.65 (C-4′), 157.36 (C-8a), 154.54 (C-8a′′), 131.36 (C-6′), 127.96 (C-2′, C-2′′′), 127.78 (C-6′′′), 122.99 (C-3′), 120.94 (C-1′), 120.05 (C-1′′′), 116.26 (C-5′, C-3′′′), 114.46 (C-5′′′), 104.07 (C-8′′), 103.65 (C-4a′′), 103.6 (C-4a), 103.22 (C-3), 102.99 (C-3′′), 98.82 (C-6), 98.77 (C-6′′), 93.93 (C-8), 55.48 (OCH3)。以上数据与文献[8]报道一致,故鉴定为7-去甲基银杏双黄酮。
化合物4 黄色粉末;HR-ESI-MS:357.135 4 [M + H]+,分子式C18H12O8;1H NMR (600 MHz, DMSO-6):7.63 (d,= 8.5 Hz, 2H, H-2, H-6), 7.52 (d,= 8.0 Hz, 2H, H-13, H-15), 7.50 (s, 1H, H-8), 6.80 (d,= 8.3 Hz, 2H, H-3, H-5), 6.76 (d,= 8.5 Hz, 2H, H-12, H-16), 6.73 (d,= 13.1 Hz, 1H, H-2), 6.30 (d,= 15.9 Hz, 1H, H-9), 5.73 (d,= 12.8 Hz, 1H, H-6);13C NMR (150 MHz, DMSO-6):168.15 (C-10), 167.93 (C-17), 159.73 (C-7), 158.60 (C-18), 144.26 (C-8), 141.43 (C-1), 132.39 (C-2, C-6), 130.18 (C-13, C-15), 125.93 (C-11), 125.42 (C-6), 117.32 (C- 3, C-5), 115.90 (C-9), 115.54 (C-12, C-16), 115.00 (C- 14)。以上数据与文献[9]报道一致,故鉴定为mono- [2-(4-carboxy-phenoxycarbonyl)-vinyl] ester。
化合物5 黄色粉末;HR-ESI-MS:287.056 7 [M + H]+,分子式C15H10O6;1H NMR (600 MHz, DMSO-6):12.48 (s, 1H, 5-OH), 10.79 (s, 1H, 7-OH), 10.11 (s, 1H, 4′-OH), 9.38 (s, 1H, 3- OH), 8.04 (d,= 9.0 Hz, 2H, H-2′, 6′), 6.93 (d,= 9.0 Hz,2H, H-3′, 5′), 6.44 (d,= 2.0 Hz, 1H, H-8), 6.19 (d,= 2.0 Hz, 1H, H-6);13C NMR (150 MHz, DMSO-6):175.93 (C-4), 163.91 (C-7), 160.74 (C-5), 159.22 (C- 9), 156.21 (C-4′), 146.84 (C-2), 135.69 (C-3), 129.53 (C-2′, C-6′), 121.71 (C-1′), 115.47 (C-5′, C-3′), 103.08 (C-10), 98.23 (C-6), 93.51 (C-8)。以上数据与文献[10]报道基本一致,故鉴定为山奈酚。
1.5 DPPH自由基清除能力测定
将分离得到的化合物配制成质量浓度为5、10、20、40、60、80、100g/mL的样品,以维生素C为阳性对照,取样品和维生素C溶液各20L,加入100 mg/L的DPPH乙醇溶液180L,避光反应30 min,在517 nm下检测OD值。DPPH清除率(%)= [1-(1-2)/0]×100%, 式中,0为空白对照吸光度值,1为样品溶液的吸光度,2为无水乙醇与样品溶液的吸光度值。
2 结果和分析
2.1 大叶藤黄叶片的液相质谱分析
利用UPLC-QTOF-MS对大叶藤黄叶片进行化学成分分析,得到叶片提取物中主要成分的保留时间和准分子离子峰,此外,还从MSE数据分析模式中获得所有化合物的碎片离子或二级质谱。通过准确分子量,MSE二级质谱与公共质谱数据库(METLIN,MassBank,ReSpect等)及藤黄属植物化合物的文献比较,鉴定化合物的可能结构或类型。初步从大叶藤黄叶片中鉴定了19个化合物,包括双黄酮类、黄酮类和间苯三酚类化合物(表1),大叶藤黄叶片提取物的总离子图见图2。
通过与文献对比以及分析离子断裂途径,共鉴定出2个黄酮和10个双黄酮类化合物。峰2和13由准分子离子峰339.027 6 [M - H]–和593.127 4 [M - H]–推断分子式分别为C15H15O9和C30H25O13, 经文献比对,分别鉴定为eucryphin和银椴甙;峰4 由准分子离子峰719.157 0 [M + H]+推断分子式为C36H30O16。在二级质谱图中,其进一步产生557.108 0 [M + H]+碎片离子,该碎片离子在C环进行Diels-Alder重排,得到431.071 0 [M + H]+碎片离子,随后该碎片离子失去羰基得到403.082 6 [M + H]+碎片离子,通过裂解途径(图3)初步鉴定峰4为福木苷。
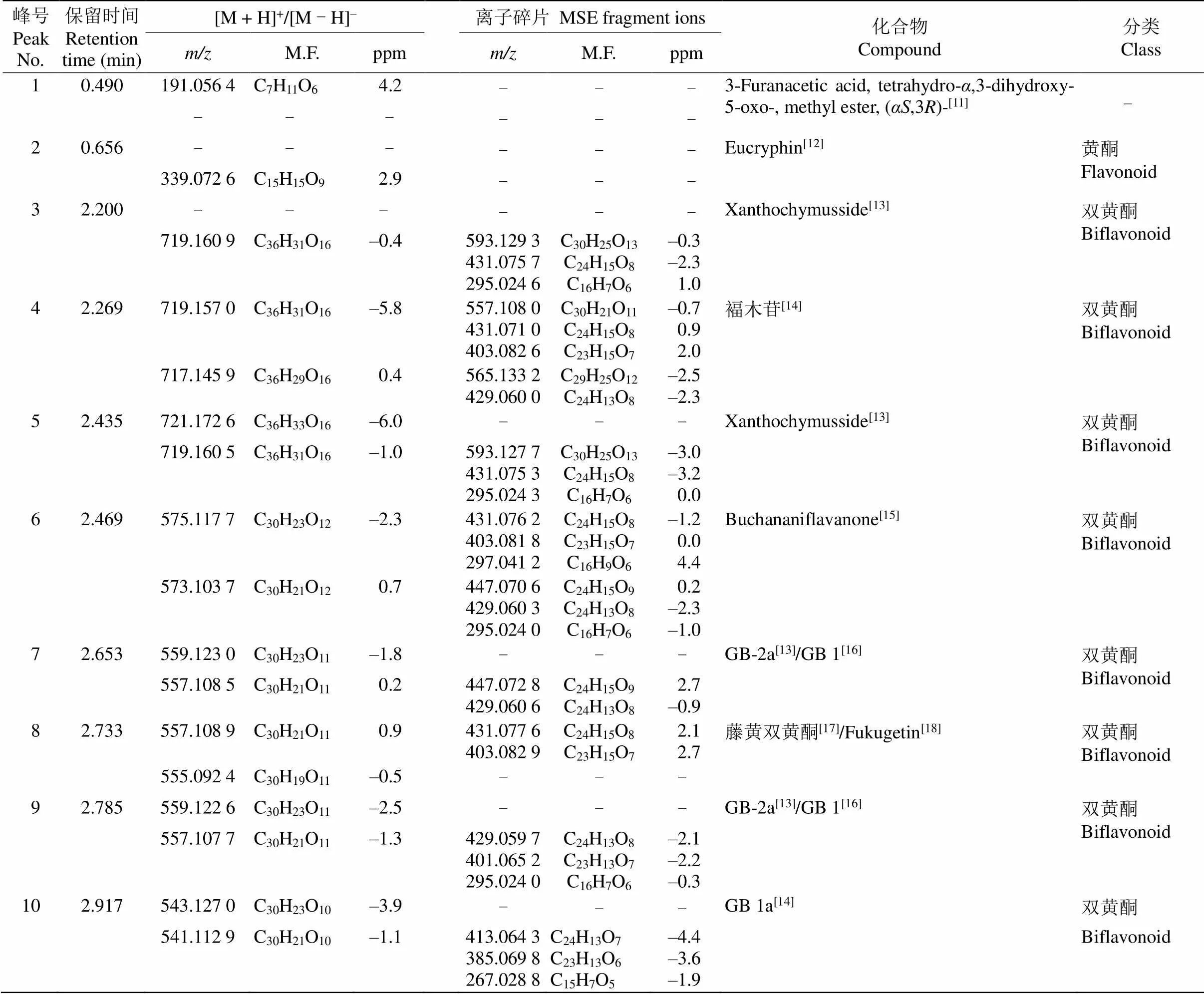
表1 大叶藤黄叶片化合物UPLC-QTOF-MS检测结果
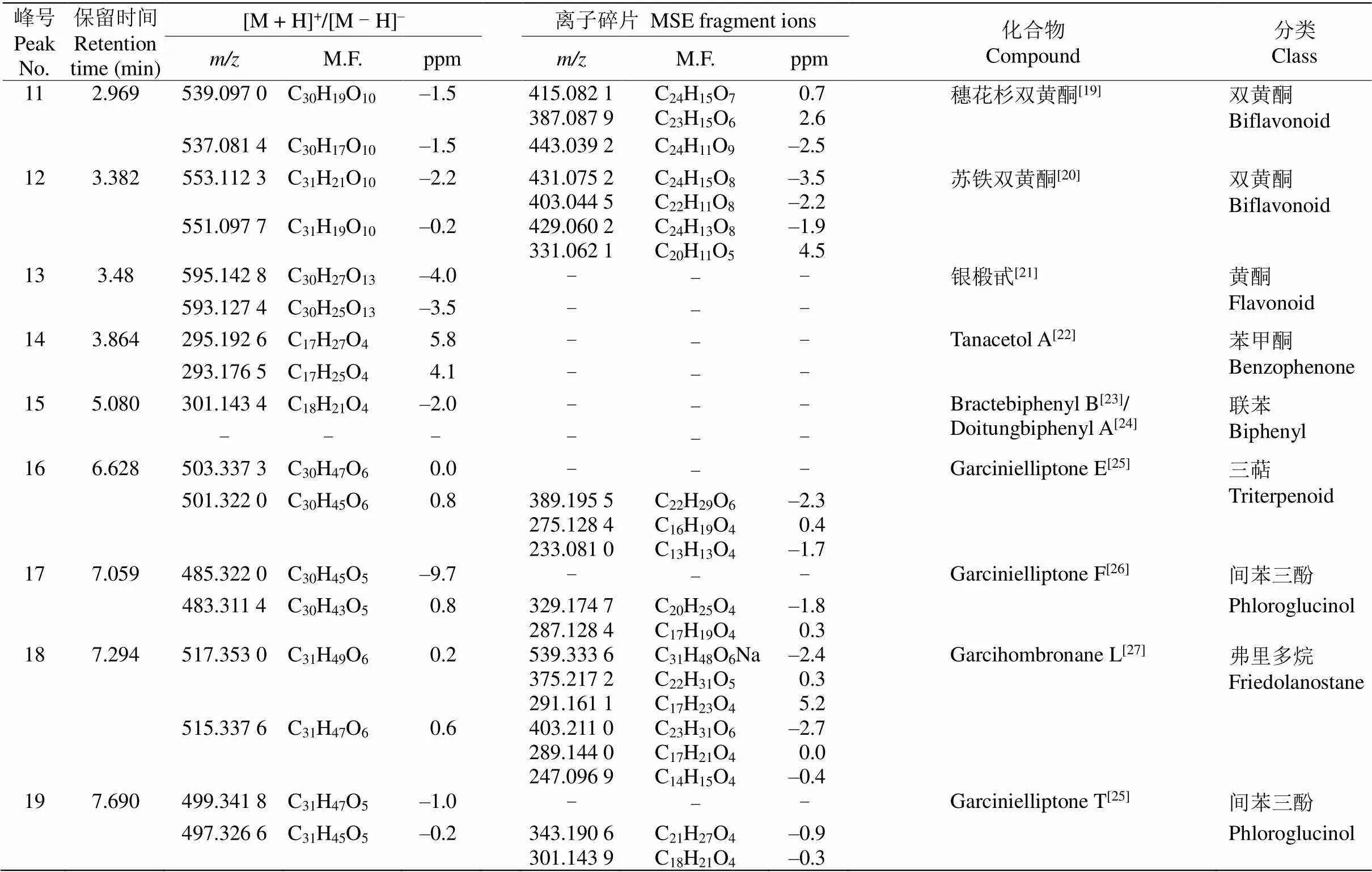
续表(Continued)

图2 大叶藤黄叶片提取物的负态总离子图。1~19见表1。
在初步分离鉴定叶片中化合物的过程中,通过数据库比较及推断离子片段裂解途径,共鉴定出2个间苯三酚类化合物。峰17由准分子离子峰483.311 4 [M - H]–推断分子式为C30H44O5,特征碎片离子为329.174 7 [M - H]–和287.128 4[M - H]–,通过裂解途径(图4)初步鉴定峰17为garcinielliptone F。
2.2 DPPH自由基清除能力
从大叶藤黄中分离得到的化合物1和5均表现出有效的DPPH自由基清除效果,在5~100g/mL范围内,其清除能力随着质量浓度的升高而逐渐增强,IC50值分别为146.8和39.0g/mL (图5)。
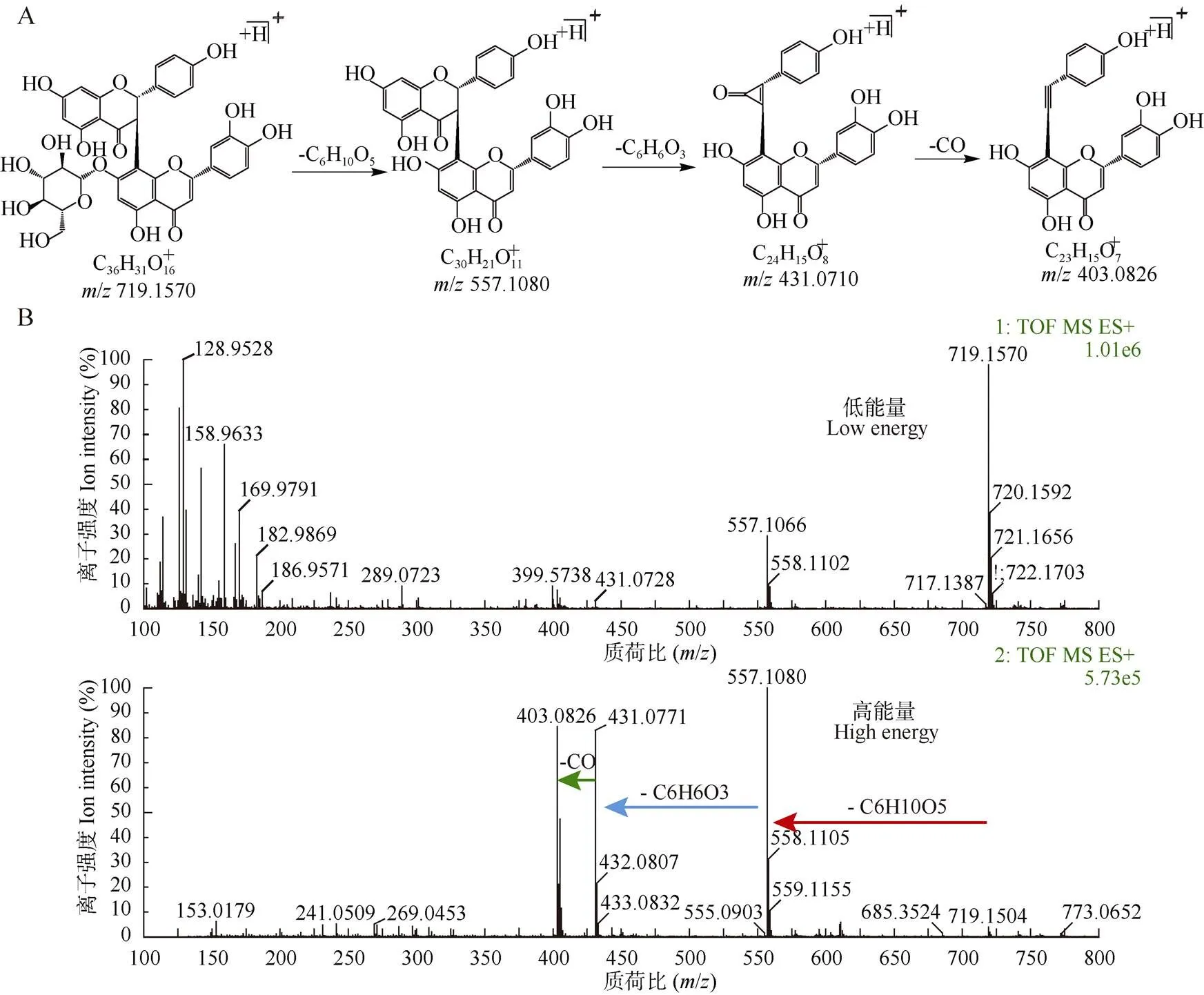
图3 褔木苷(峰4)的推断过程。A:褔木苷质谱裂解途径; B: MSE质谱图谱(正态)。

图4 garcinielliptone F (峰17)的推断过程。A: garcinielliptone F质谱裂解途径; B: MSE质谱图谱(负态)。

图5 化合物1和5对DPPH自由基的清除作用
3 结论和讨论
本研究采用UPLC-QTOF-MS对大叶藤黄叶片的主要化学成分进行分析,尝试性地鉴定出19个化合物,主要为双黄酮类、黄酮类和间苯三酚类化合物,其中,峰1、2、5、13~19为首次从该植物中报道。现代药理研究证明,黄酮类化合物具有抗肿瘤、抗自由基、抗氧化等作用[28]。此外,从大叶藤黄中分离鉴定了5个化合物,分别为二氢山奈酚(1)、dulcisbiflavonoid A (2)、7-去甲基银杏双黄酮(3)、mono-[2-(4-carboxy-phenoxycarbonyl)-vinyl] ester (4)、山奈酚(5)。其中,化合物1和2为首次从大叶藤黄中分离得到,化合物3和4为首次从藤黄属植物中分离得到;化合物1和5对DPPH自由基具有较强的清除活性,IC50值分别为146.8和39.0g/mL,其他化合物未显示活性。
据报道,化合物1通过抑制活性T细胞的细胞核因子活性来调节Ca2+内流,从而抑制T细胞的活性[29],同时,该化合物也对MCF7细胞系具有一定的抑制作用,IC50值为12.5g/mL[30];化合物3对细胞色素P450 2J2 (CYP2J2)具有较强的抑制作用, 可以作为CYP2J2抑制剂用于药物代谢[31];化合物5具有抗氧化、抗菌、抗炎、降脂以及抗癌效应等多种生物学作用[32]。本研究所得化合物可用于相关活性筛选,以期为大叶藤黄进行活性化学成分开发和利用提供参考。
[1] SONG J L, GAO H, YUAN L, et al. Study on the chemical constituents of[J]. J Anhui Agric Sci, 2015, 43(32): 222– 224. [宋敬丽, 高慧, 袁林, 等. 大叶藤黄化学成分研究 [J]. 安徽农业科学, 2015, 43(32): 222–224. doi: 10.3969/j.issn.0517-6611.2015. 32.077.]
[2] JI F, LI Z L, NIU S L, et al. Studies on the chemical constituents of the barks of[J]. Chin J Med Chem, 2012, 22(6): 507–510. [季丰, 李占林, 牛生吏, 等. 大叶藤黄茎皮化学成分研究 [J]. 中国药物化学杂志, 2012, 22(6): 507–510. doi: 10.14142/j.cnki. cn21-1313/r.2012.06.004.]
[3] ZHANG J Y, HAN Y M, CHANG Y P. Advances in studies on chemical constituents of plants inL. and their pharmaco- logical activities [J]. Drugs Clins, 2012, 27(3): 297–303. [张俊艳, 韩英梅, 常允平. 藤黄属植物的化学成分和药理作用研究进展 [J]. 现代药物与临床, 2012, 27(3): 297–303.]
[4] HAN Q B, QIAO C F, SONG J Z, et al. Cytotoxic prenylated phenolic compounds from the twig bark of[J]. Chem Biodivers, 2007, 4(5): 940–946. doi: 10.1002/cbdv.200790083.
[5] KHAIRINA N, HASSAN N C, TAHER M, et al. Phytochemical constituents and pharmacological properties of: A review [J]. Biomed Pharmacother, 2018, 106: 1378–1389. doi: 10. 1016/j.biopha.2018.07.087.
[6] MALMIR M, GOHARI A R, SAEIDNIA S, et al. A new bioactive monoterpene-flavonoid from[J]. Fitoterapia, 2015, 105: 107–112. doi: 10.1016/j.fitote.2015.06.012.
[7] Saelee A, Phongpaichit S, Mahabusarakam W. A new prenylated biflavonoid from the leaves of[J]. Nat Prod Res, 2015, 29(20): 1884–1888. doi: 10.1080/14786419.2015.1010087.
[8] Feng W S, Zhu B, Zheng X K, et al. Chemical constituents of[J]. Chin J Nat Med, 2011, 9(2): 108–111. doi: 10.3724/SP.J.1009.2011.00108.
[9] Wei W X, Pan Y J, Chen Y Z, et al. Carboxylic acids from[J]. Chem Nat Compd, 2005, 41(1): 17–21. doi: 10.1007/s10600-005-0064-4.
[10] WANG J R, DUAN J A, ZHOU R H. Chemical constituents from the bark of[J]. Acta Bot Sin, 1999, 41(2): 209– 212. [王静蓉, 段金廒, 周荣汉. 连香树树皮化学成分的研究 [J]. 植物学报, 1999, 41(2): 209–212. doi: 10.3321/j.issn:1672-9072.999. 02.020.]
[11] Varugese S, Thomas S, Haleema S, et al. Synthesis of enantiopure concave (+)-avenaciolide and (–)-canadensolide skeletons [J]. Tetrahedron Lett, 2007, 48(46): 8209–8212. doi: 10.1016/j.tetlet. 2007.09.081.
[12] Yoshimura M, Ninomiya K, Tagashira Y, et al. Polyphenolic constituents of the pericarp of mangosteen (L) [J]. J Agric Food Chem, 2015, 63(35): 7670–7674. doi: 10.1021/acs. jafc.5b01771.
[13] Li Y F, Chen Y, Xiao C Y, et al. Rapid screening and identification of-amylase inhibitors fromusing enzyme- immobilized magnetic nanoparticles coupled with HPLC and MS [J]. J Chromatogr B, 2014, 960: 166–173. doi: 10.1016/j.jchromb.2014.04. 041.
[14] Pandey R, Chandra P, Kumar B, et al. Simultaneous deter- mination of multi-class bioactive constituents for quality assessment ofspecies using UHPLC-QqQLIT-MS/MS [J]. Ind Crops Prod, 2015, 77: 861–872. doi: 10.1016/j.indcrop.2015.09.041.
[15] Stark T D, Ranner J, Stiglbauer B, et al. Construction and application of a database for a five-dimensional identification of natural compounds inspecies by means of UPLC-ESI- TWIMS-TOF-MS: Introducing gas phase polyphenol conformer drift time distribution intensity ratios [J]. J Agric Food Chem, 2019, 67(3): 975–985. doi: 10.1021/acs.jafc.8b06157.
[16] Aravind A P A, Pandey R, Kumar B, et al. Phytochemical screening ofby HPLC-ESI-QTOF mass spectro- metry and cytotoxicity studies of the major biflavonoid fukugiside [J]. Nat Prod Commu, 2016, 11(12): 1839–1842.
[17] Aravind A P A, Pandey R, Kumar B, et al. Phytochemical screening ofby HPLC-ESI-QTOF mass spectro- metry and cytotoxicity studies of the major biflavonoid fukugiside [J]. Nat Prod Commun, 2016, 11(12): 1839–1842. doi: 10.1177/1934578X 1601101216.
[18] CHEN Y, GAN F, JIN S, et al. Adamantyl derivatives and rearranged benzophenones fromfruits [J]. RSC Adv, 2017, 7(28): 17289–17296. doi: 10.1039/C7RA01543G.
[19] Li P, Yue G G L, Kwok H F, et al. Using ultra-performance liquid chromatography quadrupole time of flight mass spectrometry-based chemometrics for the identification of anti-angiogenic biflavonoids from ediblespecies [J]. J Agric Food Chem, 2017, 65(38): 8348–8355. doi: 10.1021/acs.jafc.7b02867.
[20] Parveen N S, Singh M P, Khan U, et al. Flavonoid constituents of Gleaves [J]. Fitoterapia, 1994, 65(1): 89–90.
[21] Quan G H, Oh S R, Kim J H, et al. Xanthone constituents of the fruits ofwith anticomplement activity [J]. Phytother Res, 2010, 24(10): 1575–1577. doi: 10.1002/ptr.3177.
[22] Shiekh K A, Benjakul S, Sae-Leaw T. Effect of chamuang (Roxb.) leaf extract on inhibition of melanosis and quality changes of pacific white shrimp during refrigerated storage [J]. Food Chem, 2019, 270: 554–561. doi: 10.1016/j.foodchem.2018.07. 139.
[23] Xu X M, Shi J L, Li L, et al. Biphenyls from the twigs ofand their antitobacco mosaic virus activities [J]. Rec Nat Prod, 2016, 10(5): 566–571.
[24] Li Y K, Wang Z Y, Wu X X, et al. Biphenyl derivatives from the twigs ofand their biological activities [J]. Phyto- chem Lett, 2015, 11: 24–27.
[25] Grossman R B, Yang X W. Structural revision of garcinielliptin oxide and garcinielliptone E [J]. J Nat Prod, 2020, 83(6): 2041–2044. doi: 10.1021/acs.jnatprod.0c00306.
[26] Yun Y, Shioura M, Hitotsuyanagi Y, et al. Garcinielliptone G frominduces apoptosis in acute leukemia cells [J]. Molecules, 2021, 26(9): 2422. doi: 10.3390/molecules26092422.
[27] Klaiklay S, Sukpondma Y, Rukachaisirikul V, et al. Friedolanostanes and xanthones from the twigs of[J]. Phytochemistry, 2013, 85: 161–166. doi: 10.1016/j.phyto chem.2012.08.020.
[28] FENG D P, DUAN B Z, XIA C L, et al. Study on the chemical constituents of[J]. Chin Trad Pat Med, 2021, 43(8): 2253–2255. [冯丹萍, 段宝忠, 夏从龙, 等. 红花化学成分的研究 [J]. 中成药, 2021, 43(8): 2253–2255. doi: 10.3969/j.issn.1001- 1528.2021.08.051.]
[29] Lee H S, Jeong G S. Aromadendrin inhibits T cell activation via regulation of calcium influx and NFAT activity [J]. Molecules, 2020, 25(19): 4590. doi: 10.3390/molecules25194590.
[30] Elghondakly M, Moawad A, Hetta M. Cytotoxicity and chromatographic analysis of, family Zamiaceae [J]. J Appl Pharm Sci, 2020, 10(12): 75–82. doi: 10.7324/JAPS.2020.101 210.
[31] WU Z X, JANG S N, PARK S Y, et al. Inhibitory potential of bilobetin against CYP2J2 activities in human liver microsomes [J]. Mass Spectrom Lett, 2020, 11(4): 113–117. doi: 10.5478/MSL.2020.11.4. 113.
[32] LEI X Q, CHEN A, LIU Y, et al. Research advances on pharmaco- logical effect of kaempferol [J]. Stu Tra Elem Heal, 2017, 34(2): 61–62. [雷晓青, 陈鳌, 刘毅, 等. 山萘酚药理作用的研究进展 [J]. 微量元素与健康研究, 2017, 34(2): 61–62.]
Chemical Constituents and Antioxidant Activities ofLeaves
QUAN Fan, ZHANG Jian, YAN Jian, LI Ping*
(Laboratory of Tropical Agro-Environment in South China, Ministry of Agriculture and Rural Affairs, College of Resources and Environment, South China Agricultural University,Guangzhou 510642, China)
To study the chemical constituents ofleaves, nineteen compounds were obtained from its leaves by UPLC-QTOF-MS, including bioflavonoids, flavonoids and phloroglucinols. Five compounds were isolated from 80% methanol extract of leaves by chromatographic methods. On the basis of spectral data, they were identified as dihydrokaempferol (1), dulcisbiflavonoid A (2), bilobetin (3), mono-[2- (4-carboxy- phenoxycarbonyl)-vinyl] ester (4) and kaempferol (5). Compounds 1 and 2 were isolated fromfor the first time, while compounds 3 and 4 were isolated from genusfor the first time. Compounds 1 and 5 showed antioxidant activity with IC50of 146.8 and 39.0g/mL, respectively.
; Leaf; Chemical constituent; Flavonoid; Antioxidant activity
10.11926/jtsb.4608
2022-01-17
2022-02-22
国家自然科学基金项目(31800283)资助
This work was supported by the National Nature Science Foundation of China (Grant No. 31800283).
权帆(1997年生),女,硕士研究生,研究方向为植物资源开发及利用研究。E-mail: 15060059695@163.com
. E-mail: liping2016@scau.edu.cn

