超声诊断胎儿生长受限相关胎盘疾病的研究进展
玄英华 张 娜 吴青青 王 莉
胎儿生长受限(fetal growth restriction,FGR)是指胎儿宫内生长未达到其应有的生长潜能,可以累及3%~6%的妊娠[1]。FGR 的定义在不同国家和区域有所不同,较常用的评估标准为超声预估胎儿体质量(EFW)或腹围<相应孕周的第10 百分位数,并需结合子宫动脉和/或胎儿多普勒指标异常。FGR 的主要病因包括母体、胎儿和胎盘因素3个方面,其中胎盘因素是导致FGR 的最主要原因[1]。不同胎盘疾病因其病因、病理基础不同,可以表现出特有的超声征象,但部分病变超声表现可能非常相似。超声可以实时、动态观察,以及多角度灵活扫查胎盘,同时结合彩色多普勒、频谱多普勒、微血流成像等技术,能够对胎盘实质、胎盘基底、胎盘绒毛膜板、脐带插入点及胎盘内血流情况进行较为便捷的检查,可以及时发现胎盘实质内及绒毛膜下出现的异常回声,是诊断胎盘发育异常的常用检查手段。产前及时准确地诊断胎盘异常可以提示FGR的病因,能够很好地降低不良妊娠结局。本文就FGR相关胎盘疾病的发病机制、病理基础,以及其相应超声表现进行综述,旨在为产前准确诊断FGR并及时对FGR病例进行产科管理提供参考依据。
一、胎盘母体血管灌注不良(maternal vascular malperfusion,MVM)相关病变的超声表现
MVM 是导致FGR 的最常见胎盘异常,发生机制为螺旋动脉重塑异常。胎盘形成早期绒毛组织接触底蜕膜,其中的绒毛外滋养细胞填塞子宫螺旋动脉,使其从狭窄的肌性血管转化为宽大的无肌性血管。正常情况下30~40 个螺旋动脉成功完成重塑,并深达肌层。此过程若出现异常,螺旋动脉则仍保留收缩功能,引起母体血流向绒毛间隙灌注受限,继而导致绒毛发育不良。重塑异常的螺旋动脉还容易发生狭窄和血栓,导致胎盘的缺血-再灌注损伤,进一步影响绒毛的正常发育[2]。绒毛发育不良和母体血流灌注不良均会引发胎盘中的母胎营养物质交换表面积减少,导致FGR[3]。MVM的诊断一般包括胎盘形成不良即绒毛退行性变和胎盘血流灌注受损;两种情况均能导致胎盘小[2],此外,前者严重时可以引起典型的胎盘过度膨大,后者可表现为胎盘梗死和胎盘内出血。超声表现为胎盘大小、形态、血流分布及实质回声局部或弥漫性改变。
(一)胎盘大小、形态及血流分布改变
当胎盘厚度>4 cm 或厚度与长度比值>0.5时一般考虑胎盘增厚,提示围产期合并症风险增高。胎盘厚度>第95 百分位数时,出生时小于胎龄儿的风险增高(OR=1.8,P<0.05);高危人群孕19~23 周胎盘形态异常(胎盘增厚、胎盘内出现圆形血肿、楔形高回声、果冻样胎盘)合并双侧子宫动脉异常时发生早发型FGR 的风险增高(OR=4.7,P<0.05)[4]。单脐动脉和脐带边缘附着处也是绒毛退行性变表现,对其进行准确评估可以提高FGR筛查的准确率,但其在低危人群中的价值尚待证实。准确检测FGR 病例胎盘长度、厚度及脐带插入点等,有助于识别MVM,尤其是早发型FGR 合并子宫动脉多普勒异常。上述超声异常表现在FGR 背景下有着诊断价值,但用于筛查FGR 的价值有限[5]。且因正常情况下胎盘大小和形态差异较大,对于低危人群并不推荐通过评估胎盘形态筛查FGR[6]。胎盘内血流分布相关研究结果并不一致。Noguchi 等[7]研究显示,FGR 病例、正常大小胎儿和大于相应孕周胎儿孕18~22 周胎盘血管化指数(VI)、血流指数(FI)及血管化血流指数(VFI)比较差异均无统计学意义。而Wang等[6]研究显示,FGR病例孕早期(孕11~13+6周)胎盘VI、FI 及VFI 均较正常对照组显著降低(均P<0.05)。表明评价FGR 病例胎盘内血流分布的临床意义尚需更多研究深入探讨。
(二)胎盘实质回声改变
胎盘实质回声改变主要包括胎盘血流灌注受损导致的胎盘梗死和出血等局部实质回声改变,以及绒毛退行性变导致的弥漫性实质回声改变。需注意的是,不同胎盘病灶的围产期风险取决于有功能的正常胎盘组织数量,并结合子宫动脉和脐动脉多普勒表现[4]。
1.胎盘梗死:合并子宫动脉阻力异常的早发型FGR 病例中,80%表现为多灶性胎盘梗死,提示胎盘功能组织的大量丢失[4]。但20%无并发症的妊娠,以及40%~70%轻度或重度子痫前期病例也可表现为胎盘梗死[8]。螺旋动脉重塑异常可以导致纤维蛋白样坏死、粥样硬化性管腔狭窄及血管内血栓形成等蜕膜血管病变,这些变化均会造成不稳定高速血流,导致缺血再灌注损伤,破坏胎盘结构,使绒毛节段发生局灶性梗死。因梗死灶呈实性,与正常胎盘组织相似,超声不易检出。胎盘梗死典型的超声表现为胎盘基底部的高回声(图1),但其阳性预测值仅为33%[4]。Hernandez-Andrade 等[8]通过综述以往文献总结发现,胎盘梗死的超声表现除实性回声外,还可表现为胎盘内未探及血流信号的无回声区(图2)。无回声区内无细点状回声蠕动需与血池相鉴别。

图1 孕31周胎盘梗死声像图

图2 胎盘梗死声像图
2.圆形胎盘内血肿/胎盘梗死血肿:是指不同于绒毛间血栓的另一种胎盘内出血病灶,通常位于胎盘基底板附近(与底蜕膜相邻的胎盘部分),其超声表现为病灶呈圆形,周边常包绕被挤压梗死的胎盘组织[9]。当超声表现为胎盘内不规则低回声区,边缘高回声带内未探及血流信号,则高度提示胎盘梗死血肿,见图3[8]。胎盘梗死血肿形成原因是螺旋动脉阻塞导致胎盘梗死,随后螺旋动脉再通导致血肿[10]。而有学者[9]认为蜕膜血管病变导致的出血(与胎盘后出血相对应的胎盘内出血)是其形成原因,突发的出血至绒毛间隙,形成血肿,被挤压的周边绒毛组织限制血肿的扩散,并逐渐发生梗死。圆形胎盘内血肿常合并MVM 的其他病理改变,伴有子痫前期和妊娠期高血压等,提示圆形胎盘内血肿是MVM 相关病变[9,11]。胎盘梗死血肿与慢性高血压、子痫前期、妊娠期糖尿病、FGR、早产及胎儿死亡均相关[9,12]。Neville等[9]研究显示26例圆形胎盘内血肿病例中21.4%发生了围产期死亡,60.7%合并FGR,17.9%发生胎盘早剥。

图3 圆形胎盘内梗死血肿声像图
3.绒毛间血栓:是指胎盘血池内形成的血栓,组织学表现为分层状血栓;单发的绒毛间血栓无功能上的意义,多发时可能导致FGR,其超声表现为胎盘内低至无回声区,周边有高回声环绕,见图4[4]。
4.绒毛退行性变导致的胎盘弥漫性改变:绒毛退行性变是指胎盘早期形成障碍,叶状绒毛膜形成差,着床面积减少,后期逐渐形成小胎盘和单脐动脉等[4]。有研究[13]应用超微血流成像(superb micro-vascular imaging,SMI)技术观察胎盘增厚合并FGR 病例的胎盘内微血流分布,结果发现与正常胎盘比较,增厚胎盘内绒毛树稀少,绒毛干血管变直,分叉少,尤其初级绒毛干血管增粗变直。此外,严重绒毛发育不良可以导致胎盘实质弥漫性病变,超声表现为胎盘呈球状增大,胎盘实质回声明显减少,呈现大面积血池样改变,随探头晃动,胎盘内可见细点状回声蠕动,呈果冻样胎盘(图5)。形成原因为锚定绒毛进行性断裂造成胎盘内大量母体血液充盈,此种胎盘过度胀大是严重MVM 的特征性表现。组织学表现为远端绒毛的发育不全,即气体交换绒毛形成不良,覆盖远端绒毛的合体滋养细胞层变薄,表面出现多核体结节,其下细胞滋养细胞减少,即新的合体滋养细胞停止形成[4]。临床上,大多数早发型FGR产后病理显示的MVM 产前合并双侧子宫动脉阻力增高,舒张早期出现切迹[14]。但需注意在严重MVM 胎盘过度胀大的病例中,因经胎盘气体运输受损水平位于远端绒毛(气体交换绒毛),子宫动脉多普勒多表现为正常,合并子痫前期的风险低[2]。

图5 孕22+5周严重绒毛退行性变声像图
二、超声诊断胎盘绒毛周围纤维蛋白大量沉积(massive perivillous fibrin deposition,MPVFD)和慢性组织细胞性绒毛间炎(chronic histiocytic intervillositis,CHIV)的价值
MPVFD 和CHIV 是罕见的胎盘病变,两者可以共存,均与严重FGR 显著相关,MPVFD 甚至可在无明确既往高危因素的情况下导致胎死宫内[8]。MPVFD 又称为母体面梗死,严重的MPVFD 患病率在总体分娩中不超过0.5%[15],发生率为妊娠总数的0.09%[8]。MPVFD 病理特点为从胎盘基底部到绒毛膜下绒毛间隙纤维蛋白和纤维蛋白样物的广泛沉积[15]。被包埋的绒毛发生纤维化,无血供,胎盘结构受损,导致胎盘功能异常,进而导致FGR[8]。MPVFD 超声表现为早发型FGR 背景下胎盘实质回声弥漫不均[2],可见多个囊性低回声区,周边为高回声区,其内可探及低速血流,胎盘增大(图6),以及脐动脉阻力增高,而子宫动脉血流通常无异常[4,8]。胎盘病理显示EFW<第10 百分位数的病例中,中至重度MPVFD 的发生率为11.8%[15]。Lampi等[16]回顾性研究141例MPVFD 病例发现,重度MPVFD(纤维蛋白沉积范围>50%)病例中活产儿发生FGR占72.3%,明显高于中度MPVFD(纤维蛋白沉积范围33%~50%)病例(34.2%)和轻度MPVFD(纤维蛋白沉积范围20%~32%)病例(52.2%)。重度、中度及轻度MPVFD病例中胎死宫内发生率分别为31.3%、15.8%及8.5%。CHIV 是指绒毛间隙内母体单核细胞的浸润,4.4%孕早期自然流产标本中及0.06%孕中晚期分娩的胎盘中可以发现CHIV。CHIV 超声表现为胎盘变小增厚、胎盘内部回声异常、胎盘内高回声环绕的囊性回声,脐动脉及子宫动脉阻力高等[17]。CHIV病例中FGR占比为17%~83%[8,15],Koby等[17]研究显示,CHIV 病例中FGR 占比高达92%。MPVFD 和CHIV两者复发率均较高(30%~70%)[18]。妊娠时母体自身免疫疾病可以导致此异常,也是日后妊娠中再发风险高的原因。Spinillo等[15]研 究 显 示,与 未 合 并MPVFD 的FGR 病 例 比 较,合 并MPVFD 的FGR 病例发生胎儿血管灌注不良的风险增高,可能与母体自身免疫异常相关。

图6 MPVFD 声像图
三、超声诊断胎盘绒毛膜板下出血(massive subchorionic hematoma,MSH)的价值
较大范围的MSH 又称Breus’mole,是指绒毛膜板和叶状绒毛膜间形成血肿,其厚度>1 cm,发生率为0.03%~0.08%[1]。其病因及发病机制目前尚不清楚。出血大部分来源于母体,也有由胎儿绒毛出血导致MSH 的报道[19]。MSH 对妊娠的影响程度取决于血肿的大小及发生部位。若位于脐带插入点附近,可压迫脐带,影响脐静脉回流和脐动脉灌注,导致FGR 及胎死宫内。MSH 常合并FGR、子痫前期、胎死宫内等[20-21],也有男性胎儿合并尿道下裂的报道[22]。Yanagisawa 等[20]研究发现MSH 病例的胎儿预后不良,平均分娩孕周29.9 周,胎儿存活约占53.5%,55.5%的病例合并FGR。Alanjari 等[21]将胎儿存活的MSH 病例与胎儿未能存活的MSH 病例进行比较,结果显示胎儿生长正常及脐动脉多普勒正常等因素与胎儿存活相关。
MSH 超声表现为孕中晚期邻近绒毛膜板(即胎盘子面)出现均匀或不均匀血肿回声,与正常胎盘组织有分界;也可表现为液-液水平,此征象各孕期均可持续存在或短暂出现,形成原因可能是出血后的沉淀效应,部分成分为凝血块(纤维素12),余成分为液体,孕妇静卧一段时间后即可观察到该分层(图7),出现液-液水平可进一步支持MSH 的诊断[20]。MSH 与母体和胎儿不良预后相关,诊断后应加强对孕妇及胎儿的监测,必要时及时终止妊娠,改善预后。

图7 孕23+1周MSH声像图
四、超声诊断三倍体相关胎盘异常的价值
三倍体的特点为胎儿多了一组额外的染色体,额外的一组染色体的来源比例各文献报道不同,父系来源占20%~85%[23]。三倍体为致死性异常,多数在孕早末期发生自然流产,孕10~12周的患病率为0.03%,而孕16~20 周时患病率为0.002%[24-25]。三倍体可以分为2种表型,大致对应于不同的染色体来源,Ⅰ型为父源性三倍体表型:轻度FGR,头部比例正常或呈轻度的小头畸形,部分性葡萄胎,胎盘增大呈囊性变(图8)[25];Ⅱ型母源性三倍体表型:严重的不对称型FGR,头大,胎盘小(图9)[24-25]。Zalel 等[24]研究显示孕12~16 周25 例三倍体病例中,胎盘呈囊性变4例,不对称型FGR 21例;Massalska等[23]研究分析了67例三倍体的超声表现,85.1%的病例出现FGR;19.4%的病例出现胎盘异常,包括胎盘呈囊性、胎盘增大或明显小;11.9%的病例符合父源性表型,70.2%符合母源性表现,而17.9%的病例中无法确定表型的类型。符合父源性表型的病例均出现胎盘呈囊性或增大,而母源性表型均出现不对称型FGR,8.5%的病例出现胎盘小。而近期Lugthart 等[25]对120 例三倍体病例研究则显示,82.1%的病例发生FGR;32.5%的病例出现胎盘异常,18.3%的病例出现胎盘囊性变。母源性三倍体的特点为不对称型FGR(96.9%),胎盘薄(40.6%),人绒毛膜促性腺激素(β-hCG)及妊娠相关蛋白-A 水平均显著降低;父源性三倍体的特点为胎盘葡萄胎样变(胎盘增大或水肿和/或胎盘出现多发囊性回声,占85.7%),β-hCG 显著增高,42.9%病例中为对称型FGR。总之,临床根据其超声表现和母体血清学指标,即可准确判断多余一组染色体的来源。40%的三倍体胎儿并未表现出明显的结构异常,且无创DNA 检查不能排除三倍体,也不能提供母体血清学信息,此时临床需仔细观察胎儿生长情况及胎盘情况以评估三倍体的风险[25]。

图8 孕12.5周父源性三倍体相关胎盘异常声像图
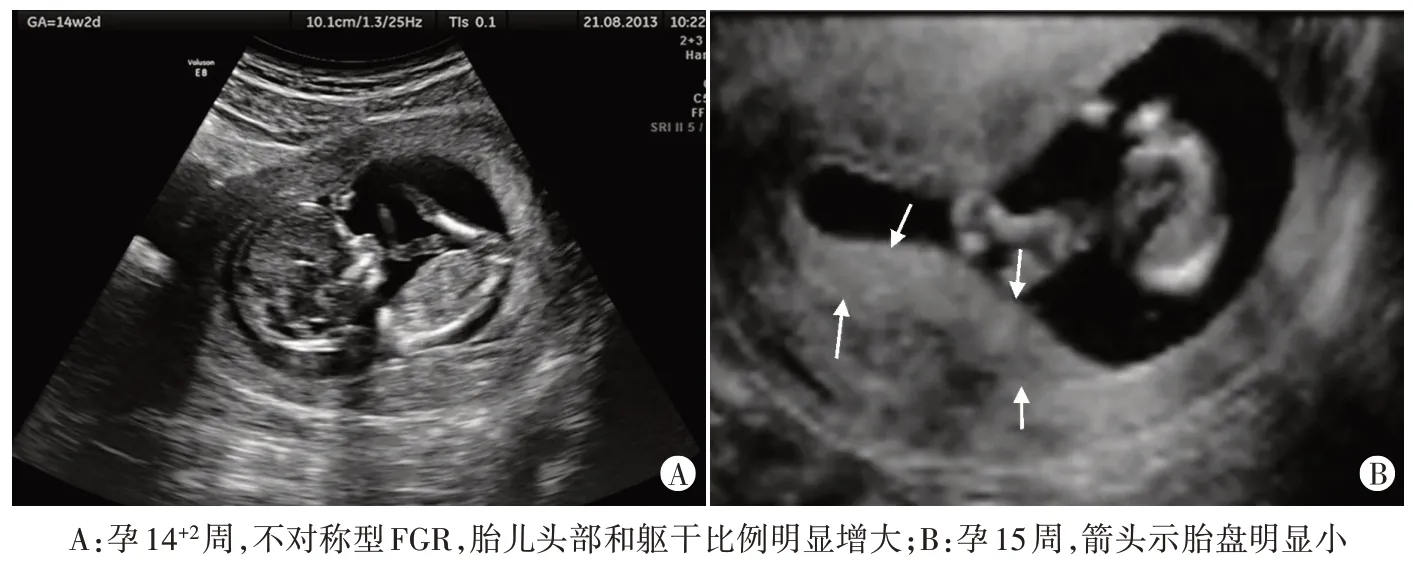
图9 母源性三倍体相关胎盘异常声像图
五、超声诊断胎盘间叶发育不良(placental mesenchymal dysplasia,PMD)的价值
PMD 临床罕见,发生率为0.02%,多见于女性胎儿[26]。其表现为较大囊性结构的扩张绒毛血管;实质内另可见迂曲呈黏液瘤样的干绒毛及葡萄样绒毛水泡,内含无色黏液,病理特点为胎盘增大,绒毛膜板及干(锚定)绒毛内血管扩张迂曲,绒毛水肿形成葡萄状水泡[26]。PMD 发病原因尚未明确,可能为11p15.5区基因印迹不平衡和部分病例中父源性/双亲源性基因镶嵌[27]。Kodera等[28]多中心研究显示47例PMD病例中,72.3%出现FGR;Nayeri 等[29]研究显示61 例PMD 病例中,33%合并FGR,且PMD 超声多表现为胎盘呈囊性变(80%),胎盘增大和/或增厚(50%)和/或伴有绒毛膜血管扩张(16%)。Ohira 等[30]总结了110例PMD超声图像特征,其中44例产前超声表现为胎盘囊性变,约70%的病例于孕13~20 周检出;48 例表现为胎儿绒毛血管扩张,且90%的病例于孕晚期检出,55%的病例于孕36周后检出;CDFI 表现为“彩玻璃征”,即量程调低时,扩张绒毛血管内不同方向和流速的血流充盈胎盘囊性病灶,为PMD的彩色多普勒特征表现[31]。探查到此征象即可排除葡萄胎和部分性葡萄胎等胎盘囊性疾病,Ohira 等[30]还指出某些PMD 病例中早期出现的胎盘囊性变随孕周的进展减少或消失。所以即使囊性病灶消失也不能排除PMD。PMD 超声表现为胎盘囊性病灶位于绒毛膜板下,彩色多普勒于囊性病灶内可探及血流信号充盈。此外,PMD可伴有母体血清甲胎蛋白水平增高(83.3%),部分病例(17.8%)会出现β-hCG 的一过性增高[29],这也是PMD 与双胎之一葡萄胎和部分性葡萄胎的鉴别要点。
PMD除了与FGR相关外,还与其他不良妊娠结局如先兆早产、胎死宫内、妊娠期高血压、先兆子痫等相关,38%的病例合并胎儿结构异常,19%~23%的病例合并Beckwiths-Wiedemann综合征[28-29,31]。PMD的诊断需结合超声表现、血β-hCG、染色体核型分析等。
六、总结
总之,FGR相关的胎盘疾病包括很多种,但因病理基础不同而具有各自超声表现,如熟悉相关表现,再结合孕妇病史及实验室检查指标可做出准确诊断,必要时可行遗传学检查排除三倍体和胎儿基因异常。超声检查时受到胎盘附着位置及子宫收缩等的影响,可能导致测量厚度时产生误差、胎盘回声显示失真、后壁胎盘探查受限等,因此建议动态测量和观察胎盘的厚度及内部回声,可待孕妇休息后再次探查,避免出现假阳性、假阴性结果,为临床产科医师的正确处理和改善母儿预后提供准确的参考依据。

