竹节参总皂苷通过HMGB1/TLR4/NF-κB信号通路改善游离脂肪酸诱导肝细胞脂肪变性的实验研究*
高明生 姚 勇 奉 镭
遂宁市中心医院消化内科 (四川 遂宁, 629000)
非酒精性脂肪性肝病(NAFLD)是一种常见的慢性肝病,与肥胖、糖尿病等代谢性疾病的高患病率密切相关[1]。NAFLD的早期特征是在没有大量饮酒的情况下,三酰基甘油积聚(>5%~10%的肝细胞),随着疾病进展可能会发展为非酒精性脂肪性肝炎(NASH),并在晚期发展为肝硬化和肝细胞癌[2]。游离脂肪酸(FFA)具有脂毒性,其代谢异常可引起肝细胞脂质沉积,损伤肝细胞器及胰岛素通路[3]。研究显示,NAFLD患者血中FFA水平高于健康人群,FFA与NAFLD病变程度有关[4]。据文献报道,FFA可诱导肝细胞脂质变性,其可作为NAFLD的体外细胞模型,对NAFLD的发病机制研究有重大意义[5]。竹节参为五加科草本植物,现代药理学发现其具有降血脂、抗氧化、抗炎等功效,可改善糖脂代谢,竹节参总皂苷(TSPJ)是其主要活性成分[6]。TSPJ已被证实不仅能够通过抑制炎症发生改善NASH,还能通过靶向雌激素β受体改善HepG2细胞脂质积累[7,8],但其有关的机制研究仍然匮乏。研究表明,高迁移率族蛋白1(HMGB1)和Toll样受体4(TLR4)与炎症和肝功能衰竭密切相关,HMGB1能够激活核因子-κB(NF-κB),并通过TLR4和B受体晚期糖化终产物促进炎症反应发展[9]。目前,TSPJ能够改善小鼠NAFLD[10],但其是否与HMGB1信号通路相关尚不明确。基于此,本研究通过FFA诱导肝癌细胞HepG2构建肝细胞脂肪变性模型,探讨TSPJ对脂质代谢的调节作用及分子机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞 人肝癌细胞HepG2,武汉大学中国典型培养物保藏中心。
1.1.2 药物及制备 竹节参(湖北恩施竹节参种植基地),经鉴定为五加科人参属植物竹节参干燥根茎。粉碎为粗粉,以1∶10的比例加入60%乙醇,浸泡2 h,加热后回流提取,将所得提取液浓缩至无醇后,加水离心,所得上清经正丁醇萃取,减压浓缩,获得正丁醇浸膏。加水,过D101大孔树脂,采用水、10%、30%、60%、90%乙醇依次冲洗,洗脱流量为1 ml/min。将各洗脱部位减压浓缩,真空干燥,得10%、30%、60%、90% TSPJ洗脱部位,低温保存。使用前,称取10 mg TSPJ洗脱提取物,DMSO(100 μl)溶解,加PBS 900 μl,配置成10 mg/ml母液。
1.1.3 主要试剂与仪器 HMGB1、TLR4、NF-κB及GAPDH兔多克隆抗体(ab18256、ab150583、ab16502、ab9485)、Oil Red O Stain试剂盒(ab150678),英国abcam公司;TRIzol试剂(15596026)、Revert aidTM First Strand cDNA Synthsis Kit(K1622)、LipofectamineTM2000试剂盒(11668019),美国Thermo公司。
1.2 方法
1.2.1 细胞培养 在DEME培养液(含1%青链霉素混合液、10%胎牛血清)中培养HepG2细胞,培养条件:37℃、5%CO2,细胞生长至80%~90%时,胰蛋白酶(0.25%)消化。
1.2.2 不同浓度TSPJ及FFA对HepG2细胞毒性检测 将对数生长期HepG2细胞接种于96孔板,用DMEM培养基稀释出不同浓度(0.25、0.5、1.0、2.0 mmol/L)的FFA(油酸:棕榈酸=2∶1)诱导剂,TSPJ同样采用DMEM培养基稀释为不同浓度12.5 μg/ml、25 μg/ml、50 μg/ml、100 μg/ml。HepG2细胞贴壁后,分别加入100 μl含不同浓度FFA及TSPJ的培养基,孵育24 h,加入10 μl CCK8溶液,孵育1~4 h,酶标仪测定450 nm处吸光度(A)。计算细胞存活率(%)=(实验组A值/对照组A值)×100%。
1.2.3 siRNA设计及合成 根据GenBank中HMGB1 mRNA全长序列,以pGPU6/GFP/Neo为载体,设计HMGB1干扰靶序列质粒,并构建非特异性序列质粒为阴性对照(HMGB1 p-NC),不同siRNA序列及阴性对照序列见表1,均由上海吉凯公司合成。

表1 HMGB1的不同siRNA序列和阴性对照序列
1.2.4 脂质体转染及鉴定 HepG2细胞以2×105个/ml接种于6孔板,细胞生长至56%~60%时,采用LipofectamineTM2000试剂盒将HMGB1 siRNA1、HMGB1 siRNA2、HMGB1 siRNA3及HMGB1 p-NC转染HepG2细胞,记为HMGB1 siRNA1组、HMGB1 siRNA2组、HMGB1 siRNA3组及HMGB1 p-NC组。转染6 h后更换培养液,孵育48 h~72 h,荧光显微镜下随机选择5个视野,观察各组HepG2细胞绿色荧光蛋白表达水平,计算转染效率。转染效率=暗视野绿色荧光细胞数/明视野细胞数×100%。
1.2.5 细胞分组 HepG2细胞分为7组,对照组(未处理)、FFA组(0.5 mmol/L FFA处理)、FFA+HMGB1 p-NC组(0.5 mmol/L FFA处理+HMGB1 p-NC转染)、FFA+HMGB1 siRNA组(0.5 mmol/L FFA处理+HMGB1 siRNA2转染)、FFA+TSPJ组(0.5 mmol/L FFA+50 μg/ml TSPJ处理)、FFA+pcDNA+TSPJ组(0.5 mmol/L FFA+pcDNA转染+50 μg/ml TSPJ处理)、FFA+HMGB1 pcDNA+TSPJ组(0.5 mmol/L FFA+HMGB1 pcDNA转染+50 μg/ml TSPJ处理)、FFA+HMGB1 p-NC+TSPJ组(0.5 mmol/L FFA+HMGB1 p-NC转染+50 μg/ml TSPJ处理)、FFA+HMGB1 siRNA+TSPJ组(0.5 mmol/L FFA+HMGB1 siRNA2转染+50 μg/ml TSPJ处理)。
1.2.6 细胞内脂质蓄积情况观察及脂质水平测定 取0.5 g油红O粉末,100 ml异丙醇溶解过夜,并与三蒸水3∶2体积混合,过滤,得工作液。弃培养基,PBS洗涤,4%多聚甲醛固定,PBS洗涤。加油红O工作液,染色15 min,PBS洗涤,显微镜下观察脂质蓄积情况,并拍照。观察结束,每孔加200 μl异丙醇,振摇脱洗,洗脱液置于96孔板,酶标仪检测450 nm处A值。A值越大,脂质水平越高。
1.2.7 细胞内TG含量检测 使用裂解液裂解1.2.5中各组HepG2细胞,12 000 r/min、4℃离心10 min,取上清,采用分光光度法测定各组细胞TG含量,按照TG含量测试盒说明书操作。
1.2.8 qRT-PCR法检测HepG2细胞HMGB1 mRNA水平 TRIzol试剂提取各组HepG2细胞总RNA,检测浓度及纯度,逆转录为cDNA,利用cDNA配置qRT-PCR反应体系。荧光定量PCR仪上扩增,2-△△Ct法计算HMGB1 mRNA相对表达量,筛选最有效的HMGB1 siRNA干扰序列。HMGB1上游引物:5′-AATAGGAAAAGGATATTGCT-3′,下游引物5′-GCGCTAGAA-CCAACTTATGA-3′;TLR4上游引物:5′-AGTGGCTGGATTTA-TCCAGGTGTG-3′,下游引物5′-TTGAGAGGTGGTGTAAGCC-ATGCC-3′,NF-κB上游引物:5′-ACACGAGGCTACAACTCTGC-3′,下游引物:5′-GGTACCCCCAGAGACCTCAT-3′;内参GAPDH上游引物:5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物:5′-AGGGGCCATCCACAGTCTTC-3′。
1.2.9 HMGB1通路相关基因蛋白水平检测 RIPA裂解液充分裂解各组HepG2细胞,冰浴,提取总蛋白,BCA法检测蛋白浓度。10% SDS-PAGE分离蛋白,转至PVDF膜,脱脂奶粉封闭2 h,加入GAPDH、HMGB1、TLR4、NF-κB一抗(1∶1 000),4℃过夜,TBST洗膜3次,加二抗(1∶3 000),室温孵育1 h,TBST洗膜3次,加入ECL显色、成像,扫描各蛋白条带灰度值并分析。

2 结果
2.1 不同浓度FFA、TSPJ细胞毒性 HepG2细胞经不同浓度FFA处理24 h后,0.25 mmol/L、0.5 mmol/L FFA组HepG2细胞存活率(97.36±2.17)%、(96.48±2.26)%与对照组(100.00%)比较,差异无统计学意义(P>0.05),1.0 mmol/L、2.0 mmol/L FFA组HepG2细胞存活率分别为(72.59±5.42)%、(31.27±3.86)%,较对照组分别下降27.41%、68.73%,差异具有统计学意义(P<0.05)。因此选择0.5 mmol/L FFA为最佳诱导浓度。
HepG2细胞经不同浓度TSPJ处理24 h后,12.5 μg/ml、25 μg/ml、50 μg/ml TSPJ组HepG2细胞存活率(95.89±2.94)%、(94.65±3.06)%、(93.71±2.85)%,与对照组比较,差异无统计学意义(P>0.05),100 μg/ml TSPJ组HepG2细胞存活率为(64.82±5.17)%,较对照组降低35.18%(P<0.05),因此选择50 μg/ml TSPJ为最佳诱导浓度。
2.2 HMGB1 siRNA有效干扰序列筛选 HMGB1干扰质粒转染HepG2细胞基因转染24 h、48 h、72 h,荧光倒置显微镜下激发波长480 nm,发射波长500 nm,观察绿色荧光,结果显示转染48 h后荧光最强,转染效率最高(约71%),此时开始进行筛选。
HMGB1 siRNA1、HMGB1 siRNA2、HMGB1 siRNA3组HMGB1 mRNA及蛋白水平与对照组比较,差异均有统计学意义(P<0.05);HMGB1 p-NC组HMGB1 mRNA及蛋白水平与对照组比较,差异无统计学意义。见图1、2。HMGB1 siRNA2组HMGB1沉默效果最佳,选择HMGB1 siRNA2为有效干扰序列。
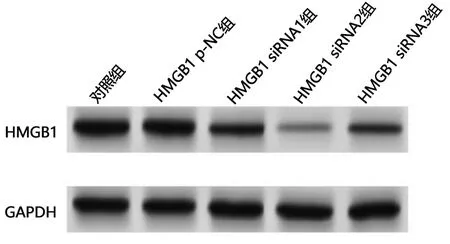
图1 Western blot检测不同HMGB1 siRNA质粒沉默后HepG2细胞中HMGB1蛋白的表达情况
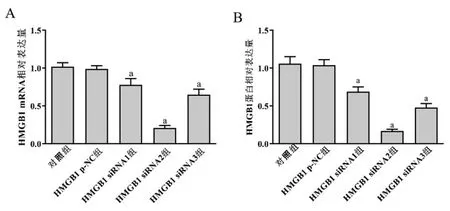
图2 HepG2细胞中不同HMGB1 siRNA质粒沉默HMGB1的表达情况 与对照组比较,aP<0.05
2.3 TSPJ对FFA诱导的HepG2细胞脂质蓄积及TG含量的影响 见表2、图3。

图3 油红O染色观察各组HepG2细胞脂质蓄积 (×400)

表2 TSPJ对FFA诱导的HepG2细胞脂质蓄积及TG含量的影响
2.4 干扰HMGB1对FFA诱导的HepG2细胞脂质蓄积及TG含量的影响 见图4、表3。
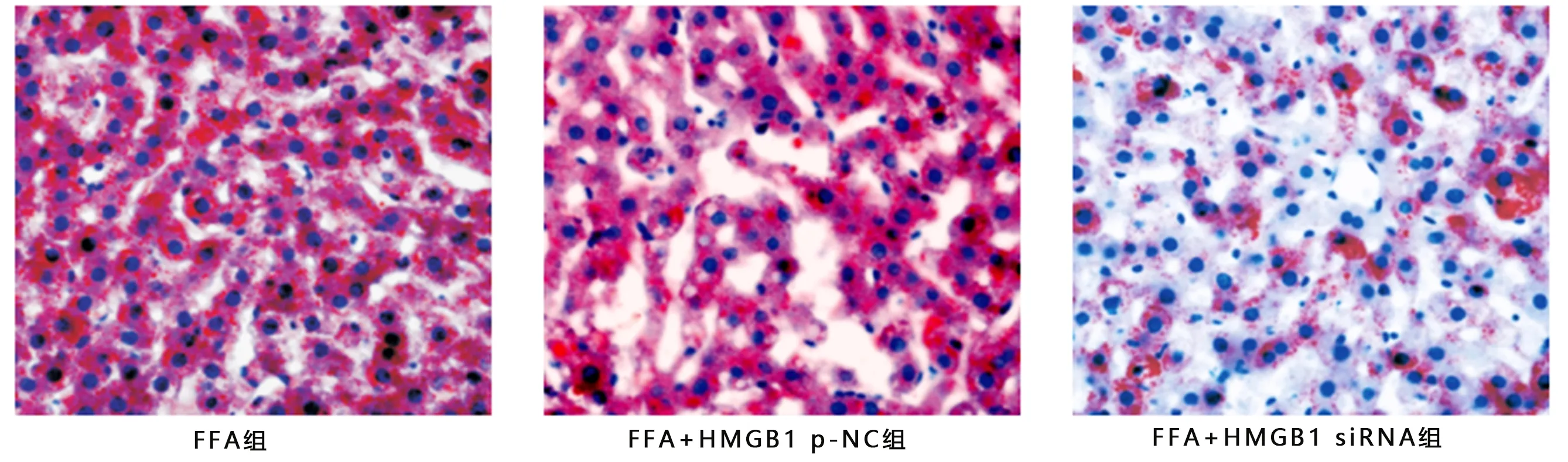
图4 油红O染色观察各组HepG2细胞脂质蓄积 (×400)
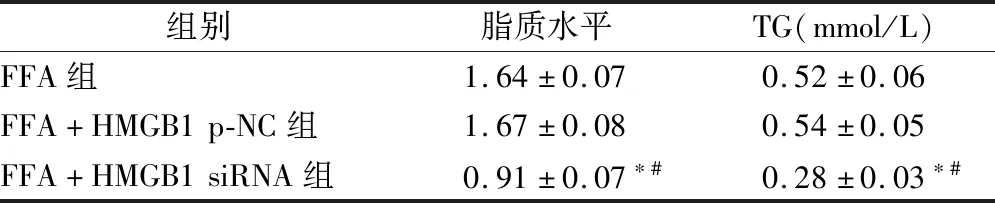
表3 干扰HMGB1对FFA诱导的HepG2细胞脂质蓄积及TG含量的影响
2.5 过表达HMGB1对TSPJ处理的FFA诱导的HepG2细胞脂质蓄积及TG含量的影响 见图5、表4。

图5 油红O染色观察HepG2细胞脂质蓄积的影响 (×400)
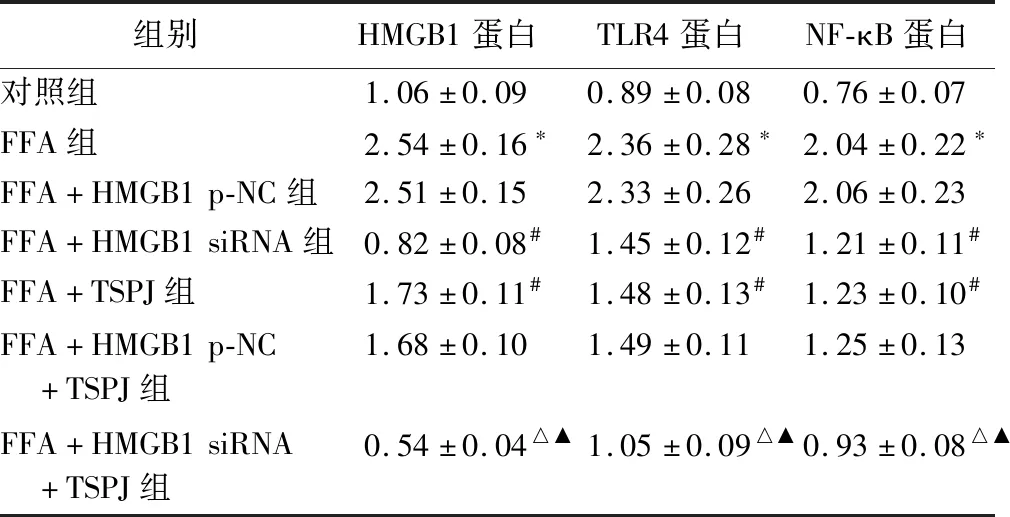
表4 TSPJ对FFA诱导的HMGB1、TLR4、NF-κB蛋白表达的影响

表4 过表达HMGB1对TSPJ处理的FFA诱导的HepG2细胞脂质蓄积及TG含量的影响
2.6 TSPJ对FFA诱导的HepG2细胞HMGB1通路相关基因蛋白表达的影响 见图6、图7、表4。

图6 Western blot检测各组HepG2细胞HMGB1、TLR4、NF-κB蛋白表达

图7 qRT-PCR检测各组HepG2细胞HMGB1、TLR4、NF-κB mRNA表达
3 讨论
NAFLD发病率随着近年来饮食习惯、生活方式的改变而迅速增加,肝细胞脂质过度沉积、脂肪变性是NAFLD的主要病理特征[11]。“多次打击学说”是目前NAFLD较为公认的发病机制,“第一次打击”以胰岛素抵抗为主,肝脏发生脂肪变性;“第二次打击”中肝细胞内发生内质网应激、过氧化应激、炎症级联反应及肠道衍生内毒素等;“第三次打击”中,肝脏免疫紊乱,从而引发肝细胞缺血坏死、肝纤维化、肝硬化等[12]。因此可知,NAFLD主要由肝脏脂质代谢异常引发的肝细胞脂质(TG过度沉积)聚积导致[13]。NAFLD细胞模型主要包括诱导多能肝细胞、永生细胞系、原代肝细胞等,因永生细胞系表型稳定、生长稳定、易于标准化及无限寿命等特点,是构建NAFLD细胞模型的最佳选择[14]。HepG2细胞作为永生细胞系具有永生化、表型稳定、易于操作等特点,因此本研究选取HepG2细胞进行研究。FFA可在信号分子转导、细胞膜合成、能量储存等过程中发挥重要作用,其代谢失调可导致肥胖、肝脏脂肪变性、高血脂、胰岛素抵抗、动脉粥样硬化等疾病[15]。本研究中,采用FFA处理HepG2细胞后,HepG2细胞脂滴数增加,脂质及TG水平均显著增加,与Lee等[16]和Long等[17]的研究结果一致,提示体外肝脏脂肪沉积模型构建成功。
竹节参是中国西南地区常见中草药,兼具南药三七及北药人参的作用。TSPJ为竹节参主要活性成分,能够改善由化学药品、高脂饮食等引发的肝损伤。研究发现,TSPJ作用于高糖高脂饮食小鼠,可能通过调节miR-199a-5p/ATG5信号通路改善NASH炎症反应,调节自噬[7]。本研究中,TSPJ干预后,NAFLD模型细胞脂滴数减少,脂质及TG水平降低,这与TSPJ在NAFLD小鼠模型中的作用一致[18],提示TSPJ可减少脂质蓄积,进而影响NAFLD疾病进展,但其具体作用机制尚不明确。
HMGB1是一种丰富的结构染色体蛋白,具有多种生物学功能:基因转录、DNA复制、DNA损伤修复和炎症细胞信号传导等[19]。HMGB1参与肝脏纤维化、炎症及损伤等过程,在NAFLD、肝细胞癌、肝缺血/再灌注损伤中发挥重要作用[20]。Lai等[21]研究发现,抑制HMGB1表达可抑制棕榈酸诱导的原代肝细胞和HepG2细胞TG水平。此外,在肝损伤或肝坏死等病理情况下,HMGB1可激活NF-κB通路,维持机体炎症环境,从而导致组织损伤[22]。研究还发现,HMGB1为TLR4上游信号分子,HMGB1可通过TLR4通路影响肝脏炎症反应[23]。有研究指出,TSPJ对于肝脏损伤引发的炎症反应具有良好的治疗效果,这很可能与抑制HMGB1的表达有关[24]。同时刘正泰等[25]研究发现,TSPJ可能通过调控TLR4/NF-κB信号通路改善大鼠脂肪细胞排列及脂肪组织炎症。与上述研究类似的是,经0.5 mmol/L FFA处理的HepG2细胞,HMGB1蛋白、mRNA水平及TLR4、NF-κB蛋白水平升高,提示FFA可调控下游HMGB1通路发挥作用;而抑制HepG2细胞HMGB1表达后,FFA诱导的HepG2细胞的脂质水平、TG含量及TLR4、NF-κB蛋白水平均降低,提示HMGB1表达下调可抑制下游TLR4/NF-κB通路激活,从而缓解炎症、减少肝脏脂质积累,对改善NAFLD有一定帮助。采用TSPJ干预后可降低HepG2细胞HMGB1蛋白、mRNA水平及TLR4、NF-κB蛋白水平,TSPJ与HMGB1 siRNA联用,与HMGB1 siRNA单独干预比较,可进一步降低上述因子的表达;TSPJ与HMGB1 pcDNA联用,与TSPJ单独干预比较,肝细胞炎症加重,脂质积累增加;提示TSPJ可能通过抑制HMGB1/TLR4/NF-κB通路改善肝细胞变性,从而缓解NAFLD。

